利奈唑胺相关血小板减少症的危险因素分析及其风险预测模型的建立
2021-09-24刘彦鑫刘婷婷魏歌闫鹏方向群解立新1
刘彦鑫,刘婷婷,魏歌,闫鹏,方向群*,解立新1,*
1解放军医学院,北京 100853;2解放军总医院第二医学中心呼吸与危重症医学科,北京 100853;3解放军北京卫戍区海淀第十七退休干部休养所,北京 100143;4解放军总医院呼吸与危重症医学部,北京 100094
利奈唑胺是一种人工合成的新型 唑烷酮类抗菌药物,广泛用于治疗革兰阳性菌感染[1],包括耐甲氧西林金黄色葡萄球菌(MASA)、耐万古霉素金黄色葡萄球菌(VRSA)、耐万古霉素肠球菌(VRE)等[2]。利奈唑胺最常见的不良反应为可逆性的骨髓抑制,包括贫血及血小板减少,其中血小板减少症的发生率为13.8%~60.5%[3-5]。利奈唑胺相关血小板减少症与不良预后密切相关,包括器官衰竭、住院时间延长及病死率增高等[6-7]。既往研究发现,利奈唑胺相关血小板减少症的危险因素有肾脏损害[8-13]、慢性肝脏疾病[14]、利奈唑胺使用时间较长[11-13,15]及基线血小板计数减少[9,13,16-17]等。但上述研究的样本量均偏少,结果存在一定偏倚,且尚未建立利奈唑胺相关血小板减少症的有效预测模型。本研究拟纳入近10年使用利奈唑胺抗感染患者的资料,分析利奈唑胺相关血小板减少症的发生情况及危险因素,并建立预测模型,以期能早期预测利奈唑胺相关血小板减少症的发生,尽量实施早期干预。
1 资料与方法
1.1 一般资料 选取解放军总医院第一医学中心7个重症监护室2010年1月-2020年12月使用利奈唑胺治疗感染的患者。纳入标准:(1)年龄≥18岁;(2)使用利奈唑胺抗感染。排除标准:(1)基线血小板计数<100×109/L;(2)同时使用影响血小板的药物,如化疗药物或替加环素等;(3)未定期监测血常规等指标;(4)合并血液系统疾病;(5)利奈唑胺使用时间<3 d;(6)预计生存时间<7 d;(7)妊娠或哺乳期;(8)对利奈唑胺过敏;(9)行手术治疗、有创伤或大出血(300 ml/次或500 ml/d);(10)合并凝血功能紊乱。本研究经解放军总医院伦理委员会批准(S2020-141-01号)。
1.2 研究方法 利用医院信息管理病例检索系统,从医疗健康电子数据库用药医嘱中,以利奈唑胺注射液或利奈唑胺片为索引筛选出用利奈唑胺治疗过的患者1391例,按纳入及排除标准,最终纳入796例患者进行研究。收集患者的基本特征[性别、年龄、体重指数(BMI)、感染部位、基础疾病、联合使用的抗生素、治疗方案、利奈唑胺使用时长],以及基线实验室指标(血常规、总蛋白、白蛋白、肝肾功能及炎性指标等)。利奈唑胺(辉瑞制药有限公司),注射液规格:0.6 g,300 ml;片剂规格:0.6 g。利奈唑胺使用方案:口服或静脉,0.6 g/次,2次/d。血小板减少症定义为出现血小板计数<100×109/L或与基线血小板计数相比下降超过30%[3]。
根据是否发生血小板减少症,将本组796例患者分为血小板减少组(n=228)与非血小板减少组(n=568)。比较两组一般资料,分析利奈唑胺相关血小板减少症的危险因素,根据危险因素的OR值计算患者各项危险因素的评分,将各危险因素评分值相加为综合危险评分[17]。建立奈唑胺相关血小板减少症风险预测模型,并评估其效能。
1.3 统计学处理 应用SPSS 23.0软件进行统计分析。正态分布的计量资料以±s表示,组间比较采用t检验。非正态资料以M(Q1,Q3)表示,组间比较采用Mann-WhitneyU检验。计数资料以例(%)表示,组间比较采用χ2检验。利奈唑胺相关血小板减少症的危险因素采用logistic回归分析,模型效能的评估采用受试者工作特征(ROC)曲线。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者一般资料比较 两组患者的性别、BMI、感染部位、联合使用的抗生素、接受其他治疗、总蛋白、白蛋白、总胆红素、直接胆红素、谷丙转氨酶(ALT)、C反应蛋白(CRP)及白细胞介素-6(IL-6)差异无统计学意义。两组患者的年龄,利奈唑胺用药时长,基础疾病(慢性阻塞性肺疾病、冠心病、神经系统疾病、慢性肾脏疾病、心功能不全)比例,白细胞计数,红细胞计数,基线血小板计数,肌酐,肌酐清除率(Ccr)及乳酸脱氢酶(LDH)差异有统计学意义(P<0.05,表1)。
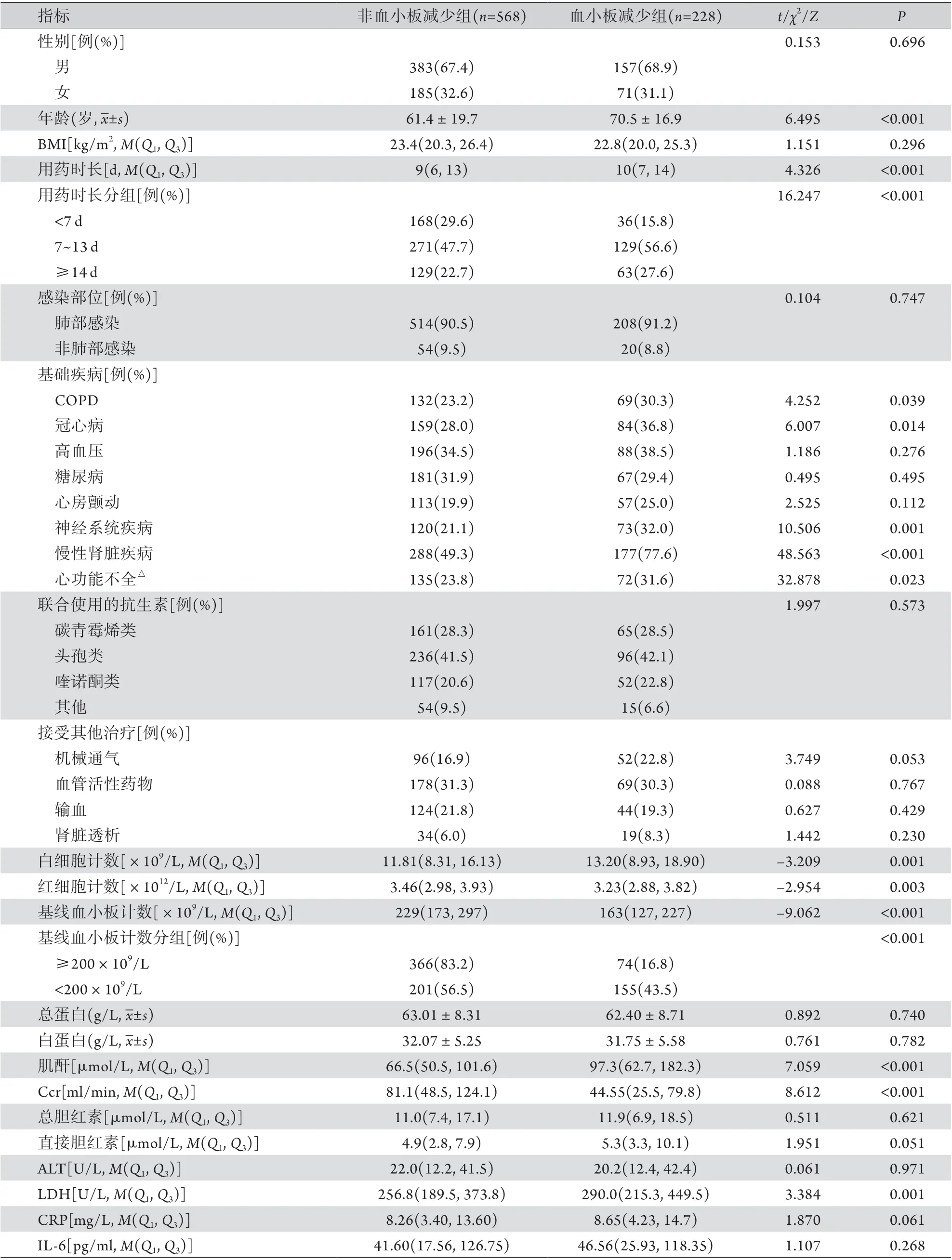
表1 两组患者一般资料比较Tab.1 General data of the two groups of patients
2.2 多因素分析利奈唑胺相关血小板减少症的危险因素 以是否发生利奈唑胺相关血小板减少症为因变量(是=1,否=0),以年龄(<80岁=0,≥80岁=1)、利奈唑胺使用时长(<7 d=0,7~13 d=1,≥14 d=2)、白细胞计数(<16×109/L=0,≥16×109/L=1)、血小板计数(≥200×109/L=0,<200×109/L=1)、Ccr(≥50 ml/min=0,<50 ml/min=1)、肌酐(<90 μmol/L=0,≥90 μmol/L=1)、直接胆红素(<7.0 μmol/L=0,≥7.0 μmol/L=1)、LDH(<250 U/L=0,≥250 U/L=1)、CRP(<10.0 mg/L=0,≥10.0 mg/L=1)为自变量进行多因素logistic回归分析,结果显示年龄≥80岁,利奈唑胺使用时长>7 d,白细胞计数≥16×109/L,血小板计数<200×109/L及Ccr<50 ml/min是利奈唑胺相关血小板减少症的独立危险因素(表2)。
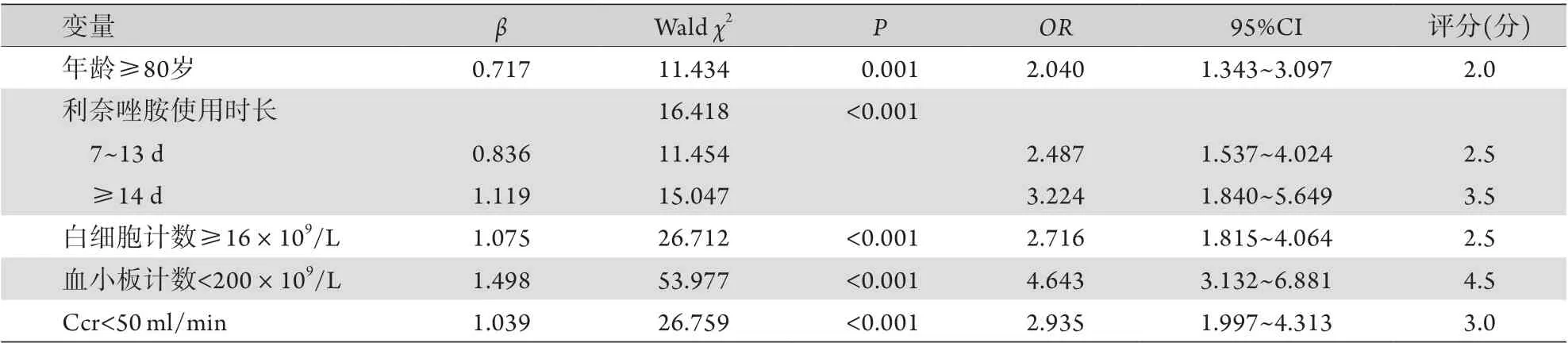
表2 利奈唑胺相关血小板减少症的危险因素及其风险评分Tab.2 Risk factors and risk score for linezolid-associated thrombocytopenia
2.3 利奈唑胺相关血小板减少症的风险预测模型的建立 根据多因素回归分析结果,建立利奈唑胺相关血小板减少症风险预测模型,采用ROC曲线检测该模型的诊断效能,其曲线下面积(AUC)为0.782,95%CI为0.747~0.816。最佳截断值为6分,敏感度82.1%,特异度59.1%,阳性预测值44.7%,阴性预测值89.1%(图1)。
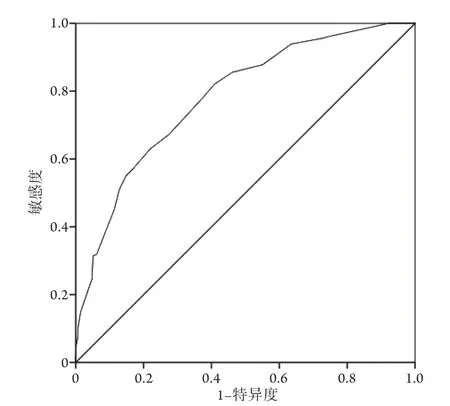
图1 受试者工作曲线评估利奈唑胺相关血小板减少症风险预测模型的效能Fig.1 Effectiveness of ROC on evaluation of the risk prediction of linezolid-associated thrombocytopenia model by ROC
3 讨 论
越来越多的研究发现利奈唑胺相关血小板减少症与患者的预后相关。Kim等[6]发现重症患者使用利奈唑胺期间发生血小板减少时,其病死率升高近1倍。本研究人群中利奈唑胺相关血小板减少症发生率为28.6%,与既往研究结果类似[3-5],另外本研究发现年龄≥80岁,利奈唑胺使用时长>7 d,基线白细胞计数≥16×109/L,基线血小板计数<200×109/L及Ccr<50 ml/min是利奈唑胺相关血小板减少症的危险因素,并且建立了风险预测模型。
Wu等[8]发现利奈唑胺相关血小板减少症组的年龄大于非血小板减少组。本研究也有同样发现,且年龄≥80岁是血小板减少症的危险因素,这可能与老年人骨髓造血功能储备不足有关。
以往研究表明利奈唑胺使用时间>14 d是利奈唑胺相关血小板减少症的危险因素[11-13,15],本研究同样发现利奈唑胺使用时长是血小板减少症的危险因素,与利奈唑胺使用时间<7 d相比,利奈唑胺使用时间7~13 d发生利奈唑胺相关血小板减少症的风险增高1.487倍,使用时间≥14 d的风险增高2.224倍。Choi等[15]的研究也发现与利奈唑胺使用时间<7 d相比,利奈唑胺使用时间7~13 d、14~20 d、≥21 d者发生利奈唑胺相关血小板减少症的风险分别增高7.25、19.51、28.80倍,提示利奈唑胺使用时长与血小板降低明显相关,与本研究结果一致。但Kaya等[19]研究发现利奈唑胺用药时长与血小板降低无明确相关性,这可能是因为该研究中61.3%的患者利奈唑胺使用时间<14 d,且10%的患者初始血小板计数<100×109/L。
本研究发现基线白细胞计数≥16×109/L是利奈唑胺相关血小板减少症的危险因素。既往研究也有类似发现,Ichie等[20]发现白细胞计数≥12×109/L是血小板减少症的危险因素(OR=10.399,95%CI 1.667~64.882,P=0.012)。白细胞作为炎性指标之一,可在一定程度上反映炎症状态,提示初始感染的严重程度可能会影响到血小板计数。
基线血小板计数已经被确定为利奈唑胺相关血小板减少症的预测因子[9,13,16-17],但各研究中的基线血小板计数各不相同,大多数在(108~240)×109/L,这是由于纳入患者的病情严重程度及对血小板减少症的定义不同所致。本研究为大样本量研究,纳入患者的基线血小板计数均≥100×109/L,结果显示基线血小板<200×109/L的患者在接受利奈唑胺治疗期间血小板减少症发生率较基线血小板≥200×109/L的患者升高3.643倍。一项纳入371例样本的研究同样发现基线血小板<200×109/L是利奈唑胺相关血小板减少症的独立危险因素[19],与本研究结果一致。因此对于基线血小板偏低的患者使用利奈唑胺时,需密切监测其血小板计数。
虽然利奈唑胺主要经过肝脏代谢,非肾脏清除率为65%,但仍有30%以上的利奈唑胺通过肾脏排泄[21-22],也有大量研究表明肾损伤是利奈唑胺相关血小板减少症的危险因素[8-13]。Hanai等[12]发现,Ccr<52.2 ml/min的患者血小板减少症发生率为50%,本研究发现Ccr<50.0 ml/min是利奈唑胺相关血小板减少症的危险因素。但Kaya等[19]未发现Ccr≤50.0 ml/min与利奈唑胺相关血小板减少症相关,可能是因为这部分患者均接受了血液透析治疗。
利奈唑胺主要治疗革兰阳性菌引起的肺部感染[2],因此本研究纳入的患者中90%以上使用利奈唑胺治疗肺部感染。另外,由于血小板减少组患者年龄偏大,因此与年龄相关的疾病,如COPD、冠心病、神经系统疾病、慢性肾功能不全及心功能不全等的发生率均高于非血小板减少组,虽然两组的这些基础疾病并不匹配,但并不会影响血小板数量,对本研究终点无影响。
利奈唑胺相关血小板减少症可能的机制包括骨髓抑制导致血小板生成减少[23]及免疫介导增加血小板清除[24]。Tajima等[25]在动物实验中发现利奈唑胺可能通过促进肌球蛋白轻链2(MLC2)磷酸化来抑制成熟巨核细胞释放血小板,进而导致血小板减少症的发生,但其具体机制目前仍未明确。
本研究的不足之处在于为单中心、回顾性研究,未监测利奈唑胺的血药浓度,无法确定利奈唑胺的血药浓度与其不良反应的相关性,部分信息(如血小板减少症相关的出血倾向)缺失,也导致研究结果有所偏倚。
综上所述,本组病例中利奈唑胺相关血小板减少症发生率为28.6%,且年龄大、利奈唑胺使用时间长、基线白细胞计数高、基线血小板计数低及Ccr水平低是利奈唑胺相关血小板减少症的独立危险因素。本研究建立了利奈唑胺相关血小板减少症的风险预测模型,有助于临床医师早期识别用药风险,为临床决策提供一定参考。
