玻璃体内注射腺相关病毒介导原纤维蛋白-2基因干扰对小鼠视网膜的影响△
2021-09-24张瑞雪蒋文君石永伟丁捷许静温莹毕宏生
张瑞雪 蒋文君 石永伟 丁捷 许静 温莹 毕宏生
遗传性疾病占国际公认的罕见病的80%,目前仅不足5%的罕见病有明确的治疗方案[1]。遗传性视网膜病变属于眼科罕见病,由于遗传缺陷而导致患者视网膜功能丧失或进行性退化,患者常在幼儿或青少年时期即出现可逆性或不可逆性视力损害。在一项对10 337名人群的遗传研究中发现了与年龄相关性黄斑变性(AMD)显著相关的原纤维蛋白-2(FBN2)基因变异体 rs154001 c.2893G>A(p.Val965Ile),在早发性黄斑变性患者的家庭成员中发现了FBN2基因变异体 c.3430G>A(p.Glu1144Lys),表明单个 FBN2 基因突变与视网膜病变密切相关。1998年Fire等[2]第一次描述了干扰RNA(RNAi)的现象,腺相关病毒(AAV)作为RNAi的载体在视网膜疾病的研究中以及在人体试验中安全性均良好[3],是高效RNAi的最佳选择。
FBN2在先天性视网膜病变发生发展中的作用机制尚不明确,本研究通过玻璃体内注射AAV介导FBN2基因干扰进行基因干预,构建FBN2基因缺陷型视网膜病变小鼠动物模型,以进一步明确 FBN2基因缺陷在视网膜病变发病过程中的作用机制,为遗传性视网膜病变的靶向治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物54只8周龄 C57BL/6J 小鼠,SPF 级,体重21~23 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。入组前对小鼠眼部健康进行筛查,排除角膜病、白内障以及通过共焦扫描激光检眼镜(SLO)、视网膜电图(ERG)和光学相干断层扫描(OCT)排除视网膜眼底疾病。小鼠饲养在山东中医药大学眼科研究所动物房。所有实验均符合 ARVO 对于动物在眼睛和视觉方面的应用规则。
1.1.2 主要实验仪器及耗材FBN2干扰载体AAV[108093;吉满生物科技(上海)有限公司],FBN-2 ELISA试剂盒(上海江莱生物科技有限公司),氧氟沙星滴眼液[辰欣佛都药业(汶上)有限公司]。显微注射针头(33 G,瑞士汉密尔顿),LightCycler®480 II 实时荧光定量PCR(RT-PCR)仪(美国Roche 公司),视觉电生理仪(英国OPTOROBE SCIENCE LTD),OCT仪(SN:Spec-CAM-09648-S2610和SN:Spec-CAM-14565-S2610;德国海德堡公司)。
1.2 方法
1.2.1 实验动物分组及处理54只C57BL/6J 小鼠随机分为 3组:正常对照组、阴性对照组、AAV组,每组18只。正常对照组小鼠正常饲养不做任何处理;阴性对照组小鼠右眼玻璃体内注射3 μL阴性病毒(1 g·L-1),AAV组小鼠右眼玻璃体内注射3 μL AAV(1 g·L-1)。分别于注射后2周、3周、4周每组各随机选取6只小鼠用于SLO、 ERG、OCT检测,观察各组小鼠眼底形态变化、视功能变化,并测量视网膜外核层(ONL)厚度;3项检测完成后处死小鼠,分离出视网膜,一半用于RT-PCR检测FBN2 mRNA的表达,一半用于ELISA检测FBN2蛋白的表达。
1.2.2 玻璃体内注射小鼠玻璃体内注射前用10 g·L-1戊巴比妥钠溶液(50 mg·kg-1)腹腔注射进行全身麻醉,保证正常呼吸,滴复方托吡卡胺滴眼液进行散瞳。将麻醉后的小鼠置于显微镜下,聚维酮碘行眼部周围消毒,生理盐水冲洗掉表面聚维酮碘后,用干燥无菌棉棒吸干。眼表麻醉后用显微镜齿镊夹住球结膜,于角巩膜缘颞侧后2 mm处垂直巩膜进针,有突破感后针头向眼球后极部倾斜20°,在显微镜下透过小鼠角膜观察针尖在玻璃体内的位置,避免刺伤晶状体和视网膜,缓慢进针,注射后滴典必殊滴眼液,每天3次。
1.2.3 SLO检查小鼠全身麻醉及散瞳方法同1.2.2。待小鼠处于完全麻醉状态,将小鼠眼睛对准SLO镜头,调整小鼠位置,以电脑显示屏可以拍到完整的眼底图为标准,每组至少取3张图片保存并分析。
1.2.4 OCT检查小鼠全身麻醉及散瞳方法同1.2.2。待小鼠处于完全麻醉状态,为小鼠配戴直径为3 mm、屈光度为-25.00 D的角膜接触镜,将小鼠眼睛对准OCT仪器(SN:Spec-CAM-09648-S2610)的扫描镜头,调整小鼠位置、镜头距离,以电脑显示屏可以拍到准确的眼底断层图为标准,每组至少取3张图片保存并分析,测量ONL厚度。用同样的方法使用另一台OCT仪器(SN:Spec-CAM-14565-S2610)对视网膜进行结构形态检测。
1.2.5 ERG检测ERG检测在绝对黑暗环境中进行。检测前将小鼠置于黑暗环境 8 h以上。检测时,使用1.2.2方法行小鼠全身麻醉及散瞳,之后使用盐酸奥布卡因滴眼液进行眼表麻醉。将小鼠置于操作台上,采用RETI port系统,将由金制的环状角膜电极固定在小鼠双眼角膜,将针状参考电极分别插入小鼠口中左右口角两侧肌肉丰厚处,针状接地电极缓慢扎入小鼠右上肢皮下肌肉,待检测屏上地线稳定后,记录脑电图Rod-b、Max-a波形以及振幅变化,并对比分析。
1.2.6 RT-PCR检测提取视网膜组织总RNA,参照文献[4]方法行RT-PCR检测各组小鼠视网膜中FBN2 mRNA表达情况。FBN2上游引物为5’- GTGTAACTGCCCGCCTGACTTCC-3’,下游引物为5’-ACCTACGCCGACCTCTGTGTTGC-3’;β-actin上游引物为5’-GTGAGCCTTCTTCCTGTTAG-3’,下游引物为5’-CATTCAGCTCCGCAAGACTT -3’。实验重复3次,采用2-ΔΔCt法定量分析各组小鼠视网膜中FBN2 mRNA 的相对表达量。
1.2.7 ELISA检测视网膜组织中加入组织裂解液,置于冰上,玻璃棒研磨,然后12 000 r·min-14 ℃离心1 min,取上清,再用超声粉碎,然后将匀浆按上述离心条件离心,吸取上清后-80 ℃保存备用。用 BCA 法检测样品浓度,并按照说明书进行 ELISA 检测,记录各组小鼠视网膜中FBN2 蛋白表达量。
1.3 统计学分析采用SPSS 21.0 统计软件对数据进行分析,进行正态分布检验和Levene方差齐性检验,多组间比较行方差分析,两两比较行t检验。检验水准:α=0.05。
2 结果
2.1 SLO检查结果注射后2周、3周、4周,与正常对照相比,阴性对照组小鼠视网膜均无明显变化。注射后2周,AAV组小鼠开始出现视网膜渗出物及黄白色似Drusen样沉积物;注射后3周,AAV组小鼠视网膜渗出物及沉积物增加;注射后4周,AAV组小鼠眼底变化同注射后2周,表明药物没有时间依赖效应(图1)。
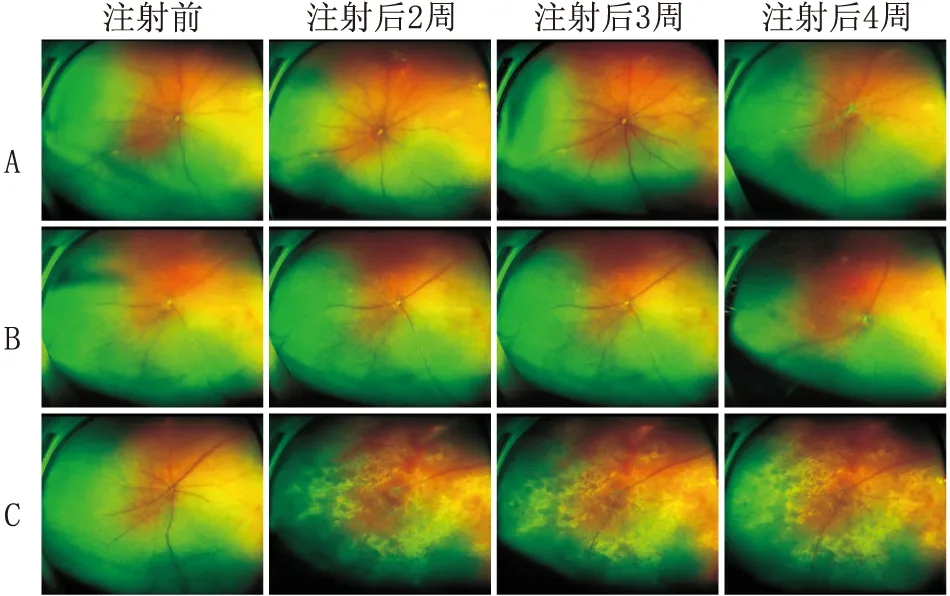
图1 各组小鼠玻璃体内注射前及注射后不同时间眼底图 A:正常对照组;B:阴性对照组;C:AAV 组。
2.2 OCT检查结果注射后4周,AAV组小鼠出现视网膜色素上皮(RPE)层光带不规则、点状高密度反射区。与阴性对照组和正常对照组相比,注射后2周、3周、4周AAV组小鼠视网膜ONL厚度均变小,差异均有统计学意义(均为P<0.05);AAV组内,注射后2周、3周、4周间小鼠视网膜ONL厚度变化不明显,差异无统计学意义(P>0.05)。阴性对照组与正常对照组小鼠各时间点ONL厚度相比差异均无统计学意义(均为P>0.05)(表1,图2,图3)。

表1 各组小鼠玻璃体内注射前及注射后不同时间视网膜ONL厚度变化

图2 各组小鼠玻璃体内注射后4周OCT检查图像

图3 各组小鼠玻璃体内注射前及注射后不同时间视网膜ONL厚度图 A:正常对照组;B:阴性对照组;C:AAV 组。
2.3 ERG检测结果注射后2周、3周、4周,AAV组小鼠Rod-b、Max-a波形均呈熄灭型,与阴性对照组和正常对照组相比振幅均变小,差异均有统计学意义(均为P<0.05);AAV组内注射后2周、3周、4周间,Rod-b、Max-a波振幅变化均不明显,差异均无统计学意义(均为P>0.05),但均较注射前明显变小,差异均有统计学意义(均为P<0.05)。阴性对照组与正常对照组相比,各时间点小鼠Rod-b、Max-a波振幅均无明显变化(均为P>0.05)(图4和表2)。

图4 各组小鼠玻璃体内注射前及注射后不同时间ERG波形 A:注射前;B:注射后2周;C:注射后3周;D:注射后4周。

表2 各组小鼠玻璃体内注射前及注射后不同时间点Rod-b、Max-a波振幅变化
2.4 RT-PCR检测结果注射后2周、3周、4周,与阴性对照组和正常对照组相比,AAV组小鼠视网膜FBN2 mRNA相对表达量均明显降低(均为P<0.05);AAV组内,注射后2周、3周、4周间小鼠视网膜FBN2 mRNA相对表达量变化不明显(P>0.05)。阴性对照组与正常对照组各时间点小鼠视网膜FBN2 mRNA表达差异均无统计学意义(均为P>0.05)(表3)。

表3 各组小鼠视网膜FBN2 mRNA相对表达量
2.5 ELISA检测结果注射后2周、3周、4周,与阴性对照组和正常对照组相比,AAV组小鼠视网膜FBN2 蛋白表达均明显降低(均为P<0.05);AAV组内,注射后2周、3周、4周间小鼠视网膜FBN2 蛋白表达变化不明显(P>0.05)。阴性对照组与正常对照组各时间点小鼠视网膜FBN2蛋白表达差异均无统计学意义(均为P>0.05)(表4)。
3 讨论
FBN2基因突变已经被证明是早发型黄斑变性[5]和AMD形成的重要原因[6]。据估计,到2050年,患有AMD的亚洲人将超过世界其他地区ADM患者的总和[7],而FBN2基因缺陷型视网膜病变目前尚无有效的治疗方法[8]。本研究利用AAV为载体进行FBN2基因干扰,通过玻璃体内注射达到敲减FBN2基因的目的,为探索FBN2基因缺陷型视网膜病变的发病机制和治疗方法提供理论依据。
本研究首次通过小鼠玻璃体内注射AAV介导FBN2干扰进行基因敲低来构建FBN2缺陷型视网膜病变模型。目前研究发现,小鼠和成年猴子眼睛中有FBN2的表达,其中小鼠与人类FBN2有97%的同源性[9]。C57BL/6J 小鼠具有基因库和抗体库比较完整、眼底易观察、视网膜组织相对保守、繁殖期短、价格便宜等优点,因此是建立FBN2缺陷型视网膜病变较优的动物选择。
本研究采用玻璃体内注射法进行基因干预。玻璃体内注射开始于20世纪初,是直接将药物运送至玻璃体内,使药物作用在眼后节组织的常用方法,视网膜组织内药物浓度可达到较高水平,此外,玻璃体内注射操作简单、安全性高[10]。与玻璃体内注射相比,视网膜下注射是将药物运送至视网膜从而直接影响视网膜下间隙细胞和组织的,但视网膜下注射对操作人员的技术要求更高,不当操作会引起视网膜脱离、玻璃体积血、眼底出血,影响疾病的转归愈后[11]。此外,徐福如等[12]研究发现,玻璃体内注射FBN2 抗体能够降低小鼠视网膜中FBN2 蛋白的表达,引起小鼠发生视网膜病变。因此,玻璃体内注射是眼部疾病研究和治疗相对安全有效的给药方式。
2004年,第一个以RNAi为基础的RNA治疗湿性AMD进入I期临床试验[13]。AAV作为RNAi的载体在视网膜疾病的研究以及在人体试验中应用广泛,包括用于AMD[14]以及糖尿病视网膜病变[15]。此外,AAV载体具有许多特性,包括非整合性、低炎症潜能、适当剂量下的低视网膜毒性、非致病性、转导非分裂细胞的能力,以及在人体试验中的良好、安全的使用记录,使其成为治疗视网膜疾病的优秀载体选择。以上研究均为本研究提供理论和实验支撑。本研究结果表明,以AAV为载体通过1次玻璃体内注射进行眼部FBN2基因敲减可以安全有效地构建FBN2基因缺陷型视网膜病变模型,这避免了动物基因敲除引起的全身并发症致死率高的缺点[16]。
Drusen是AMD的重要诊断标志,在形成起始阶段表现为RPE下出现含胆固醇的脂滴[17]。在年龄相关性眼病研究中发现,36%的有Drusen表现的患者可发展为进行性AMD[18]。本研究结果中,AAV注射后小鼠眼底出现黄白色似Drusen样沉积物, OCT检测显示RPE层出现点状高密度反射区,与刘艳丽等[19]和安娜等[20]分别通过尾静脉注射氧化剂 NaIO3和饲喂氢醌的方式建立小鼠 AMD 模型中出现似Drusen 样沉积物与RPE 损伤,以及Tao 等[21]腹腔注射N-甲基-N-亚硝脲(MNU)诱导视网膜病变小鼠眼底出现大量黄白色沉积物的眼底改变相似,说明玻璃体内注射进行FBN2基因干扰可以诱导出视网膜病变眼底似Drusen样沉积物的临床表现。而在人的研究中,Drusen在OCT中表现为RPE层光带局限增强隆起或高度隆起[22],光带局限增强范围大于本研究,推测与本实验周期相对较短,没有进一步观测Drusen的发展变化有关。此外,有临床试验表明,阈值下微脉冲激光可以治疗Drusen的形态学改变,提高患者视力[23]。提示针对Drusen的治疗有利于防止AMD的发展。
本研究发现,玻璃体内注射FBN2基因干扰载体AAV后视网膜ONL厚度降低。ONL厚度与光感受器的凋亡密切相关,光感受器细胞中的视杆细胞最先发生凋亡,随着疾病的进展视锥细胞也逐渐死亡[24],该过程主要表现为PARP-1依赖性凋亡[25]。有临床研究发现,渗出性AMD患者晚期视网膜病变区视锥细胞减少,在后期病变之处仅仅存留一点视锥细胞,处于基本消失的状态,视力明显下降[26]。以上研究均说明黄斑变性患者会出现ONL厚度降低,本研究结果与以上研究结果一致。提示FBN2基因变异可能加速了光感受器细胞的凋亡,是患者视力下降的重要原因,在临床治疗中可以通过抑制光感受器细胞凋亡缓解视网膜病变进程。
视网膜电生理是评价视网膜功能的客观指标,它记录了视网膜的各层电活动。本研究发现,玻璃体内注射AAV后暗适应下 Rod-b、Max-a波振幅平缓,均呈熄灭型。Falsini等[27]对25例黄斑病变及Drusen患者进行多焦ERG检测,发现ERG波形异常,并且与眼底改变的严重程度相关;在腹腔注射MNU构建视网膜变性小鼠模型的实验中发现,暗适应下a、b 波振幅与暗适应下视杆细胞反应的波形振幅均低平,均呈熄灭型[28];小鼠玻璃体内注射FBN2 抗体后,暗适应下视杆细胞反应波振幅均降低,均与本研究结果一致。说明视网膜变性疾病中双极细胞、视杆细胞和视锥细胞的电活动受到影响,使视网膜的电生理功能降低。有研究发现,对典型眼底新生血管患者进行光动力治疗后,为期2年的随访结果显示,ERG反应是评估治疗后视力改善与否的最佳指标[29]。提示FBN2基因缺陷型视网膜病变引起的视力下降,可以尝试通过改善双极细胞、视杆细胞和视锥细胞的电活动来恢复患者视力。
本研究结果还发现,玻璃体内注射FBN2基因干扰载体AAV后3周,小鼠视网膜 FBN2 mRNA 及蛋白表达均保持较低水平。说明通过玻璃体内注射FBN2基因干扰载体AAV降解了具有同源序列FBN2的mRNA,抑制了基因表达,出现了靶基因缺失的表型。有研究发现,玻璃体内注射FBN2 抗体后小鼠视网膜中FBN2 蛋白的表达降低[12],玻璃体内注射带有RNAi的重组AAV2或AAV5,可以对光感受器进行预去除[30];在视网膜下注射AAV载体后,在携带野生型人类RHO转基因(NHR)的转基因小鼠中实现了RHO的有效抑制,同时也导致组织学和ERG受损[31]。以上研究均说明,玻璃体内注射和视网膜下注射AAV干扰载体均可以有效地干扰目的基因,起到靶向干预的作用,与本研究结果一致。
本研究首次采用玻璃体内注射FBN2基因干扰载体AAV构建FBN2基因缺陷型视网膜病变模型,为研究FBN2基因缺陷引起的眼部疾病提供了基础,有助于进一步明确FBN2基因缺陷型视网膜病变的发病机制。本实验方法为研究FBN2基因缺陷型视网膜病变和其他基因缺陷型眼病造模提供了实验支撑。
