miR-106调控CC趋化因子配体2对增生型糖尿病视网膜病变中人视网膜微血管内皮细胞增殖、血管生成和炎症反应的影响
2021-09-24田涛姚睿彭婧利刘茹谢丽莲邝国平周小平
田涛 姚睿 彭婧利 刘茹 谢丽莲 邝国平 周小平
糖尿病视网膜病变(DR)是糖尿病最常见的并发症,是世界上老年人致盲的主要原因[1]。DR可分为非增生型DR(NPDR)和增生型DR(PDR),PDR的主要特征是视网膜前新生血管形成和细胞外基质(ECM)积聚,并伴随玻璃体-视网膜交界处纤维血管视网膜前膜的生长[2]。PDR作为一种微血管疾病,是DR中较NPDR更严重地威胁视力的并发症[3]。阐明PDR发病的分子机制对于PDR的治疗十分重要。外泌体是直径50~150 nm的小囊泡,可由不同类型的细胞分泌,内含有大量蛋白质和脂质,以及DNA、mRNA、microRNA(miRNA)和非编码性RNA形式存在的核酸,被认为是细胞间通讯的重要媒介[4]。研究发现,血浆外泌体能够通过PI3K/Akt途径促进人视网膜Müller细胞增殖和纤维化[5]。外泌体鲜明的特点和潜在的价值使其逐渐成为研究的热点。miRNAs是一种内源性的非编码小RNA分子,通过与靶基因3’非翻译区(3’UTR)结合来调控其表达[6]。有研究发现,miR-106a-5p在PDR中的表达显著低于正常对照组[7],而miR-106在PDR中可能的功能尚未有研究证实。此外,血清外泌体源性miR-106被发现可能是诊断肝细胞癌的生物标志物[8]。CC趋化因子配体2(CCL2)是一种调节单核细胞浸润和迁移的炎症细胞因子,它在肿瘤和间质细胞中均高度表达,并与肿瘤的发生发展有关[9]。已有较多研究证实,CCL2在PDR患者玻璃体标本中的表达显著高于非糖尿病对照组,并能够促进血管的生成[10]。但CCL2在PDR中的作用及机制仍需进一步阐明。在本研究中,我们设计了一系列实验以探究血清外泌体源性miR-106介导CCL2在PDR中的作用及其具体机制。
1 材料与方法
1.1 仪器与试剂人视网膜微血管内皮细胞(HRMEC)购自中国科学院上海细胞库;Lipofectamine 3000试剂购自美国Invitrogen公司;ECM培养基和超氧化物歧化酶(SOD)活性检测试剂盒购自北京索莱宝科技有限公司;Exo-Fect试剂盒(EXFT10A-1)购自上海吉泰依科赛生物科技有限公司;过氧化氢酶(CAT)检测试剂盒(A007-1-1)和还原型谷胱甘肽(GSH)检测试剂盒(A005-1-2)购自南京建城生物工程研究所;PKH67标记试剂盒购自美国Sigma-Aldrich公司;Trizol试剂购自上海源叶生物科技有限公司;SYBRGreen检测系统和7500Real time PCR系统购自上海土森视觉科技有限公司;反转录试剂盒购自北京伊塔生物科技有限公司;miR-106过表达载体及其阴性对照(miR-NC)、CCL2过表达载体(oe-CCL2)及其阴性对照(oe-NC)基因购自广州吉赛生物科技股份有限公司;酶联免疫吸附试验(ELISA)试剂盒购自上海晶抗生物工程有限公司;Western blot实验所用抗体均购自英国Abcam公司;ECL发光试剂盒购自上海翌圣生物科技有限公司;Amicon Ultra-15ML离心过滤器(UFC901008)购自上海必泰生物科技有限公司;透射电子显微镜为日本Olympus公司产品。
1.2 生物信息学分析从NCBI数据库(http://ncbi.nlm.nih.gov)获取GSE60436芯片表达数据,使用GEO2R分析PDR中的差异表达基因,差异筛选条件为FDR(校正后的P值)<0.05和|logFoldChange|>1.5(FoldChange:差异倍数)。DAVID数据库(http://david.ncifcrf.gov)用于差异表达基因的功能富集分析。Venn(http://ehbio.com/test/venn/#/)用于绘制Venn图取交集。DisGeNET数据库(http://www.disgenet.org)用于查询PDR及DR中的疾病风险基因。STRING在线预测网站(https://string-db.org/)用于预测基因间的相互作用关系。miRWalk(http://mirwalk.umm.uni-heidelberg.de)、RNA22(http://cm.jefferson.edu/rna22/)和miRactDB(http://ccsm.uth.edu/miRactDB/)用于预测基因的靶miRNAs。
1.3 组织收集从2018年1月至2020年10月在本院接诊的45例无糖尿病视网膜病变(NDR)的糖尿病患者和45例PDR患者获取血液样本,在4 ℃恒温环境下保存。本研究得到了医院临床研究伦理委员会批准,所有患者都签署了书面知情同意书。
1.4 细胞培养HRMEC在ECM培养基中培养,培养液中添加含体积分数10%胎牛血清、青霉素(100 U·mL-1)和链霉素(100 U·mL-1),置于37 ℃、含体积分数5%CO2的细胞培养箱中培养。当细胞融合率达到90%左右进行传代处理。为探讨高糖培养对HRMEC的影响,分别用5.5 mmol·L-1葡萄糖(NG)和25.0 mmol·L-1葡萄糖(HG)培养对数生长期的HRMEC,培养时间为48 h。
1.5 细胞转染和分组设计并合成miR-106模拟物(miR-106 mimic)及其阴性对照(miR-NC)、oe-CCL2及oe-NC。按照产品方案,用外泌体-Fect试剂盒将miR-106 mimic转染至血清外泌体中,oe-CCL2用Lipofectamine 3000试剂转染到HRMEC。具体转染步骤依据试剂盒说明书进行,转染48 h后进行后续研究。
实验分组如下:HG组(HG处理HRMEC)、NG组(NG处理HRMEC)、NDR-exo组(NDR患者的血清外泌体处理HRMEC)、PDR-exo组(PDR患者的血清外泌体处理HRMEC)、NG+NDR-exo组(NG处理的HRMEC与NDR-exo共孵育6 h)、NG+PDR-exo组(NG处理的HRMEC与PDR-exo共孵育6 h)、 HG+NDR-exo组(HG处理的HRMEC与NDR-exo共孵育6 h)、HG+PDR-exo组(HG处理的HRMEC与PDR-exo共孵育6 h)、HG+PDR-exo+miR-106 mimic组(HG处理的HRMEC与转染miR-106 mimic的PDR-exo共孵育6 h)、HG+PDR-exo+miR-NC组(HG处理的HRMEC与转染miR-106对照物的PDR-exo共孵育6 h)、HG+PDR-exo+miR-106 mimic+oe-NC组(HG处理的HRMEC与转染miR-106 mimic的PDR-exo共孵育6 h后,对HRMEC转染oe-NC)和HG+PDR-exo+miR-106 mimic+oe-CCL2组(HG处理的HRMEC与转染miR-106 mimic的PDR-exo共孵育6 h后,对HRMEC转染oe-CCL)。
1.6 外泌体的分离和鉴定将NDR组和PDR组患者的血液样本分别在4 ℃下以3000 r·min-1离心15 min。然后分离血清并以相同设置再次离心。然后收集上清液并以10 000 r·min-1离心30 min,然后以100 000 r·min-1离心70 min。分离的外泌体用PBS洗涤3次并在相同的超速离心设置下进行离心,然后在15 mL PBS中再悬浮并用15 mL Amicon Ultra-15离心过滤器以4000 r·min-1离心至最终200 μL。将分离的外泌体与40 g·L-1四氧化锇混合30 min,然后将其应用于铜网格上,以评估其形态特性。然后用10 g·L-1磷钨酸对颗粒进行染色,并通过透射电子显微镜进行评估。qRT-PCR检测miR-106在各组外泌体中的表达。
为了检测血清外泌体是否在体外被HRMEC内化,根据制造商的说明,使用外泌体荧光标记试剂盒PKH67试剂盒标记外泌体,实验步骤按试剂盒说明书进行操作。
1.7 MTT法检测各组HRMEC增殖情况待HRMEC生长融合度在90%左右时,将各组细胞以每孔3000个的密度接种于96孔板上,再分别接种于NG和HG培养基。48 h后,将最终浓度为0.5 g·L-1的MTT添加到各孔中并培养4 h。培养结束时,弃上清液,将形成的蓝紫色甲瓒晶体溶解在150 μL二甲基亚砜中。使用微孔板读取器测量570 nm波长处的光密度。
1.8 小管形成实验检测HRMEC的血管生成情况在小管形成实验中,96孔板预涂有Matrigel基质胶,每孔30 μL,在37 ℃培养2 h。将细胞以每孔16×103个的密度接种到96孔板中。细胞接种20 h后拍摄形成的毛细管状结构,计算分支点的数量。
1.9 ELISA法检测各组细胞上清液中TNF-α、IL-1β 和IL-6的表达采用ELISA试剂盒检测各组HRMEC上清中TNF-α、IL-1β和IL-6水平。收集各组细胞培养上清样品,严格按照ELISA试剂盒说明书进行实验。实验操作后30 min内,用分光光度微板阅读器在450 nm波长处读取结果。
1.10 各组HRMEC上清液中CAT、SOD和GSH含量检测各组HRMEC以每孔2×106个的密度接种于96孔培养板中进行培养。丢弃上清液后,用RIPA裂解缓冲液裂解细胞,离心得到上清液。采用相应试剂盒测定CAT活性(可见光法)、SOD活性(微量法)和GSH含量(比色法)。
1.11 Western blot检测各组细胞中外泌体特异性标志物CD63和CD9的表达用细胞或上清液制备裂解液,用负载缓冲液按体积比15稀释,并在95 ℃下煮沸5 min。然后通过SDS-PAGE分离蛋白样品,转移到PVDF膜上,并且在室温下用50 g·L-1脱脂奶粉封闭1 h。然后用CD63(11000)和CD9(12000)在4 ℃孵育过夜。然后在37 ℃下与二级抗体山羊抗兔IgG孵育2 h,以GAPDH(11000)为内参。使用ECL发光试剂盒检测蛋白条带。蛋白表达量为目的条带和内参条带的比值,利用ImageJ软件对蛋白表达量进行统计。
1.12 qRT-PCR检测各组HRMEC中miR-106 mRNA和CCL2 mRNA表达用Trizol试剂提取总RNA。用反转录试剂盒将RNA反转录为互补RNA。用SYBR Green检测系统和7500Real time PCR系统检测各组细胞中CCL2 mRNA和miR-106 mRNA表达。检测步骤依据试剂盒说明书进行。GAPDH作为CCL2的内参,U6作为miR-106的内参。定量分析采用2-ΔΔCt法。miR-106的正向引物为5’-CGGCTAAAGTGCTGACAGTGC-3’,反向引物为5’-GTGCAGGGTCCGAGGT-3’,大小84 bp;CCL2的正向引物为5’-CTGTAGCATCCACGTGCTGT -3’,反向引物为5’-AGTTCTCCAGCCGACTCATTG-3’,大小436 bp;GAPDH的正向引物为5’-ACCACAGTCCATGCCATCAC-3’,反向引物为5’-TCCACCACCCTGTT GCTGTA-3’,大小582 bp;U6的正向引物为5’-GCUUCGGCAGCACAUAUACUAAA-3’,反向引物为5’-CGCUUCACGAAUUUGCGUGUCAU-3’,大小149 bp。
1.13 双荧光素酶报告实验检测miR-106和CCL2的靶向结合关系将含有miR-106结合位点的野生型(WT)或突变型(MUT)的CCL2片段扩增并插入pGL3报告载体中形成CCL2-WT和CCL2-MUT。用Lipofectamine 3000将荧光素酶报告载体与miR-106模拟物或NC对照物共转染293T细胞。转染后48 h使用双荧光素酶报告分析系统检测荧光素酶活性。
1.14 统计学分析采用SPSS 21.0软件进行分析,数据以均数±标准差表示。采用卡方检验或Fisher确切概率检验进行检验。在计量数据符合正态分布的前提下,两组间比较采用t检验,多组间比较采用单因素方差分析(ANOVA)。在不符合正态分布条件下,对于两组间则用曼-惠特尼U检验,Bonferroni法用于多组间的两两比较。检验水准:α=0.05。
2 结果
2.1 生物信息学工具预测PDR中可能的分子机制GSE60436芯片中包含3例正常视网膜和6例PDR患者的纤维血管膜(FVM),差异结果显示,PDR中共有994个显著下调基因和540个显著上调基因。本研究选择540个在PDR中显著上调的基因通过DAVID数据库进行功能富集分析,在FDR(校正后的P值)<0.001的富集结果中发现感兴趣的生物过程:血管生成和炎症反应。这2个生物过程中的共同基因为ECM1、CXCL8、PIK3CC和CCL2,将CCL2纳入本研究。在RNA22、miRactDB和miRWalk中预测CCL2的靶miRNAs并取交集,交集结果为hsa-miR-106、hsa-miR-107、hsa-miR-665和hsa-miR-1293。对hsa-miR-106展开分析,探究血清外泌体miR-106是否通过特异性结合CCL2参与调控PDR的进展。
2.2 外泌体的分离和鉴定透射电子显微镜下观察发现,提取的颗粒呈圆形,直径为50~150 nm。Western blot检测结果显示,外泌体特异性标志蛋白CD63和CD9均呈阳性(图1A),且与NDR-exo组(0.75±0.06、1.12±0.11)相比,PDR-exo组细胞上CD63(1.31±0.12)和CD9(1.80±0.13)的蛋白相对表达水平更高。PKH67标记的外泌体在加入培养基后被HRMEC吸收(图1B)。

图1 外泌体的分离和鉴定A:Western blot检测外泌体特异性标志蛋白CD63和CD9的表达;B:PKH67标记的外泌体图像。
2.3 PDR患者血清外泌体促进HRMEC增殖、血管生成、炎症反应和氧化应激将NDR/PDR患者的血清外泌体和HRMEC在NG/HG培养基中共孵育6 h后发现,与NG组相比,HG和PDR-exo均能够促进HRMEC活力显著上升,毛细血管分支节点增多,细胞上清液中TNF-α、IL-1β、IL-6水平提高,SOD和CAT活性受损,GSH含量降低(均为P<0.05)(见表1-3和图2)。
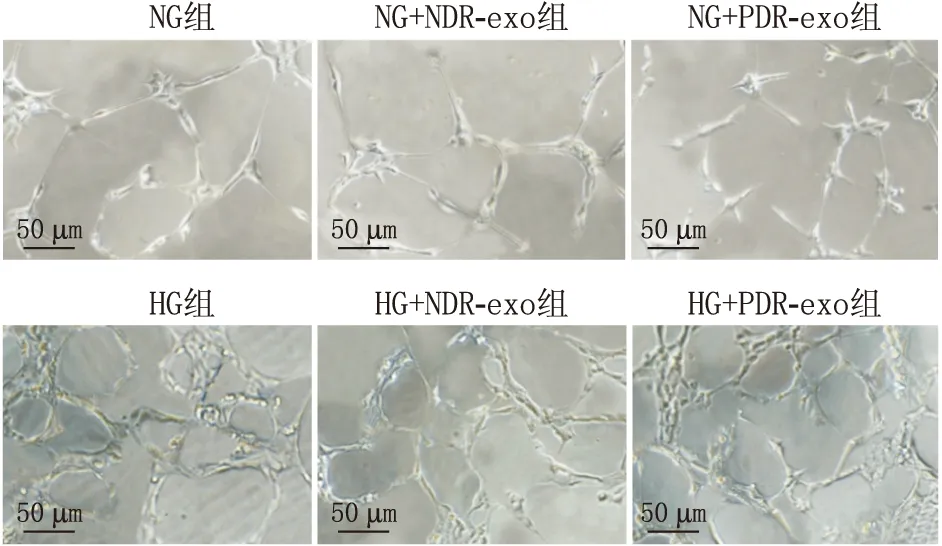
图2 各组细胞小管形成实验结果(×200)

表1 MTT和小管形成实验分别检测各组细胞活力、血管生成情况

表2 ELISA法检测各组细胞上清液中TNF-α、IL-1β 和IL-6的表达

表3 各组细胞上清液中CAT、SOD和GSH水平检测
2.4 miR-106在PDR患者血清外泌体中表达qRT-PCR检测了45例NDR患者和45例PDR患者血清外泌体中miR-106的表达发现,PDR患者外泌体miR-106的表达水平(1.00±0.22)显著低于NDR患者(0.63±0.19),差异有统计学意义(t=7.324,P<0.000 1)。此外,对NG和HG条件下HRMEC中miR-106表达水平进行检测发现,HG培养基孵育的HRMEC中miR-106表达水平(0.68±0.06)较NG组(1.04±0.10)显著降低,差异有统计学意义(t=5.124,P<0.01)。
2.5 过表达miR-106抑制HRMEC增殖、血管生成、炎症反应和氧化应激为观察miR-106对PDR中HRMEC的调控作用,本研究将miR-106 mimic转染PDR-exo后与HG条件下的HRMEC共孵育6 h,与HG+PDR-exo+miR-NC组(1.00±0.09)相比,HG+PDR-exo+miR-106 mimic组细胞中miR-106的表达(1.89±0.14)显著升高。相对于HG+PDR-exo+miR-NC组,进一步转染miR-106 mimic能够显著抑制HRMEC活力,减少毛细血管分支节点的形成,抑制细胞上清液中TNF-α、IL-1β和IL-6水平,并提高SOD、CAT和GSH水平(均为P<0.05)(见表4-6、图3)。结果提示,血清外泌体miR-106能够有效抑制PDR中HRMEC增殖、血管生成、炎症反应和氧化应激过程。

表4 MTT和小管形成实验分别检测各组细胞活力、血管生成情况

表5 ELISA法检测各组细胞上清液中TNF-α、IL-1β和IL-6的表达

表6 各组细胞上清液中CAT、SOD和GSH水平检测

图3 各组细胞小管形成实验结果(×200)
2.6 CCL2是miR-106的靶点双荧光素酶报告实验结果显示,miR-106(0.75±0.07)较miR-NC(0.99±0.09)显著降低了CCL2-WT的荧光活性(P<0.05),而对CCL2-MUT的荧光活性几乎没有影响。对NG/HG培养基中的HRMEC进行检测发现,与NG培养条件下HRMEC中CCL2表达(1.02±0.09)相比,CCL2在HG培养条件下表达(1.38±0.11)显著升高,差异有统计学意义(t=4.631,P<0.001)。此外,将HG培养基中的HRMEC与miR-106 mimic处理的PDR-exo共孵育,与HG+PDR-exo+miR-NC组(0.99±0.09)相比,CCL2在HG+PDR-exo+miR-106 mimic组表达(0.63±0.06)显著降低,差异有统计学意义(t=5.765,P<0.01)。
2.7 过表达CCL2能够部分逆转上调miR-106对HRMEC的调控作用与HG+PDR-exo+miR-106 mimic+oe-NC组(0.55±0.05)相比,CCL2在HG+PDR-exo+miR-106 mimic+oe-CCL2组细胞中表达(0.83±0.07)显著升高,差异有统计学意义(t=5.638,P<0.01)。细胞增殖和小管形成实验结果显示,上调miR-106后抑制的细胞活力和毛细血管分支点数量被oe-CCL2部分逆转。此外,CCL2过表达载体还显著升高了miR-106降低的TNF-α、IL-1β和IL-6水平,降低了miR-106促进的SOD、CAT和GSH水平。结果提示,过表达CCL2能够部分逆转血清外泌体miR-106对PDR中HRMEC的调控作用,促进HRMEC的恶性行为(见表7-9、图4)。

表7 MTT和小管形成实验分别检测各组细胞活力、血管生成情况
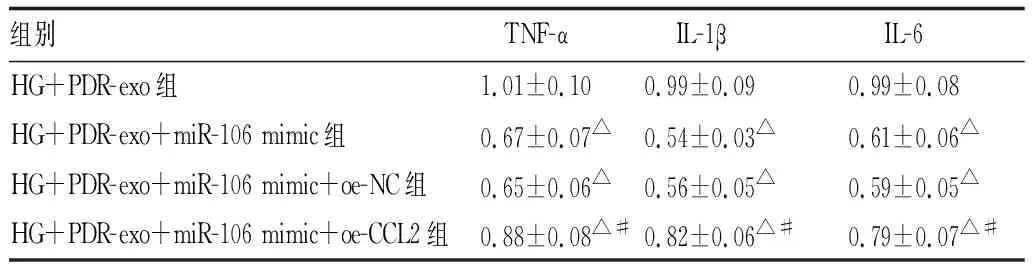
表8 ELISA法检测各组细胞上清液中TNF-α、IL-1β和IL-6的表达

表9 各组细胞上清液中CAT、SOD和GSH的水平

图4 各组细胞小管形成实验结果(×200)
3 讨论
HRMEC位于视网膜血管腔内,与各种视网膜血管疾病密切相关,如早产儿视网膜病变、糖尿病黄斑水肿和PDR等[11-12]。在本研究中,我们首次发现miR-106在HG诱导的HRMEC中表达降低,而CCL2表达升高。PDR患者的血清外泌体能够显著促进HG诱导的HRMEC活力、血管生成、炎症反应和氧化应激过程。而miR-106在PDR患者的血清外泌体中表达显著降低,过表达miR-106后的血清外泌体与HG诱导的HRMEC共孵育能够显著抑制其细胞活力、毛细血管形成和炎症因子表达,并提高抗氧化物质的水平。CCL2作为miR-106的下游靶基因,受其负调控,HRMEC中CCL2过表达能够部分逆转血清外泌体miR-106对HG条件下HRMEC的调控作用。
miRNAs作为非编码RNA,积极参与基因表达的调控。在蛋白质翻译过程中,大多数miRNAs参与了靶mRNAs的抑制或降解[13]。miRNAs在某些病理条件下的各种疾病中被鉴定[14]。有研究发现,血清外泌体miR-106可能参与调控疾病进展[8,15],此外,miR-106能够抑制HG诱导的周围神经退变的氧化应激过程,且在PDR中的表达显著低于正常对照组[16]。而miR-106在PDR中发挥的作用尚未见相关报道。本实验发现,miR-106表达在HG培养条件下的HRMEC中较NG培养条件下显著降低,PDR患者的血清外泌体中miR-106的表达较NDR患者也有显著减少。PDR患者的血清外泌体miR-106能够被HRMEC内化,并能够显著提高其细胞活力、毛细血管生成数量和TNF-α、IL-1β和IL-6表达水平,降低SOD和CAT活性,减少GSH含量。而过表达血清外泌体中的miR-106能够抑制HRMEC的增殖、血管生成、炎症反应及氧化应激过程。这些结果提示,血清外泌体miR-106可能是治疗PDR的有效分子靶点。
本研究借助生物信息学数据库筛选得到CCL2可能在PDR中发挥功能。据报道,骨保护素在PDR患者的玻璃体标本中与CCL2的表达呈显著正相关,并能够显著提高促炎因子TNF-α和IL-1β的表达,提高VEGF的血管生成作用,刺激HRMEC迁移[17]。此外,西洛他唑能够抑制CCL2的表达并减轻糖尿病大鼠视网膜氧化应激和炎症反应[18]。本研究发现,CCL2在HG培养条件下的HRMEC中表达显著升高;CCL2和miR-106的作用关系被荧光素酶实验证实,在PDR中miR-106能够抑制CCL2的表达;过表达HRMEC中的CCL2能够对过表达血清外泌体miR-106介导的效应起抑制作用,提高HRMEC活力和毛细血管生成,促进炎症反应和氧化应激的发生。这些结果表明,血清外泌体miR-106通过抑制CCL2的表达降低HG诱导的HRMEC活力、血管生成、炎症反应和氧化应激过程,血清外泌体miR-106/CCL2可能是治疗PDR的有效作用轴。
综上所述,本研究揭示了血清外泌体miR-106/CCL2对PDR中HRMEC增殖、血管生成、炎性反应和氧化应激的调控作用。但实验可靠性还需要进一步的体内实验加以佐证。血清外泌体miR-106可能在PDR的靶向治疗中发挥重要的作用。
