老年2型糖尿病患者糖脂代谢、血尿酸水平与脂肪肝的关系
2021-09-23刘佳谊王亚新王智光
赫 琪,刘佳谊,刘 洋,王亚新,张 君,王智光
(1.内蒙古自治区人民医院医学检验科,内蒙古 呼和浩特 010017;2.内蒙古医科大学附属医院 儿科实验室;3.内蒙古医科大学附属医院神经内科)
非酒精性脂肪性肝病(NAFLD)指在没有大量饮酒和其他明确损肝因素情况下,以肝细胞内脂肪过度沉积为主要临床特征的代谢综合征,与机体遗传易感性、胰岛素抵抗密切相关[1]。NAFLD包括非酒精性脂肪性肝炎、单纯性脂肪肝及因肝硬化和肝纤维化所导致的肝衰竭和肝细胞癌,NAFLD除了可导致肝细胞癌、失代偿期肝硬化、移植肝复发发生,还可促进其他慢性肝病的发生和发展[2,3]。2型糖尿病(T2DM)患者机体代谢长期处于异常状态,发生NAFLD的可能性较高,而T2DM患者NAFLD的发生会加重患者病情,促进T2DM发展,引起更多慢性疾病发生,严重损伤患者机体,因此,有效控制可能导致T2DM患者NAFLD发生和发展的危险因素,对控制患者病情的发展具有重要意义[4,5]。尿酸为人体外源性和内源性嘌呤代谢终末产物,机体排泄减少及分泌更多均会引起高尿酸发生。SUA水平的高低与T2DM患者NAFLD发生的关系目前尚存争议,T2DM患者糖脂代谢情况对NAFLD发生的影响也报道较少[6]。基于此,本研究通过对比老年T2DM患者中发生NAFLD患者和未发生NAFLD患者的SUA水平及糖脂代谢指标差异,了解其相关性,为控制老年T2DM患者NAFLD的发生和发展提供参考。现报道如下。
1 资料与方法
1.1 一般资料
选取我院2018-09~2020-03收治的390例老年T2DM患者,根据患者是否存在NAFLD分为NAFLD组(159例)和非NAFLD组(231例),又将NAFLD组按照NAFLD病情严重程度不同分为轻度NAFLD组(60例)、中度NAFLD组(68例)、重度NAFLD组(31例)。各组间基础资料比较差异无统计学意义(P>0.05)(见表1)。本研究获我院医学伦理委员会批准。纳入标准:(1)T2DM符合《中国2型糖尿病防治指南(2017年)》[7]中的诊断标准;(2)NAFLD组符合2010年中华医学会肝病学分会制订的《非酒精性脂肪性肝病诊疗指南》[8]的诊断标准;(3)年龄≥65岁;(4)签署知情同意书。排除标准:(1)男性每周饮酒乙醇折合量≥140 g,女性≥70 g;(2)合并其他严重肝疾病(药物性肝损伤、病毒性肝炎、肝硬化、肝癌、自身免疫性肝炎等);(3)糖尿病急性并发症;(4)急性感染者;(5)心血管疾病者;(6)肾功能不全者。
表1 两组基础资料比较(n,±s)
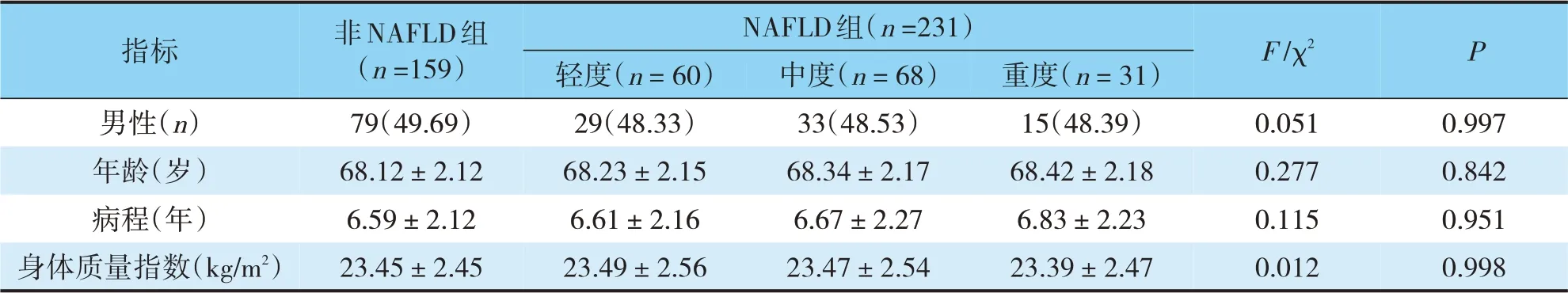
表1 两组基础资料比较(n,±s)
指标男性(n)年龄(岁)病程(年)身体质量指数(kg/m2)非NAFLD组(n=159)79(49.69)68.12±2.12 6.59±2.12 23.45±2.45 NAFLD组(n=231)P 轻度(n=60)29(48.33)68.23±2.15 6.61±2.16 23.49±2.56中度(n=68)33(48.53)68.34±2.17 6.67±2.27 23.47±2.54重度(n=31)15(48.39)68.42±2.18 6.83±2.23 23.39±2.47 F/χ2 0.051 0.277 0.115 0.012 0.997 0.842 0.951 0.998
1.2 方法
(1)测定各组糖脂代谢指标及SUA水平,于入院时测定患者SUA、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FBG)、餐后2 h血糖(2 h-BG)、空腹胰岛素(FINS)水平,采用尿酸酶-过氧化物酶耦联法测定SUA水平;采用日本西门子全自动生化仪检测TC、TG、HDL-C、LDL-C水平;采用美敦力CGMS GOLD动态血糖监测仪监测FBG、2 h-BG水平;采用电化学发光法检测FINS水平;(2)对比NAFLD组与NAFLD组糖脂代谢指标及SUA水平;(3)对比不同程度NAFLD患者糖脂代谢及SUA水平。
1.3 统计学方法
选用SPSS 22.0软件对数据进行统计学分析,计量资料以(±s)表示,两两比较行t检验,多组间行方差齐性检验;计数资料以(n,%)表示,组间行χ2检 验;利 用ROC曲 线 分 析SUA、TG、HDL-C、LDL-C、FBG、FINS水平对T2DM患者NAFLD发生的预测价值;采用Spearman秩相关分析检验T2DM患者NAFLD严重程度与糖脂代谢及SUA水平的相关性。检验水准为α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 NAFLD组与NAFLD组非糖脂代谢及SUA水平比较
两组TC、2 h-BG比较差异无统计学意义(P>0.05),NAFLD组SUA、TG、LDL-C、FBG、FINS均显著高于非NAFLD组,NAFLD组HDL-C显著低于非NAFLD组(P<0.05)(见表2)。
表2 NAFLD组与NAFLD组糖脂代谢及SUA水平比较(±s)

表2 NAFLD组与NAFLD组糖脂代谢及SUA水平比较(±s)
组别NAFLD组(n=159)非NAFLD组组(n=231)SUA(umol/L)TC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)FBG(mmol/L)2h-BG(mmol/L)FINS(mmoL/L)382.61+52.12 4.75+1.68 1.98+0.45 1.02+0.34 2.87+0.34 7.91+0.62 13.12+3.12 17.12+3.24 t P 291.24+53.25 16.796<0.001 4.42+1.71 1.886 0.060 1.15+0.43 18.379<0.001 1.28+0.26 8.547<0.001 2.56+0.31 9.327 0.0001 7.15+0.64 11.671<0.001 12.98+3.24 0.426 0.671 13.21+3.12 11.972<0.001
2.2 不同程度NAFLD患者糖脂代谢及SUA水平比较
随着NAFLD病情的加重,SUA、TG、FINS水平逐渐提高,HDL-C水平逐渐降低(P<0.05),TC、LDL-C、FBG、2 h-BG水平未见明显变化(P>0.05)(见表3)。
表3 不同程度NAFLD患者糖脂代谢及SUA水平比较(±s)

表3 不同程度NAFLD患者糖脂代谢及SUA水平比较(±s)
组别轻度NAFLD组(n=60)中度NAFLD组(n=68)重度NAFLD组(n=31)SUA(umol/L)361.12+21.45 TC(mmol/L)4.68+1.12 TG(mmol/L)1.48+0.26 HDL-C(mmol/L)1.19+0.12 LDL-C(mmol/L)2.79+0.68 FBG(mmol/L)7.79+0.74 2h-BG(mmol/L)13.02+1.13 FINS(mmoL/L)15.21+2.26 385.01+24.35*4.76+1.14 1.71+0.31*1.09+0.13*2.82+0.67 7.84+0.71 13.15+1.25 17.14+2.07*F P 398.14+23.14*#31.001<0.01 4.81+1.09 0.157 0.855 2.01+0.29*#35.155<0.01 0.98+0.11*#31.032<0.01 2.87+0.59 0.151 0.860 7.93+0.70 0.387 0.680 13.19+1.31 0.267 0.766 18.91+2.12*#32.058<0.01
2.3 SUA、TG、HDL-C、LDL-C、FBG、FINS水平预测T2DM患者NAFLD发生的ROC分析
经ROC分析,SUA、TG、HDL-C、LDL-C、FBG、FINS水平预测T2DM患者NAFLD发生的下曲线面积分别为0.910、0.860、0.812、0.785、0.926、0.862(见表4)。SUA、TG、HDL-C、LDL-C、FBG、FINS水平预测T2DM患者NAFLD发生的ROC曲线(见图1~6)。
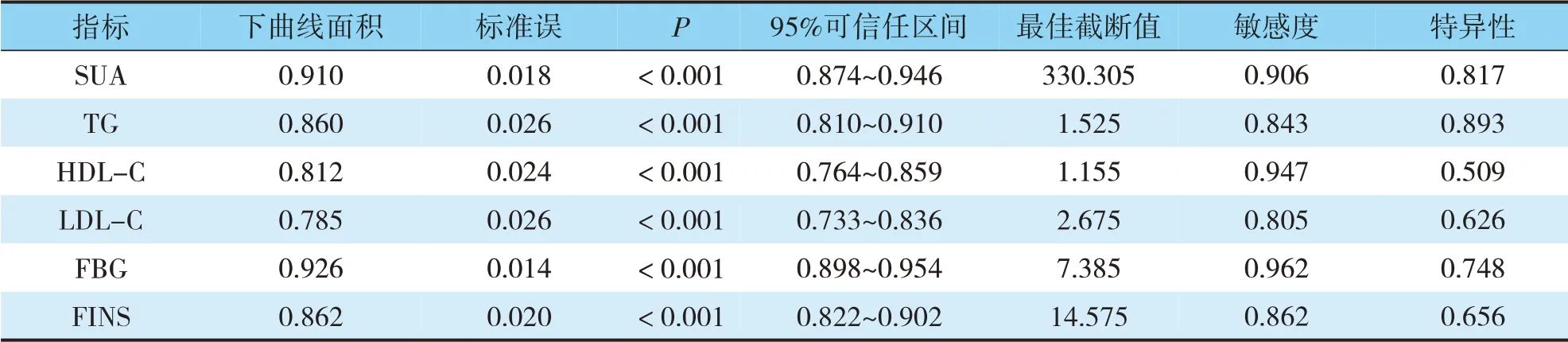
表4 SUA、TG、HDL-C、LDL-C、FBG、FINS水平预测T2DM患者NAFLD发生的ROC分析

图1 SUA预测T2DM患者NAFLD发生形成的ROC曲线

图2 TG预测T2DM患者NAFLD发生形成的ROC曲线
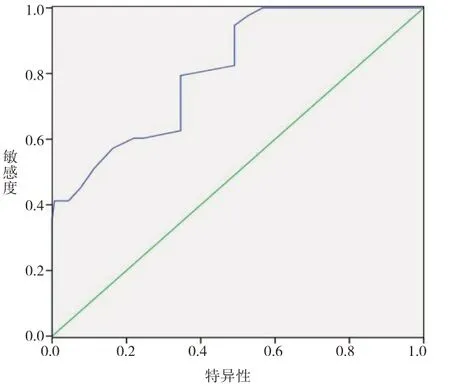
图3 HDL-C预测T2DM患者NAFLD发生形成的ROC曲线

图4 LDL-C预测T2DM患者NAFLD发生形成的ROC曲线
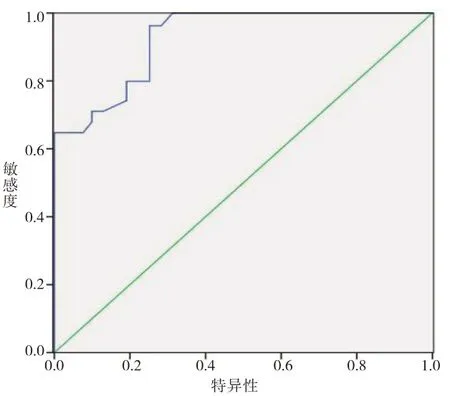
图5 FBG预测T2DM患者NAFLD发生形成的ROC曲线

图6 FINS预测T2DM患者NAFLD发生形成的ROC曲线
2.4 T2DM患者NAFLD严重程度与糖脂代谢及SUA水平的相关性
经相关性分析,T2DM患者NAFLD严重程度与SUA、TG、FINS水平呈正相关,与HDL-C水平呈负相关(P<0.05)(见表5)。

表5 T2DM患者NAFLD严重程度与糖脂代谢及SUA水平的相关性
3 讨论
近年来,NAFLD发生率逐年提高,由其引发的慢性疾病也随之增多,已成为影响人类生命安全与身体健康的常见疾病之一。T2DM患者发生NAFLD可能性显著高于正常人群。因此,临床需要找到T2DM患者NAFLD发生和发展的危险因素,并对其及时进行干预,以降低T2DM患者NAFLD发生率[9]。
本研究中NAFLD组SUA水平均显著高于非NAFLD组,随着NAFLD病情的加重,SUA水平逐渐提高。结果提示SUA水平可能是导致T2DM患者NAFLD发生和发展的影响因素。其原因分析如下:高浓度SUA会成为尿酸盐结晶沉积于患者机体中,刺激白细胞活化,释放炎症细胞因子,引发机体炎症反应,而部分可溶性SUA会进入平滑肌细胞,刺激单核细胞趋化因子发生作用,引起机体炎症因子水平提高,肝脏炎症反应提高时,会加重肝脂肪,促进T2DM患者NAFLD发生和发展[10,11]。同时,升高的SUA可促进脂蛋白氧化和脂质过氧化,促使氧自由基生成,促进机体氧化应激反应发生,导致肝脏炎症反应提高,影响NAFLD发生和发展[12,13]。另外,SUA水平与胰岛素抵抗呈正相关,胰岛素抵抗为NAFLD发生和发展的危险因素,其可促进脂肪组织中脂肪分解,使大量脂肪细胞中游离脂肪酸进入肝脏,而肝脏对游离脂肪酸的氧化作用被高浓度胰岛素抑制,导致游离脂肪酸被酯化为TG,致使TG在患者体内沉积,促使NAFLD发生[14,15]。
本研究中,NAFLD组TG、LDL-C、FBG、FINS均显著高于非NAFLD组,NAFLD组HDL-C显著低于非NAFLD组。随着NAFLD病情的加重,TG、FINS水平逐渐提高,HDL-C水平逐渐降低,TC、LDL-C、FBG、2 h-BG水平未见明显变化。结果提示糖脂代谢异常可能是导致T2DM患者NAFLD发生和发展的影响因素。其原因分析如下:T2DM患者体内长期处于血糖过高、胰岛素抵抗状态,胰岛β细胞分泌需要大量胰岛素以降低血糖,胰岛β细胞长期超负荷工作,致使其功能受损,胰岛素抵抗增加,促使NAFLD发生和发展。另外,NAFLD以肝内TG积聚为主要病理改变,因此,脂代谢紊异常与NAFLD的发生和发展密切相关,TG、LDL-C、HDLC水平异常对NAFLD的发生和发展也具有较大影响。
经ROC分析,SUA、TG、HDL-C、LDL-C、FBG、FINS水平预测T2DM患者NAFLD发生的下曲线面积分别为0.910、0.860、0.812、0.785、0.926、0.862。经相关性分析,T2DM患者NAFLD严重程度与SUA、TG、FINS水平呈正相关,与HDL-C水平呈负相关。提示SUA水平及糖脂代谢紊乱是T2DM患者NAFLD发生和发展的危险因素,因此,临床在对T2DM患者进行治疗时应对SUA水平及糖脂代谢指标予以关注,并及时采取相应干预措施,以控制T2DM患者NAFLD的发生及发展。
综上所述,SUA、TG、HDL-C、LDL-C、FBG、FINS水平对T2DM患者NAFLD发生具有重要影响,T2DM患者NAFLD严重程度与SUA、TG、HDLC、FINS水平密切相关,因此,临床应对具有以上特征的患者采取相应干预措施。
