沉默微小RNA-34a对类风湿关节炎大鼠症状改善和血清炎症因子水平的影响及其机制▲
2021-09-22刘亚东田大为
李 刚 刘亚东 徐 昕 张 鹏 熊 敏 田大为
(湖北医药学院附属国药东风总医院1 运动医学科,2 手外足踝显微外科,3 骨关节外,4 脊柱外科,十堰市 442008,电子邮箱:liy9592@163.com)
类风湿关节炎是最常见的风湿免疫性疾病,好发于50岁左右的女性[1]。类风湿关节炎属于自身免疫系统疾病,患者的骨关节组织以及滑膜组织受到破坏,最终可丧失劳动能力[2]。类风湿关节炎的发病机制是免疫细胞浸润后促进白细胞聚集并分泌炎性介质,最后导致血管翳形成、滑膜增生以及骨关节受损。类风湿关节炎是多因素导致的疾病,其中遗传因素、环境因素(寒冷、潮湿)以及长期抽烟是其主要的发病因素,早期不积极治疗会使疾病加重,并增加并发症发病率[3]。
成骨细胞由内外骨膜与骨髓基质中的间充质始祖细胞分化而来,能够特异性分泌多种生物活性物质,对骨的形成和重建产生影响[4]。目前认为类风湿关节炎的发生与多种细胞因子的异常表达相关,包括微小RNA(microRNA,miRNA)家族。miRNA-34a属于miRNA家族成员之一,有研究显示,其在类风湿关节炎滑膜组织或滑膜细胞中表达明显升高[4]。本研究探讨沉默miRNA-34a对类风湿关节炎大鼠症状改善和血清炎症因子水平的影响及其机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:无特定病原体级SD健康大鼠60只,购自深圳市亚辉龙生物科技股份有限公司[动物许可证号:SYXK(粤)2020-0220],鼠龄3~7(5.0±1.6)个月,体质量200~240(220.0±16.0)g,所有大鼠均在无菌的干净笼子里喂养,饮用水和食物均经高温及高压消毒,饲养温度为24℃,每天恒温光照12 h。本实验经我院伦理委员会批准。
1.1.2 主要试剂:水合氯醛(上海士锋生物科技有限公司,货号:EB05980);大鼠抗小鼠白细胞介素1β(interleukin 1β,IL-1β)抗体(上海振誉生物科技有限公司,货号:CSB-E08055r-1);Toll样受体4(Toll-like receptor 4,TLR4)抗体(上海恒斐生物科技有限公司,货号:K002172P);核因子κB抑制蛋白α(nuclear factor κB inhibitor α,IκBα)抗体(武汉益普生物科技有限公司,货号:ATA31699);肿瘤坏死因子α(tumor necrosis factor α,TNF-α)抗体(厦门研科生物技术有限公司,货号:IQP-163P);细胞间黏附因子1(intercellular adhesion factor 1,ICAM-1)抗体(北京孚博生物科技有限公司,货号:EBP11753);苏木精-伊红染色剂(北京伊塔生物科技有限公司,货号:YT8681),TRIzol试剂(北京伊塔生物科技有限公司,货号:YT2188),PCR试剂盒(上海抚生实业有限公司,货号:FS01P1954)。
1.2 实验方法
1.2.1 慢病毒载体构建:大鼠miRNA-34a的序列查找和设计均由GenePharma公司完成。重组的LV-miRNA-34a和LV-Sponge(抑制载体)慢病毒表达载体由GenePharma公司合成,并经测序进行验证;之后行慢病毒滴度测定(病毒滴度为108TU/mL),重组慢病毒制备完成后置于-80℃保存。
1.2.2 分组及建模:按照随机数字表法将60只大鼠随机分为空白组、模型组、过表达组、沉默组,各15只。其中模型组、过表达组、沉默组根据高燕萍等[5]方法建立类风湿关节炎大鼠模型。通过腹腔注射0.2~0.5 mL/100 g 10%水合氯醛将大鼠麻醉后,以仰卧位将大鼠的头部和四肢固定在手术台上。消毒大鼠尾根部后注射0.2 mL热杀死(160℃~180℃,2 h)结核分枝杆菌(5 mg/mL;上海臻科生物科技有限公司),最后用消毒棉球压住注射部位,防止药物渗出。注射处无液体外漏后,把大鼠放进笼中让其自然苏醒和活动。建模后对大鼠进行关节指数评分,关节指数评分>4分说明建模成功。关节指数评分标准[5],0~4分分别为无肿胀、指关节稍肿、关节轻度红肿、关节中度红肿和轻度功能障碍、关节重度红肿接近畸形,16分为最高分数。建模成功后,于沉默组大鼠双后肢骨关节处注射含10 μL LV-Sponge抑制载体的慢病毒悬液,于过表达组大鼠双后肢骨关节处注射含10 μL LV-miRNA-34a表达载体的慢病毒悬液,空白组、模型组大鼠不做任何处理,干预7 d后进行后续实验。
1.2.3 前足跖肿胀度、关节组织评分:采用玻璃容器法测定大鼠左侧前足跖肿胀度情况,首先将直径2 cm、高8~10 cm的玻璃试管固定在铁架台上,注入适量的水。然后在大鼠前足跖关节处画一刻度线,作为大鼠前足跖入水刻度的标志。试验时将大鼠前足跖踝关节刻度线以下的足跖没入水中,水面自然升高,此时在水面的最高处画一刻度线,然后取出大鼠前足跖踝关节,用1 mL注射器向玻璃试管内加水至大鼠前足跖足跖入水后所画的刻度线,所加入的水的体积便是大鼠前足跖的体积。双后肢关节组织评分,0~4分分别为正常、轻度红肿、中等程度红肿、严重肿胀、关节畸形。
1.2.4 TNF-α、IL-1β、ICAM-1水平的检测:常规采集大鼠尾部空腹静脉血液4 mL置于无抗凝剂的一次性真空采血管中备用,标本置于37℃孵箱孵育,待血液完全凝固后3 000 r/min离心10 min分离血清,置于-20℃保存待测。采用酶联免疫吸附试验法检测血清TNF-α、IL-1β、ICAM-1水平。将血清样本置于室温复温后,取出试剂盒,标记酶标板,制作标准品,以1 ∶2的稀释液稀释样品;在反应孔上依次加入稀释好的待测血清及标准品,100 μL/孔,放于37℃恒温孵育箱中湿育2 h;用专用洗涤液将反应板清洗3次后,加入抗体工作液(按1 ∶100倍稀释),100 μL/孔,置于37℃恒温孵育箱中湿育45 min;继续清洗反应板4次后,在反应孔内加入3,3′,5,5′-四甲基联苯胺溶液,100 μL/孔,置于37℃恒温孵育箱中湿育45 min后在反应孔内加入终止液(100 μL/孔)以终止反应,在酶标仪上读取450 nm处波长(参考波长570~630 nm)的吸光度,绘制标准曲线计算TNF-α、IL-1β、ICAM-1水平。
1.2.5 切片及染色:采用断头法处理大鼠,取大鼠双后肢关节滑膜组织,使用40 mL/L多聚甲醛固定后常规石蜡包埋、切片,厚度为3 μm,之后行苏木精-伊红染色,使用光学显微镜观察大鼠关节滑膜组织病理学变化。
1.2.6 成骨细胞增殖和凋亡检测:(1)细胞增殖检测。将大鼠在体积分数为75%的乙醇中浸泡3~5 min,取头盖骨,清除骨膜、血管等软组织,磷酸缓冲盐溶液清洗后剪成1 mm×1 mm的小块,0.25%胰蛋白酶37℃消化20 min,0.1%Ⅱ型胶原酶中37℃震荡,取细胞悬液,1 000 r/min离心10 min将沉淀的细胞块加入培养液,细胞计数后分装与25 mL培养瓶中,置于显微镜下观察后放入37℃、5% CO2培养箱培养24 h后贴壁2.0~3.0 d换液1次,待长满培养瓶时开始传代。取各组大鼠的成骨细胞,培养至对数生长期后,将成骨细胞分别接种于96孔板,2 000个/孔,每组设置5个复孔,每孔均加入完全培养基,在37℃、含5%二氧化碳的细胞培养箱中培养24 h、48 h和72 h后,在培养终止前4 h向每孔细胞中加入20 μL 5 mg/mL的四甲基偶氮唑盐溶液,4 h后吸去培养液,加入100 μL的二甲基亚砜,振荡器震荡5 min后读取酶标仪490 nm波长处的吸光度值,计算细胞增殖率,细胞增殖率=(细胞组的吸光度/空白孔的吸光度-1)×100%。(2)细胞凋亡检测。将各组对数生长期的大鼠成骨细胞传代后,取第2代成骨细胞接种至6孔板中(接种密度为5×107/L),并将其置于饱和湿度、37℃、含5%二氧化碳的细胞培养箱培养24 d、48 d和72 d后,加入0.25%浓度的胰蛋白酶进行消化,2 000 r/min离心5 min后收取细胞,随即使用磷酸缓冲盐溶液洗涤3 min,再重复洗涤2次,再次以2 000 r/min离心5 min后收集细胞,加入1 mL碘化丙啶染液后在常温、避光的环境中放置1 h并用特异荧光标记,在鞘液包裹下高速流动,流动期间会发射出光子,严格按照流式细胞仪检测方法,利用发光信号测量仪检测光子数值,检测细胞凋亡情况。
1.2.7 TLR4、IκBα mRNA表达水平的检测:取各组大鼠双后肢关节组织,加入1 mL TRIzol后研磨为粉末状,按照试剂盒说明书提取大鼠关节组织中总RNA,采用Eppendorf 核酸蛋白分析仪鉴定及测定RNA浓度和纯度,应用GeneAmp PCR System 9700核酸扩增仪(美国ABI公司)将RNA反转录成cDNA,试剂盒购自纳昂达(南京)生物科技有限公司(批号:232-964-5)反应条件为37℃ 15 min、85℃ 5 s,将获得的cDNA放于4℃保存。以cDNA为模板,以β-肌动蛋白作为内参,配置20 μL反应体系,包括上下游引物各0.4 μL、1 μL cDNA模板、10 μL SYBR Green,加蒸馏水至20μL。反应条件为95℃预变性30 s、95℃ 5 s、60℃ 31 s,共进行40个循环。使用美国生产的ABI 7300型PCR仪进行实时定量PCR。采用2-ΔΔCt方法计算TLR4、IκBα mRNA表达水平。使用Primer 5.0软件设计引物序列,β-肌动蛋白引物为上游5′-CTGTCCACCTTCCAGCAGATGT-3′,下游5′-CGCAACTAAGTCATAGTCCGCC-3′;TLR4的上游引物5′-ACTTGGACCTTTCCAGCAAC-3′,下游引物5′-TTTAAATGCACCTGGTTGGA-3′;IκBα的上游引物5′-AATACCCCTCTCCATC,下游引物5′-CAGCACCCAAAGTCAC。引物由上海捷瑞生物工程有限公司合成。
1.3 统计学分析 采用SPSS 26.0软件进行统计学分析。计量资料以(x±s)表示,方差齐的计量资料比较采用单因素分析,两两比较采用LSD-t检验,方差不齐则使用非参数检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠前足跖肿胀度和关节组织评分的比较 与空白组比较,模型组、过表达组、沉默组大鼠足跖肿胀度、关节组织评分均升高(均P<0.05),过表达组、模型组、沉默组大鼠足跖肿胀度、关节组织评分依次降低(均P<0.05)。见表1。
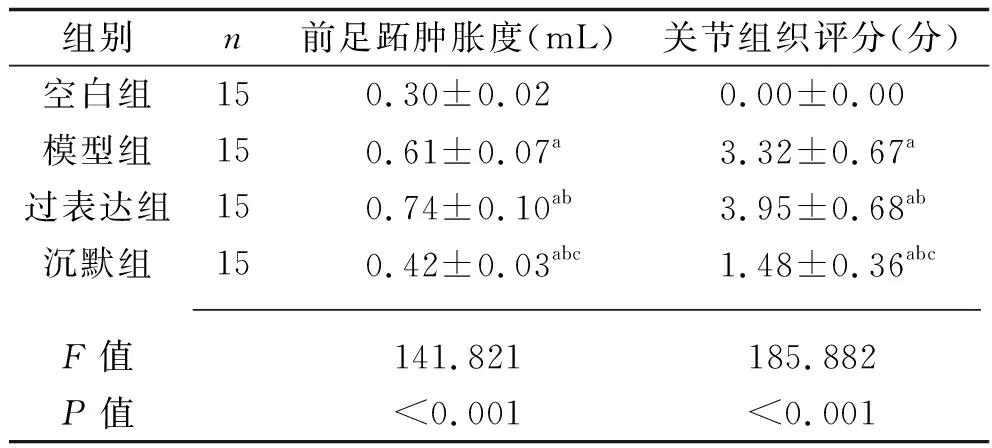
表1 4组大鼠前足跖肿胀度和关节组织评分的比较(x±s)
2.2 各组大鼠血清炎因子水平的比较 与空白组比较,其他3组大鼠血清TNF-α、IL-1β、ICAM-1水平升高(均P<0.05);过表达组、模型组、沉默组大鼠血清TNF-α、IL-1β、ICAM-1水平依次降低(均P<0.05)。见表2。
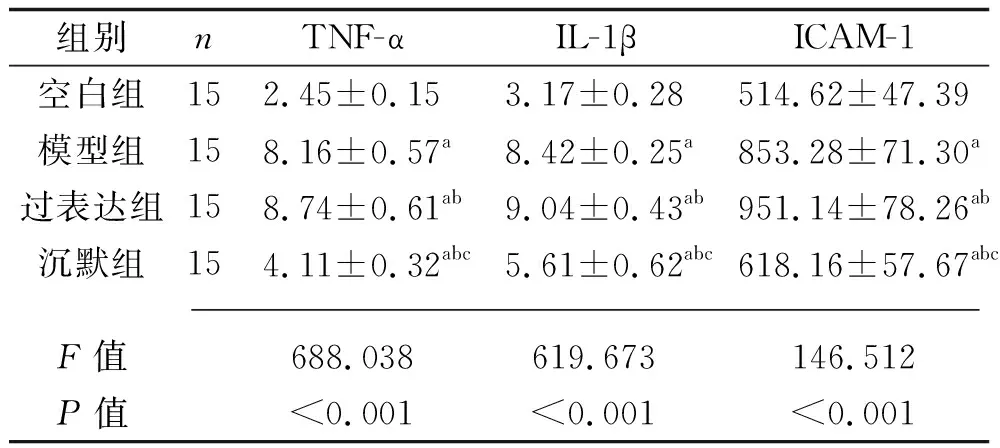
表2 4组大鼠血清炎因子水平的比较(x±s,pg/mL)
2.3 各组大鼠关节滑膜组织的病理学变化 空白组大鼠关节间隙圆滑清晰,关节间隙中无炎症细胞;模型组大鼠关节软骨和成骨组织破坏;过表达组关节滑膜组织中可见有大量炎细胞浸润,组织内增生明显;沉默组关节滑膜组织中炎症细胞浸润减少,软骨和成骨组织破坏程度明显减轻。见图1。
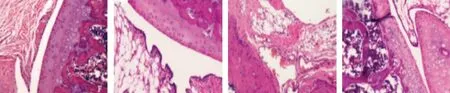
空白组 模型组 过表达组 沉默组
2.4 各组大鼠成骨细胞各时间点增殖率和凋亡率的比较 各时间点,与空白组相比,其他3组成骨细胞增殖率降低,凋亡率升高;过表达组、模型组、沉默组大鼠成骨细胞增殖率依次升高,凋亡率依次降低(均P<0.05)。见表3。
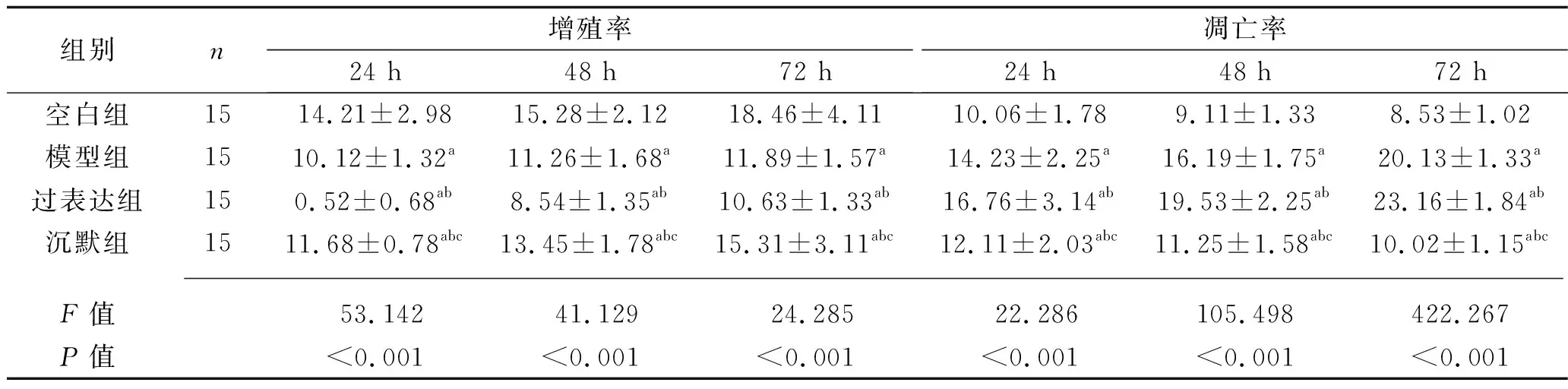
表3 4组大鼠成骨细胞各时间点增殖率和凋亡率的比较(x±s,%)
2.5 各组大鼠关节组织TLR4、IκBα mRNA相对表达水平的比较 与空白组比较,其他3组大鼠关节组织TLR4、IκBα mRNA相对表达水平升高,过表达组、模型组、沉默组大鼠关节组织TLR4、IκBα mRNA相对表达水平依次降低(均P<0.05)。见表4。

表4 4组大鼠关节组织中TLR4和IκBα mRNA相对表达水平的比较(x±s)
3 讨 论
类风湿关节炎是一种以炎性滑膜炎为主要特征的疾病,以手、足多关节、侵袭性的小关节炎症为主要表现,常伴随着关节外器官受累,可导致关节畸形和关节功能丧失[6-7],病因较为复杂。成骨细胞是骨形成过程中一种至关重要的细胞,主要负责骨基质的合成、分泌以及矿化。成骨细胞主要通过成骨细胞的增殖、细胞外基质的成熟、细胞外基质的矿化以及成骨细胞的凋亡4个方面影响骨形成,其功能的活跃程度以及活跃状态与骨形成密切相关[8-9]。在正常的机体生理条件下,成骨细胞介导的骨形成及破骨细胞介导的骨吸收之间相互影响,使骨细胞的修复和重建处于动态平衡,这可有效维持机体正常的骨量以及骨密度。发生类风湿关节炎后,机体的骨形成和骨吸收之间的动态平衡被破坏,导致骨结构、密度出现异常[10-11]。
miRNA-34a在细胞衰老、细胞周期阻滞和细胞凋亡中有着重要作用,还可以调节T、B淋巴细胞的分化,参与自身免疫性疾病的发病机制。研究显示,在类风湿关节炎大鼠模型中,miRNA-34a受到抑制时,滑膜细胞凋亡率降低,且低于正常大鼠[12]。本研究建立类风湿关节炎大鼠模型后,观察沉默miRNA-34a对症状缓急以及成骨细胞的影响,结果显示,沉默miRNA-34a后可明显抑制类风湿关节炎大鼠前足跖肿胀,缓急关节症状,抑制成骨细胞凋亡,促进成骨细胞的增殖。
TNF-α是炎症反应的重要细胞因子,主要通过激活成骨细胞和促进成骨细胞增殖来促进炎症反应,从而参与类风湿关节炎的发生[13]。TNF-α还可以直接作用于成骨细胞,激活骨细胞产生蛋白酶和前列腺素E2进一步保护软骨不受侵蚀和破坏[14]。研究表明,类风湿关节炎患者的血清和关节液中TNF-α均高表达[15]。IL-1β存在于单核细胞与软骨细胞内,可以促进炎症发展和激活骨细胞,是影响类风湿关节炎发生和发展的主要细胞因子[16]。栾仲秋等[17]研究发现,IL-1β在类风湿关节炎患者的软骨细胞中表达上调,对细胞凋亡有重要的调节作用;抑制IL-1β表达可以有效保护骨组织不受破坏,同时还可以抑制类风湿关节炎的发展。ICAM-1属于免疫球蛋白,主要参与免疫监督和炎症反应[18]。研究表明,ICAM-1与炎症细胞的黏附和浸润有密切关系。本研究结果显示,沉默miRNA-34a后,类风湿关节炎大鼠血清TNF-α、IL-1β、ICAM-1水平降低,提示沉默miRNA-34a表达可以抑制类风湿关节炎大鼠体内的炎性反应。
TLR4属于Toll样受体,分布于各组织细胞内,在淋巴组织中表达最高[19]。TLR4可以选择性地识别病原体,然后激活机体产生抗体[20]。近年来有研究显示,TLR4在免疫炎症反应中起关键作用,可以刺激骨细胞释放促炎因子,且发病早期类风湿关节炎患者/大鼠关节滑膜中TLR4蛋白表达水平上升[21]。IκBα主要存在于真核细胞,控制着细胞分化和凋亡等过程,IκBα缺乏可导致各种疾病的发生[22]。在成骨细胞内,miRNA-34a受特异性因子调节,这导致细胞周期停滞、细胞增殖能力降低,且可以调节淋巴细胞的分化[23]。本研究结果显示,沉默miRNA-34a后,类风湿关节炎大鼠关节组织中TLR4、IκBα mRNA表达水平降低,这提示沉默miRNA-34a可能通过抑制TLR4/IκBα信号通路从而发挥促进成骨细胞增殖、抑制细胞凋亡的作用。
综上所述,沉默miRNA-34a可以抑制类风湿关节炎大鼠体内的炎症反应,并缓解关节症状,机制可能与其下调TLR4/IκBα信号通路从而促进成骨细胞增殖、抑制细胞凋亡有关。
