原花青素对Erastin诱导SH-SY5Y细胞铁死亡的神经保护作用
2021-09-22王凯旋彭驰伟罗北娇
陈 玲,王凯旋,彭驰伟,罗北娇,陈 薇
(1桂林医学院药学院药理实验室,桂林 541001;2桂林医学院附属医院药剂科;*通讯作者,E-mail:daicw1104@163.com)
铁死亡(ferroptosis)是在2012年被最先提出的一种概念[1]。它是区别于传统死亡形式的铁依赖性、脂质过氧化物积累的新型细胞死亡形式。其在细胞形态学及生化特征方面与凋亡、坏死以及自噬有着明显不同[2,3]。近年来研究表明铁死亡参与多种疾病的发生过程,特别是神经退行性疾病及创伤性神经系统损伤疾病,而神经细胞死亡又是许多神经系统疾病的主要病理事件[4-6]。脑组织中由于含有大量不饱和脂肪酸和较低水平的抗氧化酶,如谷胱甘肽过氧化物酶(GPX4)等,易受羟自由基进攻而发生脂质过氧化导致神经细胞损伤[7]。因此神经系统与铁死亡密切相关。
原花青素(proantho cyanidins,PC)是一种广泛存在于植物的天然多酚类化合物,是由不同数量的儿茶素或表儿茶素缩合而成聚合体,具有超强的抗氧化性,是目前公认清除自由基的天然抗氧化剂[8-10]。研究表明[11,12],PC不仅能够有效清除自由基,防止脂质发生过氧化损伤,还能够提高抗氧化酶的活性从而达到保护作用。目前PC已应用于多种疾病的研究,但在神经细胞中具体作用尚不明确。本文采用与正常神经细胞相似的、被广泛应用于神经系统疾病研究的人神经母细胞瘤SH-SY5Y细胞,以Erastin损伤SH-SY5Y细胞为研究模型,探讨PC抑制细胞铁死亡的神经保护作用。
1 材料与方法
1.1 细胞、药物及试剂

1.2 主要仪器
恒温培养箱(德国艾本德公司)、离心机(德国艾本德公司)、多功能酶标仪(Infinite F500瑞士TECAN)、倒置荧光显微镜(IX73,日本OLYMPUS)、凝胶成像分析仪(美国BIO-RAD公司)。
1.3 细胞分组及处理
SH-SY5Y细胞随机分为5组:①对照组(control组):使SH-SY5Y细胞处于DMEM完全培养基中培养24 h;②Erastin组:使用终浓度20 μmol/L Erastin处理SH-SY5Y细胞24 h;③低浓度PC组:使用10 μmol/LPC和20 μmol/L Erastin混匀后共孵育SH-SY5Y细胞24 h;④中浓度PC组:使用20 μmol/L PC和20 μmol/LErastin混匀后共孵育SH-SY5Y细胞24 h;⑤高浓度PC组:使用30 μmol/L PC和20 μmol/L Erastin混匀后共孵育SH-SY5Y细胞24 h。
1.4 CCK-8法检测SH-SY5Y细胞活力
取对数生长期SH-SY5Y细胞,以6 000个/孔均匀地接种于96孔板,当细胞密度长到约为70%-80%时,分别使用浓度为5,10,20 μmol/LErastin及浓度为10,20,40 μmol/LPC予以相应处理;另外将20 μmol/LErastin与不同浓度PC(10,20,30 μmol/L)混匀后共同处理细胞,同时设置对照组及溶剂对照组(DMSO组),每组6个复孔,置于培养箱孵育24 h后弃去培养基,每孔加入100 μl CCK-8工作液(CCK-8 ∶DMEM=1 ∶10),置于培养箱孵育1 h后,用酶标仪测定450 nm处吸光度值(A450 nm)。细胞存活率(%)=(实验孔-空白孔)/(对照孔-空白孔)×100%。实验重复5次。
1.5 活性氧试剂盒检测细胞内活性氧(reactive oxygen species,ROS)水平
以1.5×105个/孔均匀地接种于6孔板,当细胞密度长到约为70%-80%时,使用不同浓度的PC分别与20 μmol/LErastin混匀后置于培养箱孵育24 h后弃去培养基,用PBS洗涤两次,每孔加入1 ml稀释好的DCFH-DA(DCFH-DA ∶无血清DMEM为1 ∶1 000),37 ℃细胞培养箱孵育20 min(加探针和孵育过程要避光操作),无血清DMEM洗涤3次,在荧光倒置显微镜下观察,应用图形分析软件(Image J)计算出绿色荧光强度平均值,并对每组数据进行统计分析。实验重复3次。
1.6 Image-iT脂质过氧化试剂盒检测细胞内脂质过氧化(lipid peroxidation,LPO)水平
以1.5×105个/孔均匀地接种于6孔板,当细胞密度长到约为70%-80%时,使用不同浓度的PC分别与20 μmol/L Erastin混匀后置于培养箱孵育24 h后弃去培养基,用PBS洗涤2次,加入10 μmol/L BODIPYTM581/591 C11(一种荧光探针,脂质过氧化传感器)溶液和细胞一起在37 ℃细胞培养箱孵育30 min(加探针和孵育过程要避光操作),PBS洗涤3次,在荧光倒置显微镜下观察,应用图形分析软件(Image J)计算出绿色荧光强度平均值,并对每组数据进行统计分析。实验重复3次。
1.7 铁离子比色法检测细胞内铁含量变化
以8×104个/孔均匀地接种于24孔板,当细胞密度长到约为70%-80%时,使用不同浓度的PC分别与20 μmol/LErastin混匀后置于培养箱孵育24 h后弃去培养基,用冷的PBS洗涤2次,每孔加入200 μl裂解液置于摇床裂解2 h后,加入200 μl的混液A(按说明书配制)收集混匀,60 ℃水浴孵育1 h,加入60 μl铁离子检测剂混匀,室温孵育30 min,取200 μl于96孔板,用酶标仪测定570 nm处吸光度(optical density,OD)。根据标准曲线计算出铁离子浓度。实验重复3次。
1.8 总谷胱甘肽试剂盒检测细胞内总谷胱甘肽含量变化
以2.5×105个/孔均匀地接种于6孔板,当细胞密度长到约为70%-80%时,使用不同浓度的PC分别与20 μmol/L Erastin混匀后置于培养箱孵育24 h后弃去培养基,用PBS洗涤一次,离心收集细胞,加入沉淀体积3倍量的蛋白去除试剂S溶液,充分涡旋,然后用液氮和37 ℃水浴进行两次快速冻融,4 ℃ 10 000g离心10 min得待测样品。取10 μl待测样品于96孔板,加入150 μl总谷胱甘肽检查工作液(按说明书配制)后置于摇床混匀,室温孵育5 min,加入50 μl的0.5 mg/ml NADPH溶液(按说明书配制)混匀,室温孵育1 h,用酶标仪测定405 nm处吸光度(optical density,OD)。根据标准曲线计算出总谷胱甘肽含量。实验重复3次。
1.9 Western blot法检测GPX4、xCT蛋白表达
收集药物干预后的细胞,使用加入PMSF和磷酸酶抑制剂的细胞蛋白裂解液,冰上裂解,使用细胞刮刮下细胞进行超声,4 ℃ 12 000g离心30 min,对适量上清液采用BCA法进行蛋白质定量。将蛋白样品与4×上样缓冲液按3 ∶1体积混合,100 ℃煮沸8 min变性。通过丙烯酰胺凝胶电泳后,转移至PVDF膜上,用5%脱脂奶粉封闭2 h后,加入GPX4、xCT抗体(1 ∶1 000)4 ℃过夜孵育,用TBST洗涤,二抗(1 ∶5 000)室温孵育1 h,TBST洗涤,然后用免疫印迹化学发光试剂(ECL)进行反应,曝光,使用Image J软件分析结果。实验重复3次。
1.10 统计学处理
2 结果
2.1 PC、Erastin分别对SH-SY5Y细胞增殖的影响
CCK-8结果显示,不同浓度梯度的Erastin(5,10,20 μmol/L)作用细胞24 h,各组细胞增殖受到不同程度的影响,当浓度为20 μmol/LErastin时,细胞生长受到明显抑制,细胞活力为(50.56±2.5)%,差异有统计学意义(P<0.001,见图1),故此浓度为后续实验浓度;不同浓度的PC(10,20,40 μmol/L)作用于细胞24 h,当PC浓度为40 μmol/L时,细胞活力(84.59±2.3)%,差异有统计学意义(P<0.001,见图1),故后续实验原花青素作用浓度的需小于40 μmol/L。

与对照组相比,***P<0.001图1 Erastin或PC处理SH-SY5Y细胞24 h后对细胞存活率的影响Figure 1 Effect of Erastin or PC on SH-SY5Y cell survival rate at 24 h
2.2 PC对Erastin损伤SH-SY5Y细胞存活率的影响
CCK-8结果显示,40 μmol/L的PC抑制了SH-SY5Y细胞生长,对细胞具有一定毒性,故选择浓度梯度(10,20,30 μmol/L)的PC分别与20 μmol/L Erastin共孵育细胞24 h,从统计结果图中看出30 μmol/L的PC对Erastin损伤SH-SY5Y细胞具有保护作用并增强了细胞活力(见图2),故在后续实验中使用10,20,30 μmol/L作为PC对SH-SY5Y细胞的作用浓度。
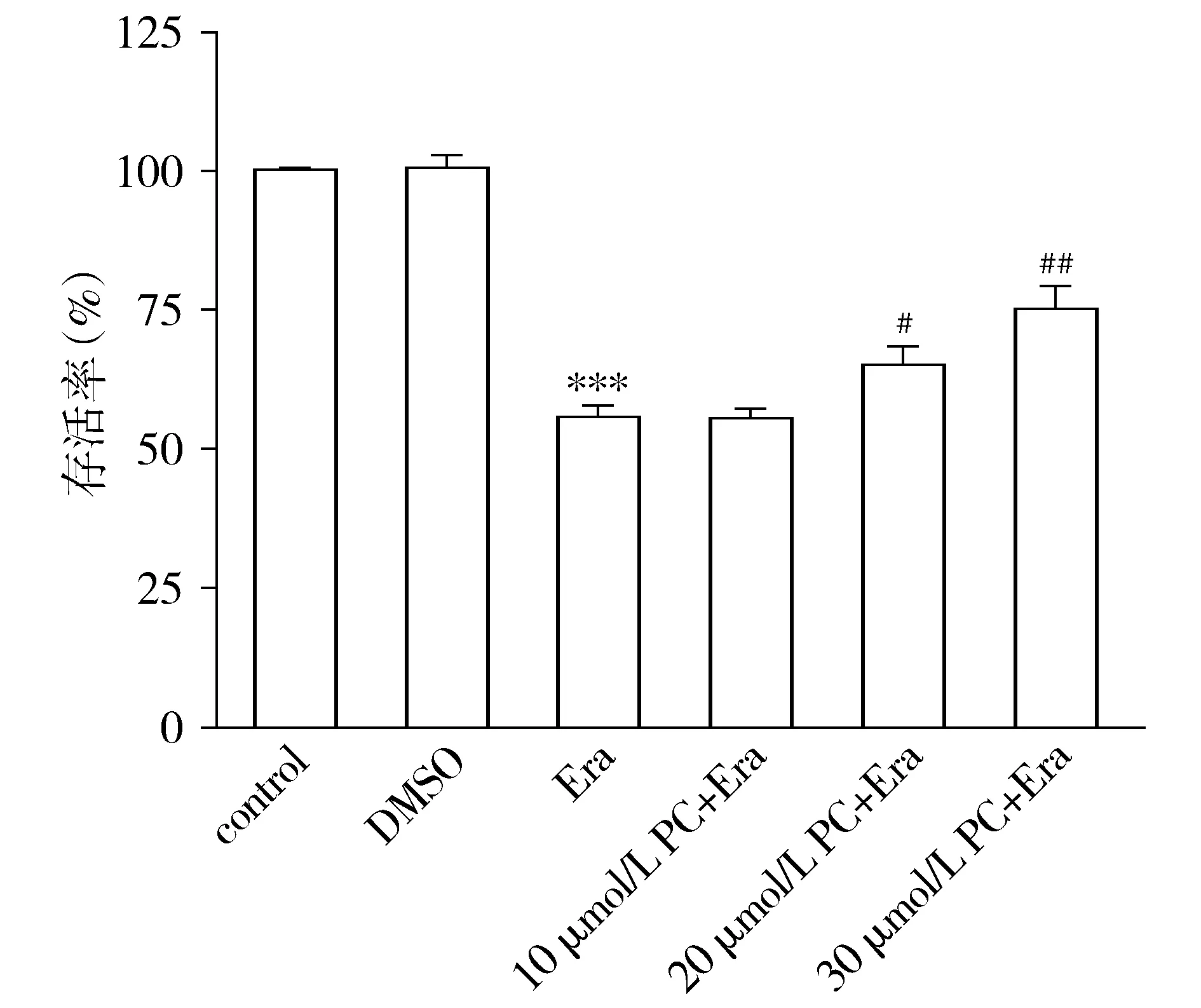
与对照组相比,***P<0.001;与Erastin组相比,#P<0.05,##P<0.01图2 不同浓度PC与20 μmol/L Erastin共孵育细胞24 h后对细胞活力的影响Figure 2 Effects of different concentrations of PC co-incubated with 20 μmol/L Erastin for 24 h on cell viability
2.3 PC对Erastin损伤SH-SY5Y细胞内ROS、LPO的影响
实验结果显示,20 μmol/L Erastin损伤细胞24 h后ROS及LPO水平较对照组明显增加(P<0.05或P<0.001),而PC处理后的细胞内ROS及LPO水平较Erastin组明显降低(P<0.01或P<0.001,见图3,4),提示PC抑制细胞内ROS和LPO的生成。
2.4 PC对Erastin损伤SH-SY5Y细胞内铁离子及GSH含量的影响
实验结果显示,与对照组比较,20 μmol/L Erastin损伤细胞24 h后细胞内发生了铁离子积累(P<0.001),GSH合成减少(P<0.001),而PC处理后的细胞较Erastin组铁离子含量降低(P<0.05),GSH含量增加(P<0.05,见图5)。
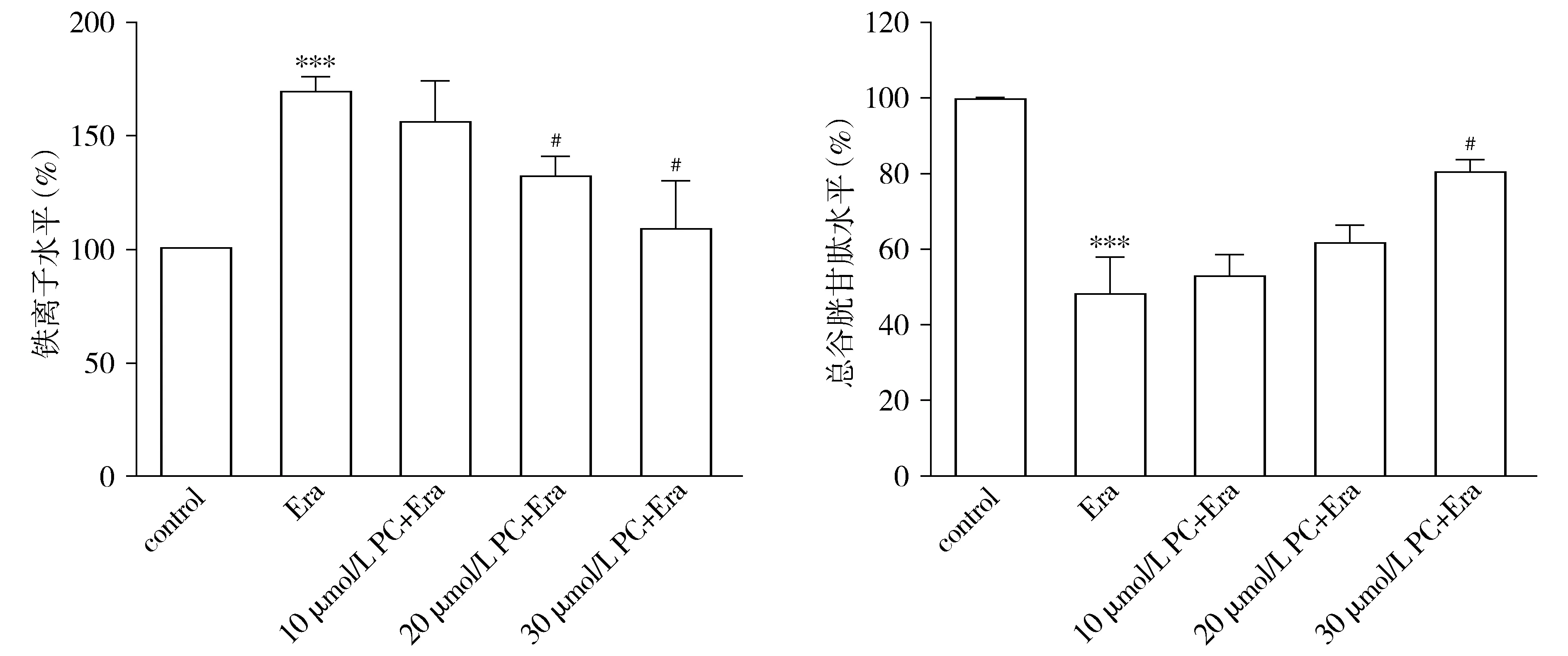
与对照组相比,***P<0.001;与Erastin组相比,#P<0.05图5 PC对Erastin损伤的SH-SY5Y细胞铁和谷胱甘肽含量的影响Figure 5 Effects of PC on iron and GSH content in SH-SY5Y cells damaged by Erastin
2.5 PC对SH-SY5Y细胞GPX4和xCT蛋白表达的影响
利用Western blot检测细胞中GPX4和xCT蛋白的表达。结果显示,与对照组比较,Erastin组中的GPX4及xCT蛋白表达水平显著降低(P<0.001);而PC处理后的组中GPX4及xCT蛋白表达较Erastin组显著升高(P<0.001),差异具有统计学意义(见图6)。

与对照组比较,**P<0.01,***P<0.001;与Erastin组比较,#P<0.05,##P<0.01,###P<0.001图6 PC对铁死亡相关蛋白GPX4和xCT表达的影响Figure 6 Effect of PC on expression of ferroptosis-related proteins GPX4 and XCT
3 讨论
铁死亡是一种新型非凋亡形式的细胞死亡方式,这种死亡是由铁依赖性的脂质过氧化物积累到毒性水平引起的,其生化特征主要有铁积累,谷胱甘肽耗竭脂质过氧化积累等[13]。研究表明[14,15],铁死亡特征已在多种疾病中被发现,尤其是与神经系统相关的疾病,并且体内外实验证明干预诱导或抑制铁死亡,可为治疗这些疾病提供新方法。PC是目前应用最广泛的酚类物质,不仅具有清除自由基、抗氧化活性,还具有抗炎、抗过敏和抗肿瘤活性,此外,它们还可以螯合金属(如铁),激活抗氧化酶(如GPX4)等[16]。研究显示,所含的酚类结构对铁超载所致肾脏、肝脏氧化损伤具有明显的抑制作用[17,18],同时,其抗氧化性及螯合作用对铁死亡引起的脊髓继发性损伤具有一定的修复作用[19]。但PC在神经系统疾病中对铁死亡的作用机制尚不明确,因此,本研究初步探讨PC对神经细胞铁死亡保护作用及其机制。
Erastin作为最早发现的铁死亡激活剂,其诱导的细胞死亡是由铁依赖的脂质过氧化介导的,并被抗氧化剂或铁螯合剂抑制[20]。其主要通过抑制胱氨酸/谷氨酸逆转运体系统(xCT)诱发铁死亡导致胱氨酸输入减少,谷胱甘肽耗竭从而降低GPX4清除过氧化物的能力,造成LPO过度积累,最终导致细胞发生铁死亡。同时,又有研究表明Erastin诱导的细胞死亡会导致细胞内铁离子增多,进一步引发芬顿反应造成ROS积累,引起脂质过氧化[21-23]。而ROS又是细胞死亡的介质,特别是脂质ROS是铁死亡的必要因素。因此,本研究通过建立铁死亡模型,研究PC对Erastin诱导细胞铁死亡的抑制作用。实验结果表明,Erastin能够诱导细胞发生铁死亡,而与Erastin损伤组比较,PC组细胞内ROS、LPO水平及铁离子含量降低,GSH水平升高,表明PC能够抑制SH-SY5Y细胞铁死亡的发生;为了进一步探讨PC的神经保护作用,我们检测了xCT和GPX4的蛋白表达情况,结果显示PC上调了xCT和GPX4的蛋白水平,证实了PC对SH-SY5Y细胞的神经保护作用。
综上所述,PC对SH-SY5Y细胞铁死亡的作用,可能是通过调控xCT/GPX4信号通路,保护细胞免受Erastin诱导的各种损伤。我们的研究结果为进一步深入研究PC在神经保护机制方面提供了依据,但其他铁死亡通路的相关因子还有待进一步被研究探索。
