lncRNA FTX对结肠癌伊立替康耐药株增殖、迁移能力的影响
2021-09-22程柏杨潘鹭翔朱茂荣王盈雯顾锦涛
程柏杨,潘鹭翔,朱茂荣,王盈雯,顾锦涛*
(1空军军医大学药学系生物制药学教研室,西安 710032;2空军军医大学基础医学院;*通讯作者,E-mail:gujintao@fmmu.edu.cn)
结肠癌是目前人类消化道最常见的恶性肿瘤之一,根据最新的研究,每年有超过3 000万人被诊断出结肠癌[1]。结肠癌的发生、发展是一个复杂且异质性的过程,由多种发病因素相互作用引起,包括遗传因素和环境因素。临床上结肠癌的治疗常以手术为主、辅以放化疗,化疗对中晚期结肠癌有着非常重要的作用,但肿瘤细胞对化疗药物的耐药性常导致化疗失败,进而导致局部复发甚至远处转移[2,3]。肿瘤的耐药性依旧是影响临床肿瘤治疗效果的重要因素,为癌症的治疗带来了很大挑战。抑制和逆转结肠癌耐药细胞的发生发展是提高临床疗效的关键[4]。因此,寻找影响肿瘤耐药相关的关键分子,对开发新的治疗靶点及预后评估具有重要意义[5]。结肠癌的发生和进展与多种基因的突变密切相关,因此,在基因和分子水平研究结肠癌可以为临床治疗提供重要的诊疗靶点。
长链非编码RNA(long noncoding RNA,lncRNA)是一种长度大于200 bp且没有蛋白编码功能的RNA[6]。近年来研究发现,lncRNA可以通过与不同的分子如mRNA、小分子RNA、蛋白质等发挥作用,进而影响肿瘤的发生发展[7]。尽管对肿瘤药物抗性机制的研究不断进展,但是对由lncRNA介导的耐药机制的认识仍然相当有限。FTX(five prime to Xist)基因是人类X染色体上的一个非蛋白质编码基因,是位于X染色体失活(XCI)的保守转录本。FTX除了编码两个microRNA分子(miRNAs)外,还编码一个高度保守的转录产物,即lncRNA FTX。研究表明lncRNA FTX在调控Xist(X染色体失活中心)表达中起着重要作用。既往研究发现lncRNA FTX与卵巢癌、结直肠癌等恶性肿瘤的进展密切相关[8,9],但没有系统阐述lncRNA FTX与肿瘤化疗耐药关系的研究。本研究旨在通过研究lncRNA FTX对结肠癌伊立替康耐药细胞增殖和迁移能力的影响,进而从分子水平阐述lncRNA FTX与结肠癌伊利替康耐药的相关性。
1 材料与方法
1.1 材料和主要试剂
结肠癌细胞系HCT-116购于中科院上海细胞研究所,McCoy’s 5A、磷酸盐缓冲液(PBS)培养基及胎牛血清购自美国Gibco公司,盐酸伊立替康(美国Selleck),CCK-8试剂盒购自上海陶素生化科技有限公司,嘌呤霉素、Trizol试剂购自美国Thermo公司,RIPA蛋白裂解液购自上海碧云天生物技术有限公司,RNA逆转录试剂盒及荧光定量PCR试剂盒购自日本Takara公司,兔源多克隆抗体GAPDH、c-myc、Vimentin、MTA-1,辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗及DAB显色液均购自英国Abcam公司,RT-qPCR引物均由北京擎科生物科技有限公司设计合成。慢病毒载体构建包装并购于上海吉凯基因科技有限公司。
1.2 实验方法
1.2.1 数据库分析 lnCAR数据库(https://lncar.renlab.org/)是由中山大学的学者开发的收集整理了来自GEO数据库(基因表达综合数据库)中肿瘤样本的lncRNA差异表达分析及生存分析。我们从该数据库中获取了80例临床样本(CR-S174)FTX的表达情况以及70例结肠癌患者(CR-O18)的预后,并进行统计学分析。
1.2.2 细胞培养 配制含10%胎牛血清、1%青霉素-链霉素的McCoy’s 5A完全培养基培养HCT-116细胞,于37 ℃、5% CO2和95%空气饱和湿度的培养箱中培养,0.25%胰酶消化传代。
1.2.3 诱导耐药并检测细胞药敏性、计算耐药指数 采用伊立替康药物浓度梯度递增诱导法建立人结肠癌耐药细胞系HCT-116/CPT-11R。将HCT-116细胞按2×105个/孔接种于六孔板中,加入浓度为1 μmol/L的伊立替康完全培养基培养,加药24 h后撤药,待细胞长至对数生长期再加药,间歇培养-撤药,重复处理2次后逐步提高给药浓度至5,10,20,50 μmol/L。连续培养9个月,获得能在50 μmol/L中稳定生长的耐药细胞株HCT-116/CPT-11R。
接种1×104对数生长期的HCT-116细胞和HCT116/CPT-11R于96孔板中,培养24 h后弃上清,分别加入100 μl不同浓度梯度含伊立替康培养基,设6个复孔培养24 h后弃上清,通过CCK-8法检测细胞生长情况。分别计算伊立替康对两种细胞的生长抑制率,细胞生长抑制率=(1-实验组OD450/对照组OD450)×100%;分析细胞半数抑制浓度(50% inhibitory concentration,IC50)和耐药指数(resistant index,RI),RI=耐药细胞的IC50/敏感细胞的IC50)。
1.2.4 慢病毒感染 取对数生长期HCT-116/CPT-11R细胞,消化、重悬、计数,并按5×104个/孔接种于六孔板后正常培养。待细胞密度达20%-30%时更换培养基,设置5个组,空白对照组(NC)、阴性对照组(sh-NC)、慢病毒感染组1(sh-FTX1)、慢病毒感染组2(sh-FTX2)及慢病毒感染组3(sh-FTX3)。根据上海吉凯基因公司2019慢病毒操作手册中人结肠癌细胞HCT-116的复感染指数(MOI)=20,分别加入PBS、空白慢病毒及敲低FTX的3种慢病毒(病毒滴度4×108TU/ml),同时加入感染增强液HiTransG P。sh-FTX1序列:5′-CAGCATCCTGCACCTAGTTAT-3′;sh-FTX2序列:5′-GAGGGACAAATCCCATTTGAA-3′;sh-FTX3序列:5′-GTGCCGCTGTTAGACGAAGTA-3′;sh-NC序列:5′-TTCTCCGAACGTGTCACGT-3′。培养8 h后更换完全培养基,转染72 h后最后用浓度为4 μg/ml的嘌呤霉素筛选,2 d后更换完全培养基,传代后荧光显微镜下观察感染效率。
1.2.5 RT-qPCR法检测各组细胞中lncRNA FTX的表达 为了探讨lncRNA FTX在结肠细胞、结肠癌细胞系以及构建的结肠癌耐药株中的表达,我们提取总RNA,采用RT-qPCR的方法检测NCM460、HCT-116、HCT-116/CPT-11R细胞中lncRNA FTX的表达。
将NCM460、HCT-116和HCT-116/CPT-11R细胞以及慢病毒感染后的四组细胞接种于六孔板中,待细胞处于对数生长期时,收集细胞,用Trizol提取试剂分别提取总RNA并进行定量。
将提取的总RNA用Takara反转录试剂盒反转录为cDNA,反应条件为37 ℃ 15 min,95 ℃ 10 s。按照qPCR试剂盒说明书配制反应体系,反应条件为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40次循环后记录数据,引物序列见表1。以β-actin为内参,使用2-ΔΔCt方法分析FTX的相对表达量。

表1 实时定量PCR引物序列
1.2.6 蛋白免疫印迹(Western blot)实验检测c-myc、Vimentin、MTA-1蛋白的表达水平 将空白对照组、阴性对照组和和sh-FTX组细胞分别接种于10 cm2培养皿中,待细胞融合度达80%左右时分别收集细胞,使用RIPA裂解液提取各组总蛋白,测定蛋白浓度并定量。
以GAPDH为内参进行十二烷基硫酸钠聚烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),转膜于甲醇活化后的PVDF膜上,再用5%脱脂牛奶室温封闭1 h,随后用一抗GAPDH、c-myc、Vimentin、MTA-1(1 ∶1 000稀释),于4 ℃摇床孵育过夜,用洗膜缓冲液(Tris buffered saline tween,TBST)清洗3遍,每遍10 min,然后室温孵育辣根过氧化物酶标记的山羊抗兔二抗(1 ∶3 000稀释)2 h;TBST清洗3遍,每遍10 min,最后用ECL化学发光仪显色。
1.2.7 CCK-8实验检测细胞增殖能力 使用10 cm2培养皿培养HCT-116细胞,当细胞培养至对数生长期时用3 ml胰蛋白酶消化,离心收集细胞,加入培养基重悬制成细胞悬液,用细胞计数仪计数后,按5×103个/孔接种至96孔板中,设置5个时间梯度,在接种后0,24,48,72,96,120 h时,分别在每孔加入培养基体积10%的CCK-8溶液,于培养箱中孵育90 min后测定吸光度。
1.2.8 克隆形成实验检测细胞克隆形成能力 6 cm2培养皿培养NC组、sh-NC组和和sh-FTX组细胞至对数生长期,分别用1 ml胰蛋白酶消化后离心收集细胞沉淀,加入细胞培养基重悬制成细胞悬液,用细胞计数仪计数后按1×103个细胞/孔接种到六孔板中,放入细胞培养箱中培养15 d。吸去培养基,PBS清洗两次后,用4%的多聚甲醛固定15 min,然后用结晶紫进行染色30 min,最后用PBS冲洗多余的结晶紫,晾干后拍照、计数。
1.2.9 划痕实验检测细胞迁移能力 取对数期细胞分别消化后接种于六孔板于培养箱中培养,待细胞融合率达80%左右时,使用20 μl的无菌枪头在六孔板中央划痕,用PBS清洗两遍,除去掉落悬浮的细胞后换无血清培养基培养。然后在0 h和48 h后分别在倒置光学显微镜下观察划痕愈合程度,分别选取视野拍照。最后分别计算迁移融合率,比较与对照组的迁移程度。
1.3 数据统计分析
应用GraphPad Prism 8进行作图并且通过SPSS 23.0软件进行统计学分析,正态分布的计量资料结果采用均数±标准误表示,两组间比较采用t检验,多组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 数据库分析
统计数据显示,结肠癌患者肿瘤组织样本中FTX表达高于正常组织样本(P=0.001 6,见图1A);且生存分析结果显示FTX低表达组的生存率高于FTX高表达组,其中低表达组患者的5年生存率约为高表达组的2倍(P<0.05,见图1B)。

A.肿瘤组织和正常组织中FTX的表达B.不同表达水平FTX的结肠癌患者生存曲线图1 lnCAR数据库中结肠癌患者FTX差异表达及生存分析Figure 1 FTX differential expression and survival analysis in patients with colon cancer in lnCAR database
2.2 耐药细胞株HCT-116/CPT-11R的构建及耐药性检测
通过逐步增加伊立替康浓度,梯度诱导HCT-116细胞产生耐药性,细胞在不同浓度伊立替康培养基中生长抑制率变化见图2。计算出HCT-116和HCT-116/CPT-11R的IC50分别是(7.43±0.68)μmol/L和(134.56±4.60)μmol/L,耐药指数为18.13(RI>5,P<0.05),说明HCT-116/CPT-11R耐药细胞株对伊立替康产生耐药性,并符合耐药株的基本特性。

图2 CCK-8检测不同浓度伊立替康对细胞的生长抑制率Figure 2 Cell growth inhibition rates of HCT-116 and HCT-116/CPT-11R after treatment with different concentrations of irinotecan by CCK-8
2.3 lncRNA FTX在耐药株中的表达
结果显示,结肠癌细胞HCT-116 lncRNA FTX表达量显著高于正常结肠细胞NCM460(P<0.01),而HCT-116/CPT-11R显著高于结肠癌细胞HCT-116,差异均有统计学意义(P<0.05,见图3)。

与NCM460相比,**P<0.01;与HCT-116相比,#P<0.05图3 lncRNA FTX在正常结肠、结肠癌及结肠癌耐药细胞中的表达量Figure 3 Expression level of lncRNA FTX in colon, colon cancer and colon cancer drug-resistant cells
2.4 lncRNA FTX shRNA转染效率和干扰效果
空白慢病毒(sh-NC)及敲低FTX的3种慢病毒(sh-FTX1、sh-FTX2、sh-FTX3)感染HCT-116/CPT-11R细胞,分别收集总RNA,利用RT-qPCR测定lncRNA FTX的敲低效率。结果显示,sh-FTX1、sh-FTX2及sh-FTX3的相对表达量分别0.458±0.096,0.765±0.080,0.669±0.091,其中与sh-NC相比,sh-FTX1敲低效果最好(P=0.001 0,见图4),因此选择sh-FTX1敲低细胞株进行后续的实验。
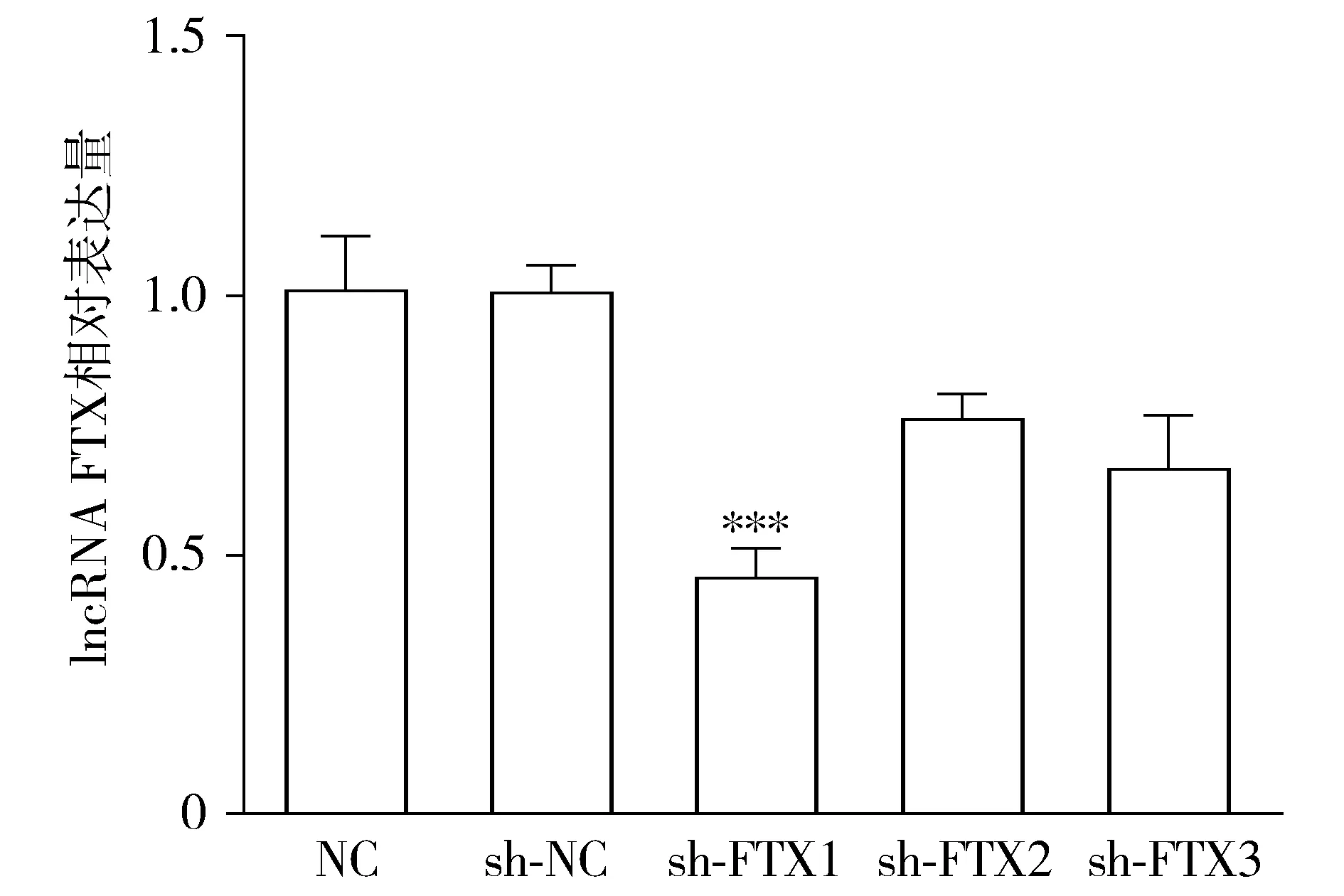
与sh-NC组相比,***P<0.005图4 RT-qPCR检测lncRNA FTX shRNA敲低效果Figure 4 The knockdown effect of lncRNA FTX shRNA detected by RT-qPCR
2.5 lncRNA FTX对细胞增殖能力的影响
CCK-8结果表示,敲低lncRNA FTX后细胞的活力被显著抑制,在72 h时三组细胞空白对照NC、阴性对照sh-NC以及sh-FTX的吸光度分别是0.660±0.059,0.642±0.074和0.224±0.009,sh-FTX组与sh-NC组相比差异具有统计学意义(P<0.005,见图5)。克隆形成实验结果发现,低表达lncRNA FTX的细胞克隆形成能力被显著抑制(28±8.544),敲低lncRNA FTX的细胞克隆形成率以及克隆的大小都远低于空白对照组(56±8.544)和sh-NC组(59±7.000),且差异具有统计学意义(P<0.005,见图6)。
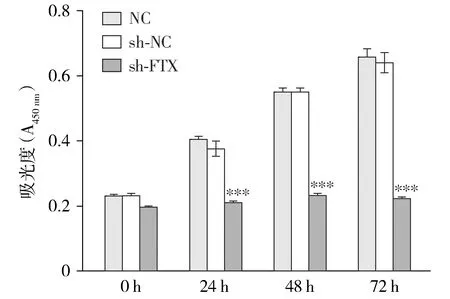
与sh-NC组相比,***P<0.005图5 CCK-8实验检测转染sh-FTX耐药株HCT-116/CPT-11R细胞活力Figure 5 Cell viability of HCT-116/CPT-11R transfected with sh-FTX by CCK-8

图6 克隆形成检测转染sh-FTX耐药株HCT-116/CPT-11R的克隆形成能力Figure 6 Clonal formation assay of HCT-116/CPT-11R transfected with sh-FTX
2.6 lncRNA FTX对细胞迁移能力的影响
细胞划痕实验结果显示,NC及转染sh-NC、sh-FTX的HCT-116/CPT-11R细胞分别迁移(237.583±13.45)μm,(237.120±19.77)μm和(27.073±3.45)μm,且sh-FTX组相比于NC组和空白对照组,差异具有统计学意义(P<0.005,见图7),说明敲低lncRNA FTX显著抑制HCT-116/CPT-11R的迁移能力。

图7 lncRNA FTX对HCT-116/CPT-11R细胞迁移的影响(×100)Figure 7 Effect of lncRNA FTX on HCT-116/CPT-11R cell migration (×100)
2.7 Western blot实验检测肿瘤细胞增殖、侵袭相关蛋白表达水平
收集细胞分别提取总蛋白,Western blot检测发现,与对照组相比,sh-FTX组HCT-116/CPT-11R的增殖相关蛋白c-myc以及迁移相关蛋白Vimentin、MTA-1的表达明显被抑制,且差异有统计学意义(P<0.05,见图8)。说明lncRNA FTX可能是通过调控以上相关蛋白促进结肠癌细胞增殖和迁移。

图8 Western blot实验检测细胞中相关蛋白的表达Figure 8 The expression of related protein in cells was detected by Western blot assay
3 讨论
近年来,结肠癌在中国的发病率逐渐上升,根据国际癌症研究机构提供的GLOBOCAN 2018癌症发病率和死亡率估计值,结肠癌的发病率和死亡率仅次于肺癌、女性乳腺癌和前列腺癌[10]。早期结肠癌可以采取内镜微创治疗,而对于中晚期结肠癌患者化疗是重要的治疗手段,常用的化疗药物有伊立替康、5-氟尿嘧啶、奥沙利铂等[11,12]。伊立替康是一种拓扑异构酶Ⅰ抑制剂,发挥细胞毒作用,能选择性地作用于拓扑异构酶Ⅰ,对DNA空间构型、复制、重组、转录及有丝分裂等过程具有十分重要的干预功能,使DNA单链及双链断裂,从而诱导癌细胞凋亡[13]。但由于肿瘤细胞的DNA修复能力的增强,尤其DNA pol-β是DNA修复的关键,进而为肿瘤细胞产生耐药性提供了分子基础[14]。由于耐药性的产生,化疗效果并不是特别理想。因此,从基因和分子水平了解结肠癌的发病及耐药机制对其防治具有重要意义。
近年来,长链非编码RNA(long noncoding RNA,lncRNA)作为基因组转录的“噪音”被报道其可在不同层次水平调控基因的表达,并在各种疾病中发挥功能。其中,本文讨论的lncRNA FTX在多种肿瘤中的异常表达与癌症发生发展以及预后密切相关,其分子机制是X通过调控下游分子的表达来影响肿瘤的发生发展[15,16]。我们通过对从lnCAR数据库中获取的结肠癌患者FTX的表达情况以及不同表达组的生存率进行统计学分析,验证了结肠癌患者FTX的高表达会降低其生存率。除此之外,有前期研究表明:lncRNA FTX通过调节miR-342-3p和AEG-1对胶质瘤细胞的增殖和侵袭起关键作用;在肺腺癌细胞中,lncRNA FTX通过调节miR-335-5p/NUCB2轴促进肺腺癌细胞增殖和迁移[16];另外,lncRNA FTX可以通过调节下游分子miR-192-5p促进大肠癌的进展。然而,目前尚未有lncRNA FTX与结肠癌耐药株的相关报道。我们一线化疗药伊立替康诱导构建结肠癌耐药株HCT-116/CPT-11R,并发现其lncRNA FTX表达量显著高于非耐药株及普通结肠细胞。并通过RNA干扰实验,在耐药细胞中转染lncRNA FTX shRNA下调其表达,发现耐药株细胞的增殖、迁移能力均明显减弱,其作用机制可能通过上调增殖、迁移相关基因c-myc[17]、Vimentin[18]、MTA-1[19]的表达而实现。
综上所述,结肠癌耐药株HCT-116/CPT-11R中lncRNA FTX呈高表达,敲低lncRNA FTX明显下调了c-myc、Vimentin、MTA-1蛋白的表达,从而抑制结肠癌耐药细胞株的增殖及迁移能力。lncRNA在结肠癌化疗耐药发生、发展中发挥了重要作用,具有成为结肠癌耐药新的靶向分子的价值。但本文仅在细胞水平验证了lncRNA FTX与耐药株的相关性,一方面还缺乏足够的临床标本进行验证,另一方面还需要从体内水平证明这一现象,进一步探讨lncRNA FTX在结肠癌伊立替康耐药中的作用。
