介孔硅固体分散体的制备及载药性能研究
2021-09-20霍代夏程丹丹李瑞娟顾艳丽吕晓洁
霍代夏,程丹丹,李瑞娟,刘 佳,顾艳丽,吕晓洁*
(内蒙古医科大学药学院,内蒙古 呼和浩特010059)
姜黄素(curcumin,Cur)是姜科植物姜黄中的一种黄色植物多酚,被证实是姜黄的主要活性成分之一,其药理作用广泛,毒性低。临床前研究表明,有抗炎、抗氧化、抗微生物和抗癌等药理作用[1~3]。但由于其存在水溶性较差(pH 7.4时仅为0.0004 mg/mL)、生物利用度低、不易被机体吸收、快速被清除出体外、光学不稳定、在中性到碱性溶液中极易降解等问题[4],严重限制了临床应用及相关制剂的开发。为了克服这些缺点,研究者尝试用各种方法来改善姜黄素的溶解和溶出,包括将其制成纳米粒、固体分散体[5]、环糊精包合物、脂质体、胶束、微囊、微球等[6]。介孔二氧化硅(mesoporous silica nanoparticals,MSN)是一种孔径介于2~50 nm的多孔材料,比表面积大,耐热性、耐pH、耐机械应力和耐水解的能力均较好,且稳定、低毒[7]。β-环糊精(β-Cyclodextrin,β-CD)及其衍生物羟丙基-β-环糊精(HP-β-CD)具有“内腔疏水,外部亲水”的独特性质,可以提高药物的水溶性和稳定性[8]。因其无毒、可降解,可直接用于药物的增溶,通常用于提高口服和肠外给药药物的水溶性[9]。
本研究制备了β-CD、HP-β-CD修饰的介孔二氧化硅载体,进一步以姜黄素为模型药制成固体分散体,研究其对难溶性药物姜黄素溶解和体外溶出的影响。
1 仪器与材料
1.1 仪器
Tecnai G2 F20 200kV场发射透射电子显微镜(美国FEI)、S-4800场发射扫描电子显微镜(日本日立)、DSC 25差示扫描量热仪(美国TA)、SZ-100-Z2激光粒度测定仪(日本HORIBA)、TriStar 3020型比表面积及孔径测试仪(美国Micromeritics)、TU-1901型紫外可见分光光度计(北京普析通用)、IRAffinity-1傅里叶红外光谱分析仪(日本岛津)、FMC-1000台式冷冻恒温振荡器(东京理化)、DF-101S集热式恒温加热磁力搅拌器(河南巩义予华)、ME204/02电子天平(梅特勒-托利多)。
1.2 材料
姜黄素(Cur,HPLC≥98%,四川维克奇)、溴化十六烷基三甲胺(CTAB,≥99%,Biosharp)、硅酸四乙酯(TEOS,99%,安耐吉化学)、β-环糊精(β-CD,医药级,曲阜天利)、2-羟丙基-β-环糊精(HP-β-CD,97%,罗恩试剂)、十二烷基硫酸钠(SDS,天津凯通化学)、其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 MSN、β-CD-MSN、HP-β-CD-MSN的制备
称量1g CTAB,加入480 mL蒸馏水,充分搅拌使其混合均匀,加入3.5 mL NaOH调节pH,加热使体系稳定在80℃,滴加5 mL TEOS,剧烈搅拌下反应2 h,之后使体系逐渐降温。离心,用蒸馏水和无水乙醇充分洗涤沉淀,离心弃上清,沉淀置真空干燥箱干燥过夜。盐酸:甲醇=50:1(V:V)回流去除模板,无水乙醇洗涤,沉淀真空干燥至恒重,得MSN。
称量1 g CTAB于480 mL蒸馏水中,反应条件同上,在80℃稳定片刻后,先加入7.5 g β-CD或1.15 g HP-β-CD搅拌均匀,再滴加5 mL TEOS,反应2 h,体系逐渐降温。用蒸馏水和无水乙醇洗涤沉淀,分离沉淀后置真空干燥箱过夜。盐酸:甲醇=50:1(V:V)回流去除模板,无水乙醇洗涤,沉淀真空干燥至恒重。分别得到β-CD-MSN、HP-β-CD-MSN。
2.2 载体材料的理化性质
2.2.1 电镜法观察形态 将样品用乙醇分散,滴于铜网,室温挥干后用透射电镜观察不同载体的形貌、粒径和孔径。MSN、β-CD-MSN、HP-β-CDMSN形态均为类圆形,粒径在80~120 nm之间,可见清晰的中孔结构,修饰了β-CD和HP-β-CD的载体粒径略增大(见图1)。
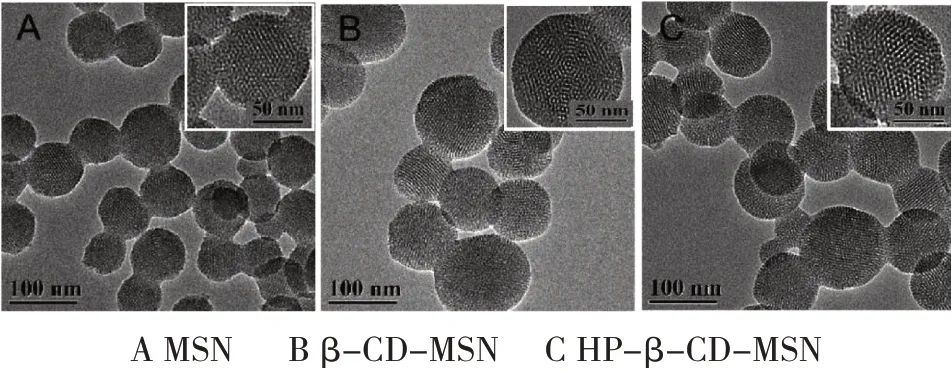
图1 载体的透射电镜图Fig.1 Transmission electron microscope of carriers
2.2.2 粒径和zeta电位 粒径是评价纳米粒子的一项重要指标,其大小和均匀程度影响纳米粒子的体内分布及代谢。zeta电位影响体系的稳定性,电位的绝对值在30~60 mV之间认为体系是稳定的。实验制备的MSN、β-CD-MSN和HP-β-CD-MSN的粒径均在120~150 nm,因有水化膜存在,测量得到的粒径比电镜观察到的略大(见表1)。三种样品在水中zeta电位的绝对值均在30~40 mV之间,表明本课题制备的载体具有较强的电荷斥力,物理稳定性良好。

表1 载体的粒径和zeta电位值(n=3)Tab.1 Particle size and zeta potential of carriers(n=3)
2.2.3 载体的孔结构参数N2吸脱附常用来测定介孔材料的比表面积及孔径,根据实验结果得到的吸附等温曲线,其形状与材料孔径大小、孔类型有关。为了避免水分对测试结果的影响,测试前需先对样品进行真空干燥,之后在120℃下脱气,除去材料表面及孔道内部的水分。
由载体材料的吸附等温曲线可以看出,三种材料均属Ⅳ型等温曲线,表现出了介孔结构的特征(见图2)。当P/P0<0.2时,由于在样品表面发生了单分子和多分子层吸附,氮气的吸附量增加缓慢;P/P0介于0.2~0.4时,低温下氮气在样品孔道发生了毛细管凝聚,相对压力值迅速增加,图中有拐点出现,这一现象可证实了样品中有介孔结构存在;当P/P0介于0.4~0.95时,相对压力比较稳定,增大不明显,说明氮气分子吸附在样品表面;当P/P0>0.95时,由于出现样品内孔道的毛细管凝集现象,曲线出现了较大变化[10]。另外,由于毛细管凝聚,可以观察到,脱吸附等温线在吸附等温线上方,呈现出滞后环。
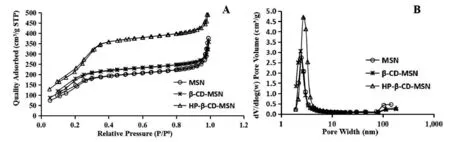
图2 载体的氮气吸附等温线(A)和孔径分布曲线(B)Fig.2 Nitrogen absorption isotherms(A)and pore size distributions(B)of carriers
用BJH(Barret-Joyner-Halenda)和BET(Brunauer-Emmett-Teller)法分析孔结构。几种介孔二氧化硅载体材料均具有较大的比表面积,加入β-CD后的载体材料与MSN相比,比表面积略有增大,孔容积和孔体积略下降(见表2)。加入HP-β-CD后,比表面积、孔容积和孔径均较前两者有一定提高。可见用共缩聚法制备环糊精修饰的MSN载体,并没有堵塞介孔孔道,也未改变介孔材料的基本形态,不同修饰材料对孔径影响不同。

表2 载体材料的孔结构参数Tab.2 Pore structure paramaters of carriers
2.3 Cur含量测定方法的建立
2.3.1 专属性考察 精密称量Cur 2.0 mg,用无水乙醇溶解后,用0.2%SDS稀释,将MSN、β-CD-MSN和HP-β-CD-MSN用同溶剂稀释后,在200~700 nm波长范围内进行扫描。Cur溶液在430 nm处有最大紫外吸收,空白载体在此波长下无吸收,对药物测量无干扰,专属性良好,故选择430 nm为检测波长。
2.3.2 标准曲线 精密称量Cur 5.0 mg,用无水乙醇溶解后,加0.2% SDS分别配制成浓度为0.25、0.50、1.00、1.50、2.00、2.50、3.00 mg·L-1的对照品溶液,430 nm处测量吸光度。以浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到回归方程y=0.1901 x+0.0048,R2=0.9995,Cur在0.25~3.00 mg·L-1浓度内呈良好线性关系。
2.3.3 重现性实验 精密称取Cur 3.0 mg,置于100 mL容量瓶中,用无水乙醇溶解,0.2% SDS定容至刻度,得到对照品溶液,用0.2% SDS将其稀释至2.0 mg·L-1,430 nm测量吸光度,重复测定5次,计算RSD为0.72%,该法的重现性良好。
2.3.4 精密度实验 精确配制Cur低、中、高(0.5、1.0、2.0 mg·L-1)不同浓度的对照品溶液,同1日内测定5次,计算日内精密度,RSD值为1.17%。同法每日测定1次,连续测定5日,计算日间精密度,计算RSD值为1.82%。表明该法精密度良好。
2.3.5 稳定性实验 量取2.0 mg·L-1的Cur对照品溶液,室温下放置0、2、4、6、8、10 h后测定吸光度。计算RSD值为1.67%。说明Cur供试品溶液在室温条件下,10 h内稳定。
2.4 Cur与MSN系列载体固体分散体及物理混合物的制备
分别取50.0 mg MSN、β-CD-MSN、HP-β-CDMSN,室温状态下搅拌并抽真空3 h。另取Cur 10.0 mg,溶于10 mL乙醇中,分别加入上述体系中,搅拌3 h使其充分混合均匀。之后打开瓶塞,加热搅拌,蒸发溶剂至干,真空干燥至恒重。收集干燥粉末研匀,得三种载体与Cur的固体分散体,记为Cur-MSN-SD、Cur-β-CD-MSN-SD及Cur-HP-β-CDMSN-SD。
Cur和MSN、β-CD-MSN、HP-β-CD-MSN按照相同比例称量,置研钵中研匀,过5号筛,即得Cur和不同载体的物理混合物,记为Cur+MSN、Cur+β-CD-MSN及Cur+HP-β-CD-MSN。
2.5 载药情况考察
2.5.1 扫描电镜观察载药前后形态 分别取Cur、空白载体、物理混合物及固体分散体制备样品,用扫描电镜观察其形态和结构(见图3)。Cur外形较为粗糙,药物分子结晶较大且不均匀(见图3-A);三种空白载体的电镜图片差别不大,在放大3 k倍的视野下观察,载体均团聚成堆(见图3-B);Cur与三种载体的物理混合物电镜图片几乎无差别,在相同的分散条件和放大倍数下,载体附着在药物晶体表面,未改变药物晶体的大小,物理混合物均显示了药物和载体的共同特点,二者可清晰区分(见图3-C);三种固体分散体的电镜图片显示,Cur-MSN-SD(图3-D)和Cur-β-CD-MSN-SD(见图3-E)呈小块聚集状,大小不均,视野中几乎见不到完整的药物晶体,无法清晰辨别介孔硅材料和Cur,其微观形态与物理混合物不同,分散程度较Cur和物理混合物均有改善。但Cur-HP-β-CD-MSN-SD(见图3-F)仍然可见药物晶体。

图3 样品的扫描电镜图Fig.3 Scanning electron microscope images of samples
2.5.2 差示扫描量热法(differential scanning calorimeter,DSC)DSC是将样品和参比物在同等环境中程序升温及降温,通过测量二者温差为零时所须补偿的热量来判断药物晶体的含量,晶体越多,得到吸热峰的面积越大。
分别取Cur、空白载体、物理混合物及固体分散体各样品适量,在扫描温度50℃~300℃,升温速度10℃·min-1的条件下进行DSC分析。得到原料药在181℃时有尖锐的吸热峰,对应Cur的熔点,物理混合物也在同样的位置有吸热峰。Cur-MSN-SD、Cur-β-CD-MSN-SD几乎没有峰,而Cur-HP-β-CDMSN-SD在同样的位置显示出了吸热峰(见图4)。说明模型药在Cur-HP-β-CD-MSN-SD中只有少部分以无定型的形式存在,而在另外二种材料的固体分散体中药物的形态发生了变化,绝大部分以无定型状态存在。
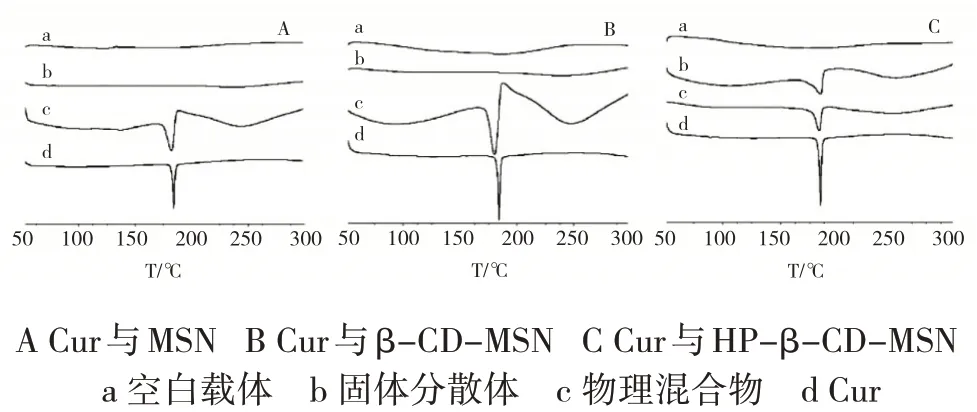
图4 样品的DSC曲线Fig.4 Differential Scanning Calorimeter curves of samples
2.5.3 红外分析 分别取Cur、空白载体、物理混合物及固体分散体适量,与溴化钾粉末研磨均匀后压片,测定其红外光谱(见图5)。Cur分子结构中主要有苯环、-OH、C=O、-OCH3及C=C等。曲线a为Cur的特征吸收峰,3503 cm-1处可归属为酚羟基伸缩振动,1627 cm-1处为C=O双键的伸缩振动,C-O-C的振动峰位于1025 cm-1处;b、c、d空白载体表现出了MSN的特征吸收峰,804 cm-1、1095 cm-1处的峰可归属为对称和不对称Si-O-Si伸缩振动,468 cm-1和968 cm-1处分别为Si-O-Si弯曲振动和Si-OH表面的伸缩振动,2856 cm-1处的吸收峰归属为CTAB中CH3和CH2的伸缩振动。e、f、g分别为空白载体与Cur物理混合物的红外曲线,仍清晰可见药物的特征吸收峰。h、i、j分别为三种固体分散体,Cur的特征吸收峰部分被掩盖,可能由于药物进入载体晶型转变所致,且未发现新的特征峰,说明Cur与载体材料间仅有物理吸附作用,未产生新的物质。

图5 样品的红外光谱图Fig.5 Infrared spectra of samples
2.6 药物溶解度的测定
称取过量的Cur、Cur-MSN、Cur-β-CD-MSN和Cur-HP-β-CD-MSN,于0.2% SDS中,室温下避光,充分振摇至溶解平衡。取溶液过0.22 μm微孔滤膜,用紫外可见分光光度计在430 nm处测量吸光度。
通过测量得到,Cur在0.2% SDS中的溶解度为(22.15±1.30)mg·L-1,Cur-MSN-SD、Cur-β-CDMSN-SD和Cur-HP-β-CD-MSN-SD在相同溶剂中的溶解度分别为(312.78±8.15)mg·L-1、(172.93±3.75)mg·L-1、(27.90±1.81)mg·L-1。Cur-MSN-SD比原料药的溶解度高了约15倍,Cur-β-CD-MSN比原料药的溶解度高了8倍多,而Cur-HP-β-CDMSN与原料药基本持平。可见不同载体材料的固体分散体对于Cur的增溶效果不同,其中MSN作为载体制备的固体分散体增溶效果最好。
2.7 体外溶出度的测定
取Cur、Cur-MSN-SD、Cur-β-CD-MSN-SD和Cur-HP-β-CD-MSN-SD适量,使Cur含量保持相同,以0.2% SDS溶液作为溶出介质,于(37±0.5)℃,120 rpm振摇。分别于0、5、10、20、30、60、120、240、360 min取样,取样后立即补充等体积、同温的溶出介质。采用紫外-可见分光光度法在430 nm处测定不同时间下药物的溶出量。计算Cur的累积释放率,并绘制释放曲线(见图6)。

图6 样品的体外溶出曲线Fig.6 In vitro release curves of samples
据文献报道[11],SDS对降低Cur的水解,保持其稳定的作用较强,因此实验选择0.2%SDS作为溶出介质。从体外释放结果可见,Cur在0.2% SDS中几乎不能溶出,300 min的溶出率在1%以下。在相同的条件下,Cur-MSN、Cur-β-CD-MSN和Cur-HPβ-CD-MSN均有不同程度的溶出,但不同载体增加溶出的效果不同,与Cur相比,Cur-β-CD-MSN-SD的累积溶出效果最好,Cur-MSN-SD次之,Cur-HPβ-CD-MSN刚开始表现出了突释的现象,随着时间的延长,其增加溶出的效果较差。
3 讨论
得益于介孔二氧化硅特殊的表面性质,将其作为载体与药物制成固体分散体后,可以抑制药物晶型转化,并将药物限制在纳米级尺寸,使药物保持相对易溶的无定型或亚稳定状态。介孔硅表面的硅羟基本身有一定的亲水性,能与-OH、-NH2等末端基团的分子形成分子内氢键,改善药物润湿性,减小接触角,增加溶出速率;载体巨大的比表面积增加了药物与溶出介质的接触,利于载药体系吸附在胃肠黏膜表面并滞留,促进了药物吸收。有文献报道[11],介孔二氧化硅材料制备的固体分散体可将药物限制在非晶态,室温下保存两年仍然是稳定的。β-CD分子内空腔大小适中,应用广泛,对其2位羟丙基修饰得到HP-β-CD,在不改变其独特结构的基础上,分子具有更强的不对称性,羟丙基的引入可以改变环糊精的极性和亲水性。
根据不同的介孔硅材料制备的固体分散体增加Cur溶解和体外溶出的效果推测,由于药物转变成了无定型状态,加之载体巨大的比表面积,使药物迅速分散于介质中,溶剂的浸润能力增加。但不同载体由于表面性质、孔径孔容大小,对Cur溶解和体外溶出增加效果不同。Cur-MSN的平衡溶解度最高,但在体外溶出实验中,β-CD-MSN-SD的释放最快,累积释放率也最高。而Cur-HP-β-CD-MSNSD复合样品一接触溶出介质即达到较大的溶出量,但随着时间的延长,释放量下降,对累积释放增加的效果不明显。推测可能是由以下几个原因造成的,首先,HP-β-CD-MSN的孔径最大,较大的孔隙更容易被加载流体接触,且容易使药物重新生成结晶物质。另外,当分子被释放时,吸附的第一个单分子层由于作用力更强,更难解吸,会导致一部分药物留在载体中[12]。MSN和β-CD-MSN表面性质的差异,使其表现出了不同的溶出行为。材料高表面自由能和表面硅烷醇的高反应活性也可能导致药物释放不完全[13];修饰基团的键能差别,也会造成材料和药物的稳定性不同[14];调节载体的亲/疏水性能,药物的释放量也会随之变化,疏水性材料的药物释放更少[15]。
用介孔硅作为固体分散体,可以提高难溶性药物的溶解和溶出,但MSN与难溶药物之间的相互关系并不明确,不同种类的载体如何影响药物溶解、释放,如何准确地选择载体仍有一定的盲目性,且药物在体内的释放情况也有待进一步确证,但介孔硅在生物相容性及毒副作用方面表现出的优势和在提高难溶性药物溶解度方面的潜力值得我们进一步探究。
