脂多糖与益生菌对胆总管结石形成的影响
2021-09-19牛昊书侯羽菲
牛昊书,崔 宏,陈 吉,侯羽菲
(1.内蒙古包钢医院消化内科,内蒙古 包头 014010;2.青岛西海岸区人民医院消化内科)
胆系结石疾病在我国是一种常见病,对公共卫生系统造成了巨大的医疗负担。大多数胆囊结石均在胆囊中发现,但有时会通过胆囊管进入肝外胆管,成为胆管结石,约有10%~15%的胆结石患者伴有胆管结石。胆管结石也可在没有胆囊结石的情况下形成,这种由胆色素为主要成分的原发性胆管结石在东亚国家比欧洲国家更为常见[1]。胆系结石形成的原因有很多,其中微生物菌群在胆系结石形成中的促进作用逐渐得到了证实,但具体发病机制仍然不十分清楚。几年前,人们已经认识到,胆道在非病理条件下具有复杂的微生物群。肠道菌群可通过奥狄括约肌或经肠肝循环通过血液进入肝脏进而通过胆汁分泌定植于胆道内[2]。通过影响胆固醇和胆汁酸的代谢和分泌促进胆色素结石和胆固醇胆石的形成[3,4]。脂多糖/内毒素(lipopolysaccharide,LPS)是革兰氏阴性菌细胞壁的主要成分,近年研究发现内毒素可通过多种途径促进胆系结石的形成[5]。荟萃分析显示,益生菌(嗜酸乳杆菌,乳酸杆菌,植物乳杆菌组)可以显着降低血清总胆固醇[6],有研究发现胆道结石患者胆汁中双歧杆菌的比例明显下降[7],提示益生菌治疗有可能作为预防胆道结石形成的手段之一。本研究通过检测胆总管结石病人口服肠道益生菌前后胆汁的LPS浓度变化进行研究,探讨LPS及肠道益生菌在胆总管结石形成过程中的作用,以期为胆总管结石形成的预防提供参考思路。
1 资料与方法
1.1 研究对象
选取在2016-12~2020-10就诊于我院的巨大或复杂胆总管结石(单发结石直径≥20mm,或多发结石且其中最大结石直径≥20mm)患者,选取行ERCP无法一次完全取石留置胆管塑料支架患者45例为A组,男24例,女21例,平均年龄(70.09±13.53)岁,均于6月后复行ERCP更换支架或再次取石,首次ERCP术后随机选取15例口服双歧杆菌乳杆菌三联活菌片4片/次,一日3次6月为A1组,男6例,女9例,平均年龄(71.4±11.49)岁,余30例为A2组,男18例,女12例,平均年龄(69.43±14.58)岁;选取行ERCP检查的无胆管结石的胆管恶性狭窄患者26例为B组,男14例,女12例,平均年龄(72.73±12.07)岁,其中行胆总管金属支架置入术12例,其中术后口服双歧杆菌乳杆菌三联活菌片4片/次,一日3次6月6例为B1组,平均年龄(77.33±9.05)岁,余6例胆总管金属支架置入术未口服双歧杆菌乳杆菌为B2组,平均年龄(78.33±10.82)岁。余14例为临时置放塑料支架后短期内行手术治疗。纳入标准:采用B超、CT或MRCP诊断明确;排除标准:(1)发热患者;(2)患有免疫系统疾病、慢性肝病、慢性呼吸系统疾病、慢性肾脏疾病、其他系统急慢性感染症状、术前使用抗生素的患者。本研究已通过医院伦理委员会批准,每位手术者均签署知情同意书。
1.2 标本采集
A组及B组均行ERCP术,A组予胆总管取石术及胆总管塑料支架置入术,6月后复行ERCP胆总管塑料支架拔出术或胆总管取石术,ERCP术中造影导管成功超选插入胆总管后,用无热原注射器接造影导管抽取胆汁3~5mL,用于脂多糖检测。
1.3 检测方法
胆汁中脂多糖的检测采用显色基质定量法,试剂为购自丹娜(天津)生物科技有限公司的革兰氏阴性菌脂多糖检测试剂盒,检测按照试剂说明进行。
1.4 统计学处理
2 结果
2.1 脂多糖变化
脂多糖在A组(胆总管结石组)胆汁中浓度为(19.36±5.23)EU/mL,高于B组(胆管狭窄组)胆汁中的浓度(9.32±4.48)EU/mL,差异有统计学意义(t=8.19,P<0.05)(见表1);置入支架前,A1组(口服益生菌组)胆汁中的脂多糖浓度为(19.98±5.98)EU/mL,A2组(未口服益生菌组)胆汁中脂多糖浓度为(19.04±4.90)EU/mL,差异无统计学意义(t=0.56,P>0.05),6月后,A1组(口服益生菌组)中的脂多糖浓度为(10.18±2.28)EU/mL,较前显著降低(t=6.96,P<0.05)。A2组脂多糖浓度为18.71±4.23 EU/mL,较前虽轻微降低,但差异无统计学意义(t=0.85,P>0.05)。A1组脂多糖浓度显著低于A2组,差异有统计学意义(t=-7.27,P<0.05)(见表2)。

表1 胆管结石组与狭窄组LPS浓度(EU/mL)比较
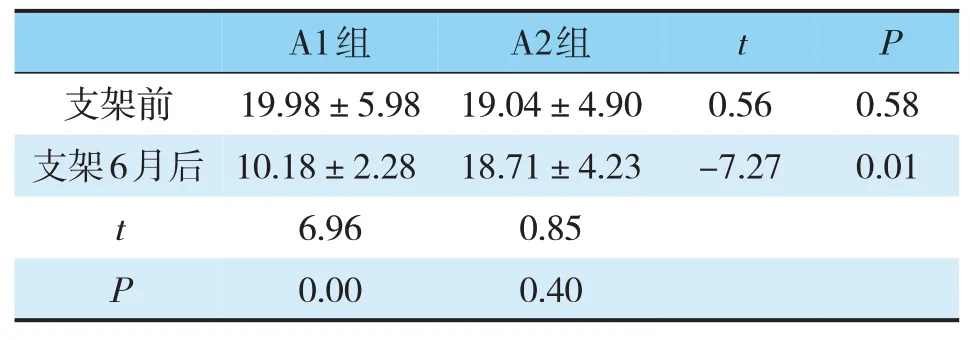
表2 胆管结石组置入支架前后LPS浓度(EU/mL)比较
2.2 结石大小变化
置入支架前A1组结石直径(22.25±2.96)mm,A2组结石直径(22.10±2.38)mm,差异无统计学意义(t=0.20,P>0.05);置入支架6月后,A1组结石平均直径(19.6±4.14)mm,较置放支架前明显缩小(t=3.42,P<0.05),A2组结石平均直径(20.07±4.07),较置放支架前明显缩小(t=3.27,P<0.05),虽支架6月后A1较A2组结石平均直径小,但差异无显著统计学意义(t=-0.36,P>0.05)(见表3),总的结石缩小率(有结石缩小证据的病人数占所在组总人数的比率)A1组为66.7%、A2组为53.3%,但差异无统计学意义(χ2=0.73,P>0.05)(见表4);根据结石的数量与大小制定简易评分(见表5),置入支架术后6月,B1组(1.67±1.37)分低于B2组(2.67±1.50)分,但差异无统计学意义(t=1.20,P>0.05)(见表6)。

表3 胆管结石组置入支架前后结石直径(mm)比较

表4 总的结石缩小率比较
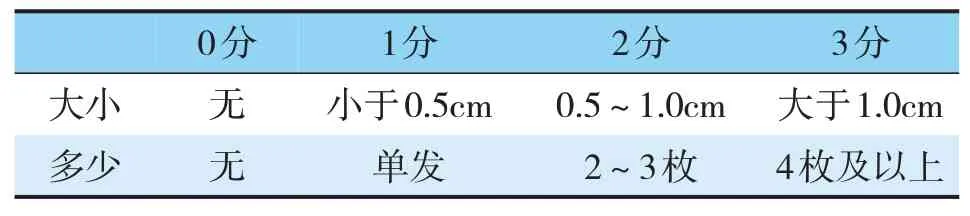
表5 胆总管结石简易评分

表6 胆管狭窄组支架后产生结石评分比较
2.3 结石大小与脂多糖的相关性
LPS浓度与A组置放支架前结石大小呈正相关(r=0.881,P<0.05),线性回归分析(R2=0.776,P<0.05);LPS与A组置放支架6月后结石大小亦呈正相关(r=0.962,P<0.05),线性回归分析(R2=0.925,P<0.05)(见图1、2)。A1组脂多糖浓度降低幅度(9.80±5.45)EU/mL与结石减小程度(2.67±5.04)mm无明显相关性(r=0.281,P>0.05)。
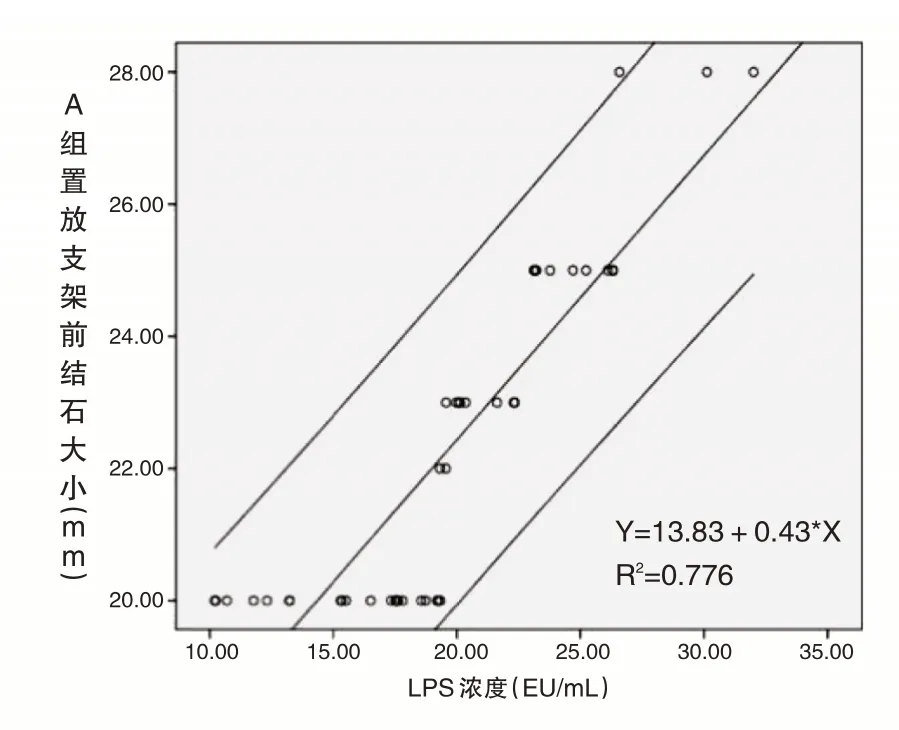
图1 LPS浓度与A组置放支架前结石大小关系

图2 LPS浓度与A组置放支架6月后结石大小关系
3 讨论
近年临床研究证实,胆道感染是胆管结石形成的主要原因之一[2],通常,从十二指肠肠道细菌的逆行感染被认为是胆系感染的可能主要来源。此外,当肠道胆盐缺乏、小肠黏膜屏障损伤时,细菌通过门静脉系统入侵也有助于胆道感染。肝胆管结石患者胆汁中含有大量革兰氏阴性杆菌,其产生的LPS含量与感染的程度呈正相关。
大量研究表明,LPS与胆系结石的形成具有密切关系。Toll样受体4(toll-like receptor 4,TLR4)可通过多种分子模式刺激免疫应答,并通过获得性免疫对机体进行保护[8],但这些应答导致的持续性炎症反应会对机体产生损伤。研究发现哺乳动物胆管上皮细胞有TLR4表达。LPS是TLR4的天然配体,其可通过激活TLR4信号通路,从如下方面[9]引起胆管结石的产生:(1)LPS与枯否细胞(kupffer cells,KCs)细胞膜表面CD14的结合,通过激活LPS/TLR4信号通路从而介导了KCs合成和分泌多种促炎因子,引起持续性炎性损伤;(2)LPS/TLR4诱导产生某些炎症介质和细胞因子,激活细胞内MAPKs-NF-κB信号通路,致使产生炎症的瀑布效应,导致自由基产生,氧、羟自由基增加会加速胆道内胆红素钙结石生成,沉淀颗粒增大,进而形成肝胆结石;(3)LPS/TLR信号通路通过参与胆囊炎症的发生和发展,导致胆囊功能受到影响,引起肝内胆管胆汁淤积,从而形成肝胆管胆石;(4)唐世芳等[10]通过用LPS刺激人胆管上皮细胞株进行培养发现TLR4参与活化并激活由LPS介导的肝内胆管上皮细胞发生上皮-间质转化(epithelial-to-mesenchymal transition,EMT),参与肝胆管纤维化的进程,改变胆管树内胆汁流,影响结石的形成;(5)LPS可以使组织源性β-葡萄糖醛酸酶(β-glucuronidas,β-GD)的合成和释放增加,分解胆红素双葡糖醛酸酯,使结合胆红素分解成游离胆红素,进而与钙结合生成胆红素钙结石,对无细菌感染的胆色素结石的产生起到一定作用。
本研究发现胆管结石组胆汁内LPS含量明显高于无结石的胆总管狭窄组(P<0.01),且LPS浓度与结石大小呈正相关性(P<0.01),线性回归分析提示胆总管结石大小变化可以用LPS浓度为解释变量的线性回归模型来解释(P<0.01),提示LPS可能为胆管结石的原因之一,这与目前的研究相符。但LPS与胆管结石的形成原因互为双向性,究竟LPS是胆管结石形成的原因,亦或LPS增多继发于胆总管结石的形成,尚需进一步行动物研究以明确。本研究通过对ERCP胆管金属支架置入术前无结石的胆管恶性梗阻的观察发现,通过口服益生菌抑制LPS浓度的B1组继发结石的评分低于B2组,虽统计学差异不明显(P>0.05),考虑与样本量低,观察时间短有关,但仍有可能提示抑制LPS浓度可减少或预防结石的可能,需增加样本量及观察时间以明确。本研究发现,A1组6月后LPS浓度显著降低(P<0.01),6月后A1与A2组结石直径较前均明显减小(P<0.01),但A1组与A2组结石直径无明显差异(P>0.05),且A1组脂多糖浓度降低幅度与结石减小程度无明显相关性(P>0.05),提示LPS有促进结石形成的作用,但对已形成的胆管结石,依靠单纯减低LPS浓度并不能起到减小结石的作用,通过减少LPS浓度可能起到预防胆管结石,而非治疗的效果。
近十年来,许多基于人类和动物模型研究证实胃肠道不同部位微生物菌群与胆系结石的形成存在联系,胆道的微生物组与十二指肠的微生物群具有高度相似性[11,12]。参与胆汁酸氧化和差向异构化的肠道细菌会破坏胆汁酸的肠肝循环并导致胆系结石的形成[2]。胆汁成分(即胆固醇或胆红素)的失衡是导致胆道内结石形成的主要机制。结石通常分为3种类型:胆固醇结石,黑色色素结石和褐色色素结石。胆固醇和黑色色素结石通常在胆囊内形成,它们的形成在很大程度上取决于宿主脂质稳态和胆红素代谢。相反,褐色色素结石与胆道感染有关,通常在胆管内形成[13]。在东亚,原发于胆总管的结石比在西方更为常见,基于生化结构差异,胆固醇结石在胆囊结石中的比例为58.3%,而在胆总管结石中的比例为31.1%,胆色素结石在胆囊结石中的比例为39.6%(黑色素结石23.7%、褐色素结石15.9%),在胆总管结石中的比例为66.1%(黑色素结石11.8%、褐色素结石54.3%),褐色素结石比黑色素结石胆固醇含量更高,褐色素结石及胆固醇结石中均存在细菌,表明细菌感染在以胆固醇为主的结石形成中起着致病作用[1]。
厌氧菌(最常见的是大肠杆菌)会产生多种酶,例如缀合的胆汁酸水解酶,这些酶会化学修饰胆管内的胆红素。在此过程中,胆红素被细菌β-葡萄糖醛酸糖苷酶水解为未结合的胆红素,其迅速沉淀,与胆管树中的钙结合,导致结石形成[13]。Ye等[12]发现三个肠杆菌科(大肠埃希氏菌,克雷伯菌和未分类属)和椎体杆菌属在胆总管结石病人胆汁中高度丰富,Wu等[14]发现胆结石患者和健康受试者之间肠道微生物成分有着显着的变化,胆结石患者存在着细菌门蛋白质细菌的过度生长,通常包括多种病原体,如大肠杆菌、沙门氏菌、弧菌和螺旋杆菌等。
胆汁酸和肠道菌群之间的关系是紧密而互补的。胆汁酸控制肠道细菌的过度生长并防止炎症,而肠道菌群则在胆汁酸的生物转化中发挥作用,并通过末端回肠的法尼醇X受体(farnesoid X receptor,FXR)和G蛋白偶联的膜受体5(G protein-coupled membrane receptor 5,TGR5)在肝脏中影响胆汁酸的组成和代谢[15]。肠道细菌通过BSH将初级胆汁酸解偶联为游离胆汁酸,然后通过7α-脱羟基作用将游离胆汁酸转化为次级胆汁酸,肝肠循环中游离胆汁酸和次级胆汁酸的增加,可能导致免疫细胞功能性FXR的抑制,进而引起胆汁胆固醇过饱和并诱导胆固醇结石形成。Berr等表明,次级胆汁酸的增加促进胆固醇结石的形成。研究发现,患有GSD的患者中7α-脱羟基细菌的水平比没有GSD的患者高42倍(P<0.01)。
双歧杆菌对致病性大肠埃希菌、福氏志贺菌、沙门菌等肠道致病菌有拮抗作用,可抑制产生内毒素的革兰氏阴性菌数量,并有降胆固醇的作用。Liang[7]等发现在胆管Oddi括约肌松弛下,双歧杆菌和李斯特菌的比例急剧下降,提示双歧杆菌有潜在的作为预防胆总管结石治疗方案的可能。
本研究发现,长期口服双歧杆菌乳杆菌三联活菌片的胆管塑料支架置入组患者的胆汁LPS较口服前及未口服组均显著减少(P<0.01),提示双歧杆菌可有效抑制胆道革兰氏阴性菌感染。相关研究表明,胆管塑料支架置入术后,可使患者结石的大小及数量减少。本研究发现,置入胆总管塑料支架的胆总管结石病人中,口服益生菌组的胆总管结石平均直径较未口服组减小不显著(P>0.05),提示双歧杆菌对已经形成的胆总管结石无明显缩小作用。虽总的结石缩小率更高,但差异亦无明显统计学意义(P>0.05),需进一步行动物研究以了解口服益生菌对已形成结石的影响。胆管恶性狭窄患者均置放直径为1cm的金属裸支架,长期口服双歧杆菌组继发胆总管结石评分低于未口服组,提示口服双歧杆菌可能对胆总管结石的形成有抑制和预防的作用,但差异无明显统计学意义(P>0.05),考虑与样本量较小及观察时间较短有关,另外胆管癌患者身体状况不一、胆道狭窄程度及损伤程度不一,均对结果产生影响,益生菌对结石的抑制和预防作用有待更严格的筛选标准及更大的样本量研究或动物模型研究以明确其作用。
脂多糖增高可能为胆总管结石形成原因之一,通过抑制LPS/TLR4信号通路有可能对预防或抑制胆总管结石的形成产生积极影响。口服益生菌可调节肠道菌群及胆道菌群,减少胆道内脂多糖水平,可能对胆总管结石的形成起到一定预防及抑制作用,具体机制及效果有待深入研究。
