pSTAT1与PD-L1在三阴性乳腺癌中的表达及相关性研究
2021-09-19杨宏坤贾永峰
杨宏坤,刘 霞,2,施 琳,2,贾永峰,2,云 芬,2
(1内蒙古医科大学基础医学院,内蒙古 呼和浩特 010059;2内蒙古医科大学附属医院病理科)
三阴性乳腺癌(TNBC)是指雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和Her2均阴性的一类乳腺癌(breast cancer,BC)亚型。TNBC具有高度异质性和侵袭转移能力[1],对常规内分泌治疗和化疗药物不敏感,因而预后较差。TNBC具有的高突变率引起免疫原性增加以及更多的免疫细胞浸润[2]。在正常组织中,信号转导子和转录激活子-1(activator of transcription,STAT1)能传递多种细胞因子和生长因子的信号,促进免疫激活、抑制免疫过激,维持机体正常的免疫功能[3]。STAT1具有活性(pSTAT1)与非活性(uSTAT1)两种状态,pSTAT1仅在激活后数小时内能被检测到[4,5]。2-(1,8-萘啶-2-基)苯酚又称为2-NP,通过促进STAT1 Tyr701(酪氨酸)位点的磷酸化,维持pSTAT1的持续表达[6]。细胞程序性死亡-配体1(programmed cell death 1 ligand 1,PD-L1),是早发现的一个重要免疫检查点,以PD-L1为免疫检测指标的肿瘤靶向治疗药物已投入临床应用,提高肿瘤中PD-L1的表达可以为免疫治疗提供有效的靶点[7]。本实验检测pSTAT1与PD-L1在TNBC中的表达并探讨其相关性,为TNBC的治疗提供理论依据。
1 材料与方法
1.1 材料
(1)标本选取内蒙古医科大学附属医院2017~2019年经病理确诊的120例乳腺癌组织,其中50例TNBC组织,70例非non-TNBC组织,收集同期36例乳腺良性病变(腺病)组织,所有病例术前均未经过放化疗治疗且临床资料完整;(2)细胞选取MDAMB-468和MCF-7人乳腺癌细胞系,均购于中国医学科学院,其中MDA-MB-468为TNBC细胞系,MCF-7为non-TNBC细胞系;(3)实验试剂,抗体使用Phospho-Stat1兔单克隆抗体(Tyr701)(58D6)和PD-L1兔单克隆抗体(E1L3N)XP,均购自Cell Signaling Technology(CST)公司;即用型免疫组化超敏UltraSensitiveTM SP试剂盒购自福州迈新生物技术开发有限公司;2-NP购自上海陶素生物科技有限公司;qRT-PCR试剂盒购自北京全式金生物技术(TransGen Biotech)有限公司;引物购自生工生物工程(上海)有限公司。
1.2 方法
免疫组化采用EnVision法,经过脱蜡,抗原修复,3%双氧水封闭,山羊血清封闭,一抗孵育,二抗孵育,DAB显色,苏木素染色,脱水透明,封片;操作过程严格按照产品说明书进行;pSTAT1使用EDTA微波热修复,抗体稀释比例为1:800;PD-L1使用柠檬酸微波热修复,抗体稀释比例为1:200。
实时荧光定量PCR(quantitative real-time PCR,qRT-PCR),使用DMEM基础培养基、灭活胎牛血清(FBS),按9:1的比例配制成完全培养基,于一定湿度的37℃恒温二氧化碳培养箱中常规培养MCF-7和MDA-MB-468细胞,当细胞长至培养瓶85%~90%,并且细胞状态良好时,对照组经2-NP(45uM)处理一小时后,提取对照组与正常对照组(DMSO组)中的RNA,反转录合成cDNA,采用qRT-PCR检测MCF-7、MDA-MB-468细胞系处理组与对照组中PD-L1和IRF-1的相对表达量。所用引物序列:PD-L1:F-TGGCATTTGCTGAACGCATT、R-TGCAGCCAGGTCTAATTGTTTT,IRF-1:F-CGGGGCTCATCTGGATTAATAA、R-GGTCTTTCACCTCCTCGATATC,β2MG(内 参):F-TGTTGCCATCAATGACCCCTT、R-CTCCACGACGTACTCAGCG
1.3 结果判定
乳腺癌组织中,pSTAT1表达于癌细胞以及免疫细胞的细胞核中,部分细胞质伴有少量表达,以癌细胞核阳性作为判读指标;PD-L1表达于癌细胞以及免疫细胞的细胞膜和细胞质中,以癌细胞膜阳性作为判读指标。乳腺腺病中,以腺上皮细胞核(pSTAT1)或细胞膜(PD-L1)阳性为阳性指标。
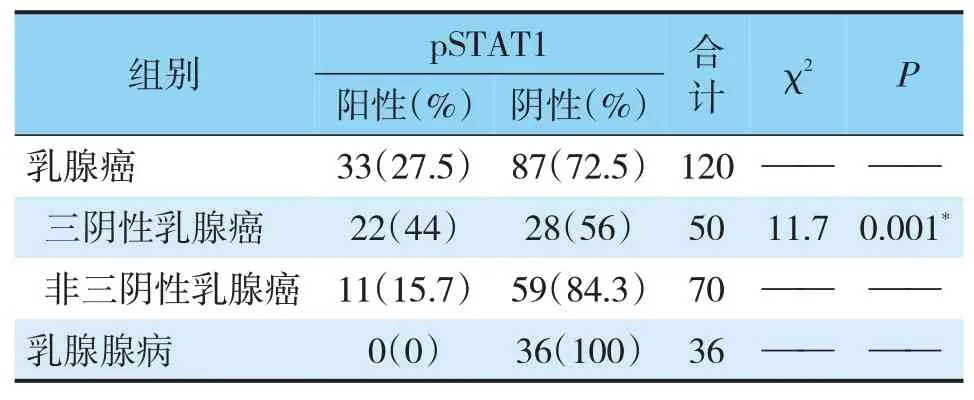
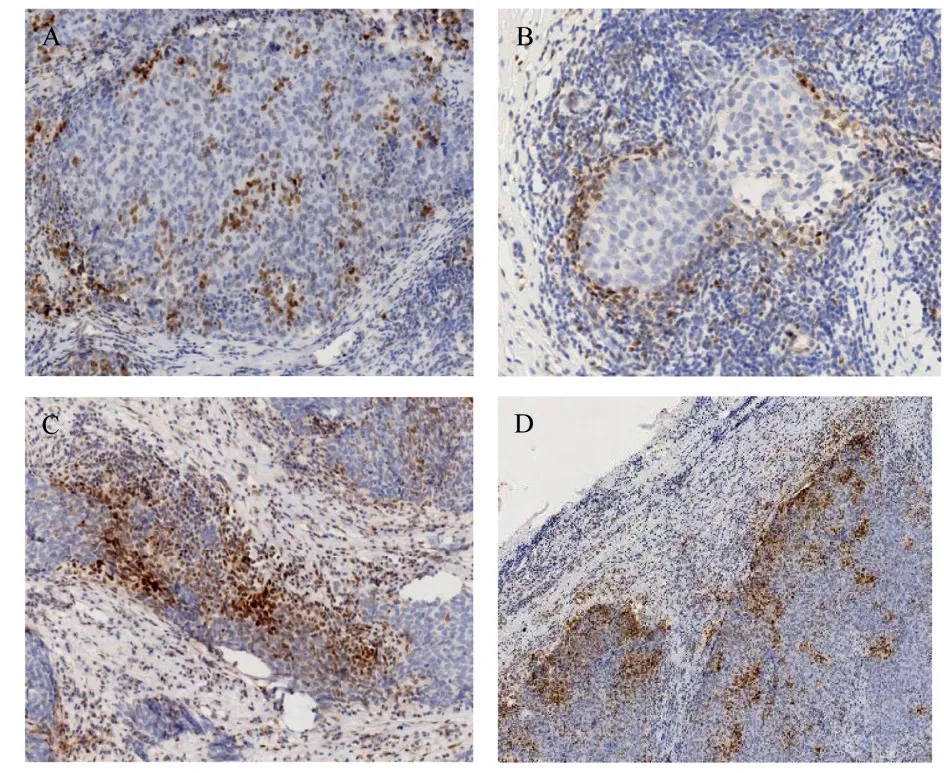
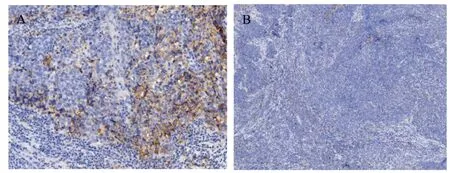
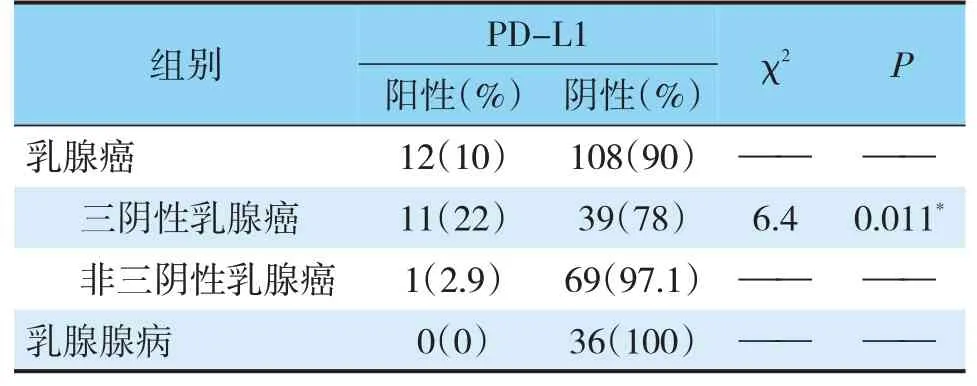
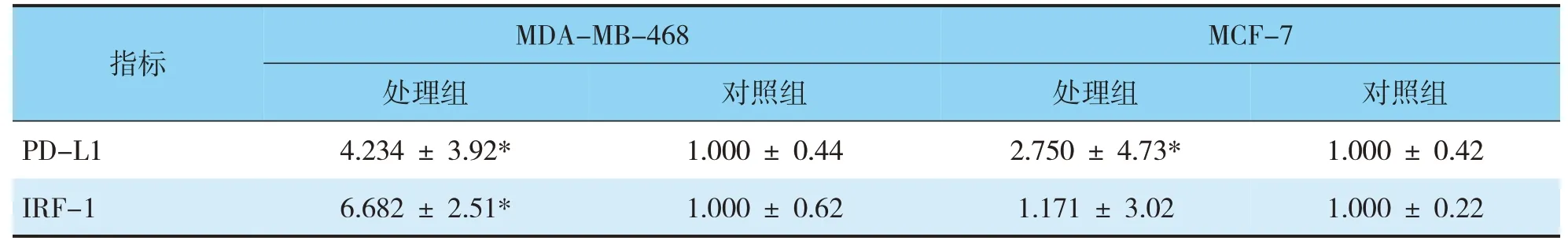
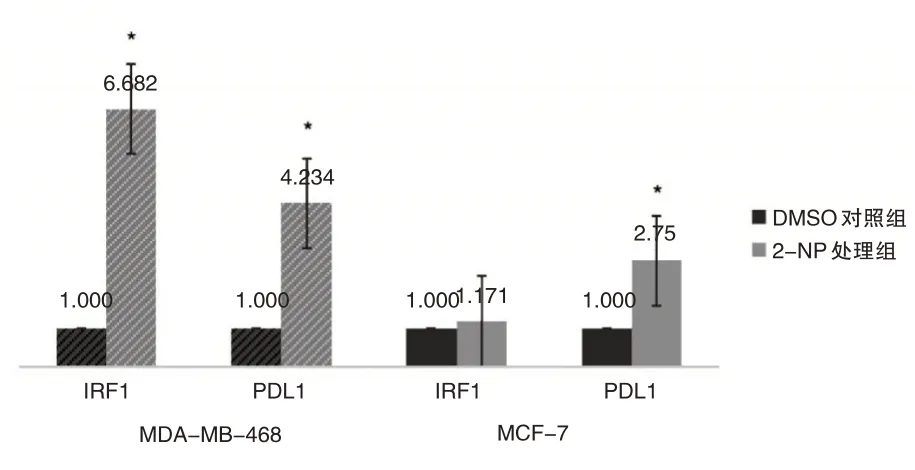
免疫组化采用肿瘤细胞阳性比例分数(tumor proportion score,TPS)打分,随机选取10个高倍镜视野(×400),每个视野最少计数100个肿瘤细胞,然后计算每个高倍视野中阳性细胞的百分比,再算出10个视野的平均百分率,以TPS≥1%为阳性,0 实验数据使用SPSS 22.0统计软件进行分析,比较采用χ2检验、Spearman相关性分析、方差分析以及Fisher确切概率法进行数据分析,检验水准为α=0.05,P<0.05认为差异有统计学意义。 2.1.1pSTAT1在乳腺癌中的表达(见图1)根据TPS打分标准,BC阳性率为27.5%,TNBC阳性率为44%,non-TNBC阳性率15.7%,乳腺腺病不表达pSTAT1,阳性率为0(pSTAT1在腺上皮细胞中不表达,肌上皮细胞鲜有表达,以腺上皮细胞核阳性为判读标准);与non-TNBC相比TNBC表达水平显著升高,且具有统计学差异(χ2=11.7,P=0.001<0.05)(见表1)。 表1 pSTAT1在乳腺癌和乳腺腺病组织中的表达情况Tab.1 TheexpressionofpSTAT1inbreastcancerandbenigntissues 2.1.2在TNBC中pSTAT1阳性病例具有多种特殊表达模式(1)阳性肿瘤细胞以点灶状分散在癌巢中(见图1A)占总阳性病例数40.9%;(2)阳性肿瘤细胞集中在肿瘤巢团与间质交界处(见图1B)占总阳性病例数27.3%;(3)部分病例中可观察到癌巢呈弥漫表达(见图1C),占总阳性病例数18.2%;(4)而较少的病例中可出现点灶和交界模式混合表达,占总阳性病例数13.6%(见图1D、表2),以上四种模式可以概括为,散在点灶状分布、癌巢边缘分布、弥漫表达和混合表达。 图1 pSTAT1在乳腺癌中的表达Fig.1 The expression of pSTAT1 in breast cancer 表2 pSTAT1在乳腺癌中的表达模式及其比例分布Tab.2 Theexpressionpatternandproportiondistributionof pSTAT1inbreastcancer 2.1.3PD-L1在乳腺癌中的表达(见图2A)结果判读采用TPS打分标准,120例乳腺癌阳性率为9.23%,TNBC阳性率为22.0%,non-TNBC阳性率为2.9%,36例乳腺腺病阳性率为0(以腺上皮细胞膜阳性为判读标准);PD-L1在TNBC和non-TNBC中的表达差异具有统计学意义(χ2=7.41,P=0.001<0.05)(见表3)。 图2 PD-L1在乳腺癌中的表达Fig.2 Expression of PD-L1 in breast cancer 表3 PD-L1在乳腺浸润性癌和乳腺腺病组织中的表达情况Tab.3 TheexpressionofPD-L1inbreastinvasivecarcinomaand benignlesions 2.1.4pSTAT1与PD-L1表达的相关性分析TNBC中pSTAT1与PD-L1表达位置相似,二者可能存在共表达(见图3);通过统计学分析,pSTAT1与PDL1的表达具有相关性(r=0.507,P<0.05)(见表4)。 图3 乳腺癌中PD-L1和pSTAT1的表达Fig.3 The expression of PD-L1 and pSTAT1 in breast cancer 表4 pSTAT1与PD-L1表达的相关性分析Tab.4 CorrelationanalysisofpSTAT1andPD-L1positive expression 经qRT-PCR检测结果显示,MCF-7、MDAMB-468的处理组中PD-L1的相对表达量均高于对照组,MDA-MB-468处理组中PD-L1的表达量为对照组的4.234倍,具有统计学差异(P<0.05);MCF-7处理组中PD-L1的表达量为对照组的2.75倍,具有统计学差异(P<0.05);MDA-MB-468中IRF-1的表达量为对照组的6.682倍,具有统计学差异(P<0.05);MCF-7中IRF-1的表达量为对照组的1.171倍,处理组与对照组相比不具有统计学差异(P>0.05);MDA-MB-468较MCF-7中IRF-1和PD-L1的表达量增高的更为显著(见表5、图4)。 表5 IRF-1和PD-L1的相对表达量Tab.5 RelativeexpressionlevelsofIRF-1andPD-L1 图4 IRF-1和PD-L1的相对表达量Fig.4 Relative expression of IRF-1 and PD-L1 早在1902年,STAT1就开始被关注和研究。STAT1除具有激活机体抗炎、抗肿瘤免疫反应外,与肿瘤的生长、转移等密切相关[8~10],如肾癌、肺腺癌以及胰腺癌中,高表达的STAT1与患者的生存期(overall survival,OS)低有关,特别是在肾癌中STAT1表达的增加与高级别、晚期、体积较大的肿瘤、淋巴结转移和远处转移有关[9]。与STAT1表达低或不表达的乳腺癌患者相比,高表达STAT1的患者预后更差[6],STAT1在肿瘤中的功能并非始终处于良性端。通常情况下,STAT1以非活性(uSTAT1)的无功能形式存在,仅在激活后数小时内以活性(pSTAT1)状态存在并发挥其传导和转录功能[4]。目前,活性状态的pSTAT1在TNBC中的研究较少,其功能和意义尚无明确解释。 本研究中发现,pSTAT1在TNBC中存在特异性激活,并且具有四种不同的表达模式,pSTAT1高表达的肿瘤细胞周围常伴有较多的免疫细胞,推测肿瘤细胞中pSTAT1的表达可能是受到相邻免疫细胞的激活。STAT1的活化受到IFN-γ等细胞因子的作用,而激活的免疫细胞分泌大量的细胞因子[8]。通过以上分析发现,pSTAT1的表达模式可能反应了肿瘤中免疫细胞浸润的程度。(1)点灶状,表现为pSTAT1阳性的肿瘤细胞呈片状或小灶状表达于肿瘤巢团内;可能是由于少量的免疫细胞分散浸润于癌巢中,相邻肿瘤细胞受到激活持续表达pSTAT1(见图1A);(2)癌巢边缘表达模式,表现为pSTAT1高表达在癌巢与间质交界处的的肿瘤细胞中,这一类型的癌巢周边常伴有较多的免疫细胞浸润,但免疫细胞很少侵入癌巢中(见图1B),推测免疫细胞分布在癌巢周围,因此刺激肿瘤边缘细胞高表达pSTAT1;(3)弥漫表达,推测是由于大量的免疫细胞浸润于癌巢中,引起pSTAT1弥漫表达(见图1C);(4)混合表达,癌巢边缘与点灶状模式同时表达,可能是由于免疫细胞包围并浸润到癌巢中,激活相邻肿瘤细胞高表达pSTAT1(见图1C)。 既往研究表明,PD-L1抑制T细胞功能,传导免疫抑制信号,是肿瘤免疫逃逸的关键机制之一[11]。本研究中发现,与non-TNBC相比,TNBC中高表达PD-L1,PD-L1的高表达可能协助TNBC免受微环境中的免疫攻击和控制。对比发现,pSTAT1与PDL1在TNBC中的表达分布一致,二者可能存在共表达(见图3);通过统计学分析,pSTAT1与PD-L1的表达具有相关性(P<0.05)。 为了进一步证实二者的相关性,我们使用STAT1激活剂2-NP处理人乳腺癌细胞系MDAMB-468和MCF-7,观察PD-L1和IRF-1的表达。由于2-NP对核因子(NF)κB、STAT3无作用,因此对STAT1具有特异性[12,13]。结果显示,与对照组相比,2-NP处理后两种细胞系中的PD-L1表达均上调,证实乳腺癌中pSTAT1与PD-L1具有正相关性。MCF-7中处理组IRF-1表达量高于对照组,但差异不具有统计学意义,MDA-MB-468较MCF-7中IRF-1和PD-L1的表达量增高的更为显著(见图4),提示TNBC中pSTAT1高表达可能会诱导STAT1-IRF1-PDL1通路的激活;而non-TNBC中pSTAT1与PD-L1虽具有正相关性,但可能尚存在其他通路。已有最新实验证实,在恶性黑色素瘤及卵巢癌中存在STAT1-IRF1-PDL1通路级联激活,诱导免疫检查点配体PD-L1的高表达[14,15]。STAT1作为机体下放免疫信号的重要调节因子,不仅能够激活免疫系统,在炎症后期通过限制免疫反应,避免免疫过激也起到重要作用,STAT1相关的炎症级联反应是调节这一免疫平衡的关键[4]。TNBC可能利用STAT1的免疫调节能力,持续性高表达pSTAT1,进而上调PD-L1的表达,协助肿瘤逃避免疫系统的识别与攻击,最终产生免疫逃逸。这或许能够在某种程度上解释适应性免疫系统不能识别和破坏高免疫原性肿瘤细胞的原因。 综 上 所 述,pSTAT1和PD-L1在TNBC中 高 表达,pSTAT1促进了PD-L1在TNBC中表达,pSTAT1有望成为TNBC免疫治疗的重要靶标,为TNBC临床治疗提供新的策略。1.4 统计学分析
2 结果
2.1 pSTAT1与PD-L1在TNBC组织中的表达



2.2 实时荧光定量PCR(qRT-PCR)检测IRF-1和PD-L1的相对表量
3 讨论
