黑沙蒿治疗过敏性鼻炎的网络药理学研究
2021-09-19孙国园朱小玲李斌鑫
孙国园,朱小玲,贾 鑫,李斌鑫,董 玉
(1.内蒙古自治区国际蒙医医院药学部,内蒙古 呼和浩特 010065;2.内蒙古自治区蒙药药效物质与质量控制工程技术研究中心;3.内蒙古医科大学附属医院药剂部;4.内蒙古医科大学药学院)
黑沙蒿(Artemisaordosica)蒙古名为哈拉-沙巴嘎,又称沙蒿、鄂尔多斯蒿、油蒿、籽蒿,为菊科蒿属植物。在我国主要分布于内蒙古、河北(北部)及山西,具有良好的防风固沙性能[1]。黑沙蒿味辛苦,性微温。据《中华本草》记载,黑沙蒿可祛风除湿、解毒消肿,主治风湿性关节炎、感冒头痛、咽喉肿痛等[2]。研究表明[3],黑沙蒿的主要活性成分包含黄酮类、挥发油类和三萜类,香豆素类等,可以增强免疫力,提高氧化功能等。近年来大面积飞机播种使黑沙蒿分布更加广泛,据调查,黑沙蒿在我国分布面积达37500万亩[4]。随着黑沙蒿分布面积的扩大,蒿粉过敏引起的过敏性鼻炎(allergic rhinitis,AR)和哮喘病例不断增加,严重影响了当地居民的正常生活。有数据显示,全球的过敏性鼻炎患者超过5亿[5]。过敏性鼻炎在我国大陆地区人口中的患病率达到4%~38%,不同地区之间差异较大[6]。过敏性鼻炎主要临床表现为流涕、鼻痒、眼痒、喷嚏、鼻塞和咳嗽等急性过敏反应,严重者会引发过敏性哮喘。目前,西医临床治疗过敏性鼻炎常用抗组胺药、肾上腺皮质激素、减充血剂、肥大细胞稳定剂等,其中抗组胺药、肾上腺皮质激素应用较多,这些药物能控制AR症状却不能根治,而且有副作用。最近,有研究人员评估了黑沙蒿提取物对过敏性鼻炎(AR)和体内抗炎症作用减弱效果,结果表明黑沙蒿提取物能够减轻卵清蛋白(OVA)诱导的AR症状[7],这为黑沙蒿抗过敏性鼻炎提供了有力的证据。本研究基于网络药理学探寻黑沙蒿的潜在活性成分、靶点及信号通路,阐释黑沙蒿抗AR作用机制,为黑沙蒿治疗AR提供理论依据。
1 应用的软件与方法
1.1 软件(见表1)

表1 软件
1.2 方法
1.2.1化学成分的收集及其靶点的预测 通过查阅文献搜集黑沙蒿的化学成分,将所筛选的化学成分通过Pubchem数据库查询其结构信息,将查询到的化合物结构信息输入Swiss Target Prediction数据库,以Probability≥0.6为条件预测其作用靶点,整合、去掉重复项。
1.2.2疾病靶点的筛选通过TTD、Drugbank、Dis-GeNET数据库筛选出过敏性鼻炎(allergic rhinitis,AR)的作用靶点。
1.2.3化学成分及AR共同靶点的获取在Venny2.1在线软件上分别导入所选化学成分和AR作用靶点,绘出韦恩图,两者取交集部分,即黑沙蒿抗AR的作用靶点。
1.2.4“成分-靶点”网络的构建与分析将“1.2.1”中收集到的化学成分以及“1.2.3”所获取的抗AR的作用靶点导入Cytoscape3.7.2软件,构建“成分-靶点”相互作用网络,使用Cytoscape对药物中的主要活性成分进行分析,节点的大小代表度值(degree)的大小。
1.2.5PPI网络构建与分析将“1.2.3”所获取的抗AR的作用靶点导入到STRING数据库中,设置蛋白种类为“Homo sapiens”检索,最低相互作用阈值为0.4,得到蛋白相互作用的信息,将其导入到Cytoscape3.7.2软件后绘出PPI网络。
1.2.6通路富集分析用DAVID数据库对潜在作用靶点进行GO(gene ontology)富集分析和KEGG(kyoto encyclopedia of genes and genomes)通路分析,并分析AR的生物过程和信号通路。
2 结果
2.1 黑沙蒿中的化学成分
通过文献检索,获得黑沙蒿中的化学成分20个[1,3,8,9](见表2)。

表2 化合物名称
2.2 化学成分及AR共同靶点的获取
通过Swiss Target Prediction数据库筛选出化学成分的作用靶点,整合、去掉重复值后得到383个作用靶点。通过TTD、Drugbank、DisGeNE数据库筛选出AR的作用靶点,去掉重复值后得到413个靶点。将所选化合物靶点和疾病靶点导入Venny2.1在线软件上,绘出韦恩图,得到共同靶点63个(见图1)。
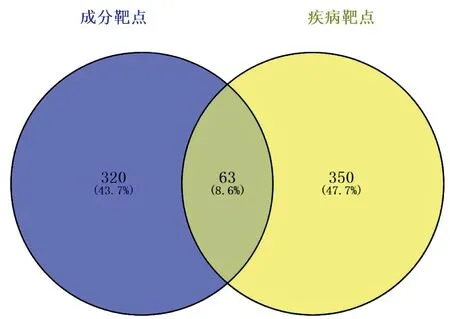
图1 黑沙蒿有效成分-AR靶点韦恩图
2.3 活性成分-靶点网络构建
将收集到的黑沙蒿的成分靶点与AR的作用靶点导入Cytoscape 3.7.2软件,取所有靶点中共同的部分,绘出网络图(见图2),该网络共包括35个节点,183条边,其中绿色节点为化合物分子,红色节点为药物靶点,边为化合物分子与靶点之间的相互关系。图中,度值较大的成分分别是黄酮类化合物Genkwanin(HSH-4,芫 花 素)、hydroxygenkwanin(HSH-5,羟基芫花素)、acacetin(HSH-8,金合欢素),cirsimaritin(HSH-9,滨蓟素)。度值较大的靶点是ACHE(乙酰胆碱酯酶)、ESR2(雌激素受体)、ADORA1(腺苷A1受体)、ADORA2A(腺苷A2A受体)、ALOX5(花生四烯酸5-脂氧合酶)等。每个化合物与多个靶点相关联,同时,一个靶点被多个化合物作用,体现了黑沙蒿多成分、多靶点的作用机制(见图2)。
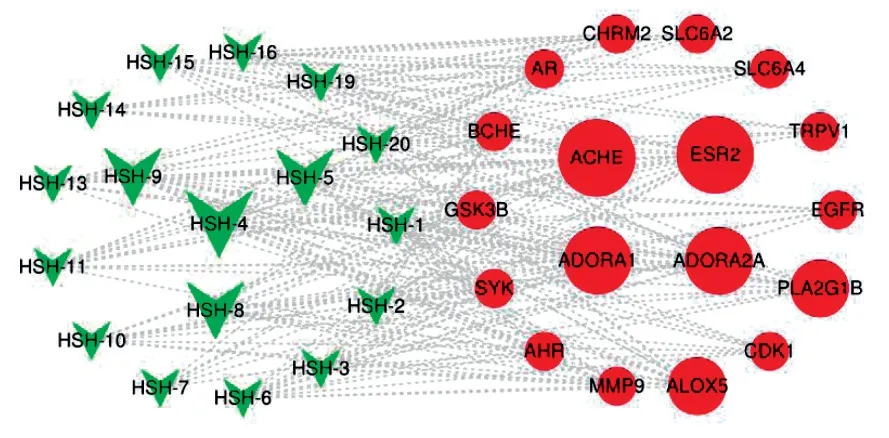
图2 黑沙蒿活性成分-靶点网络
2.4 PPI网络构建
在STRING数据库中录入黑沙蒿活性成分与过敏性鼻炎(AR)共同靶点,即抗AR的作用靶点,设置蛋白种类为“Homo sapiens”检索,最低相互作用阈值为0.4,得到PPI网络关系数据,输入Cytoscape3.7.2软件,分析并构建PPI网络图。图中,度值越大,节点越大,其在整个网络中就越关键。该网络总共包括13个节点和20条边,其中,靶点EGFR(表皮生长因子受体)的度值最大;其次是MMP9(基质金属肽酶9)、AR(雄激素受体)、AHR(芳香烃受体)(见图3),推测EGFR是黑沙蒿治疗AR的关键靶点。

图3 黑沙蒿治疗AR的蛋白相互作用PPI网络
2.5 基因功能与通路分析
使用DAVID数据库对黑沙蒿活性成分对应靶点进行GO分析和KEGG通路分析,GO富集分析包括生物过程(biological process,BP)、分子功能(molecularfunction,MF)和细胞组分(cellular component,CC)3个分支,PValue值设为小于0.05,并筛选前10个生物过程,用GraphPad Prism 5.0绘图(见图4~6);共富集到4条通路,红色条形的长短表示基因数目的多少,绿色条形的长短表示P的负对数值,该值越大说明信号通路的显著性越高(见图7)。

图4 黑沙蒿治疗AR的BP富集分析
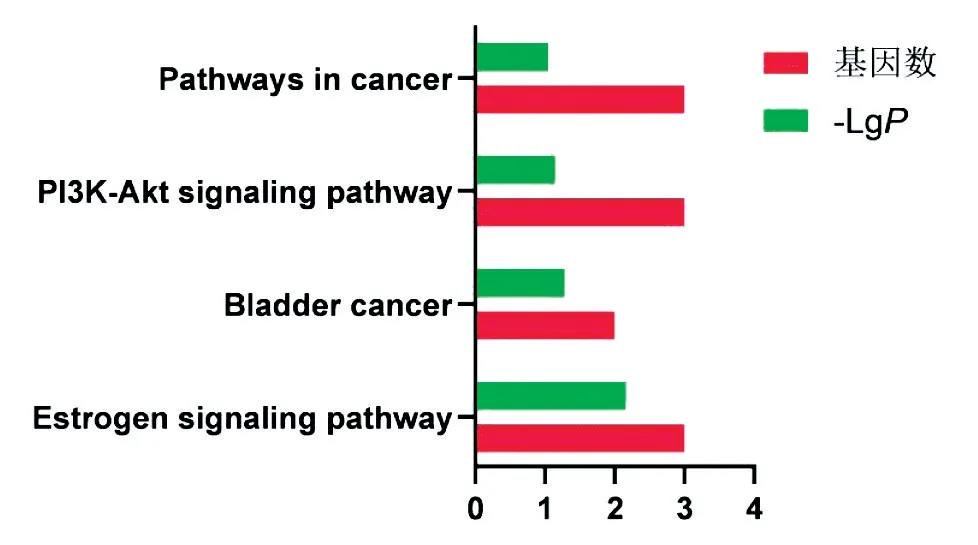
图7 黑沙蒿治疗AR的KEGG通路分析
黑沙蒿抗过敏性鼻炎的BP富集分析结果(见图4),作用靶点主要涉及细胞增殖(cell proliferation)和凋亡过程的负调控(negative regulation of apoptotic process)等。黑沙蒿抗过敏性鼻炎的CC富集分析结果,靶点主要涉及突触(synapse)和不对称突触(asymmetric synapse)等(见图5)。MF分析结果显示,受体信号蛋白酪氨酸激酶活性(receptor signaling protein tyrosine kinase activity)相关性最大(见图6)。雌激素信号途径(Estrogen signaling pathway)基因数最多,P负对数值最大(见图7)。
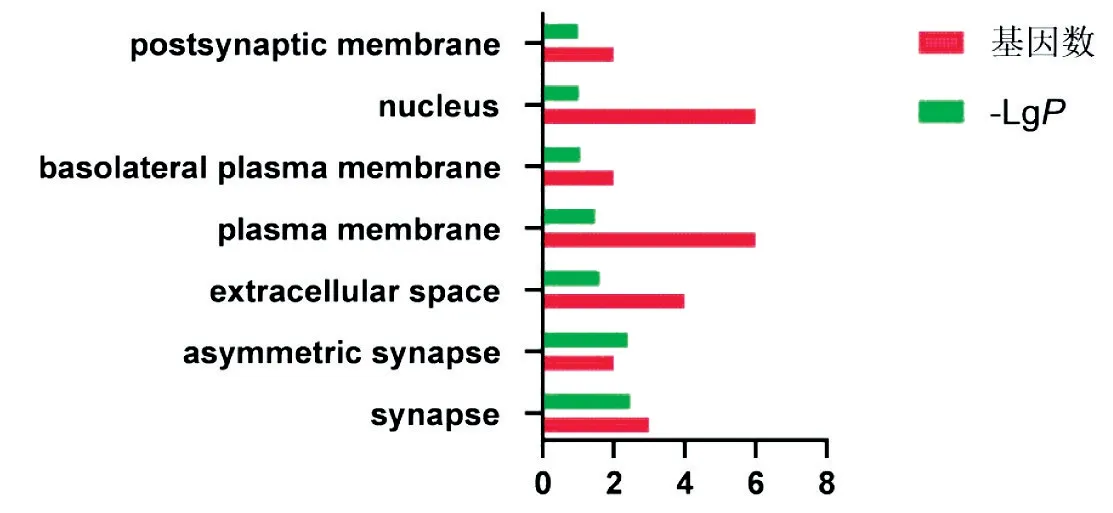
图5 黑沙蒿治疗AR的CC富集分析
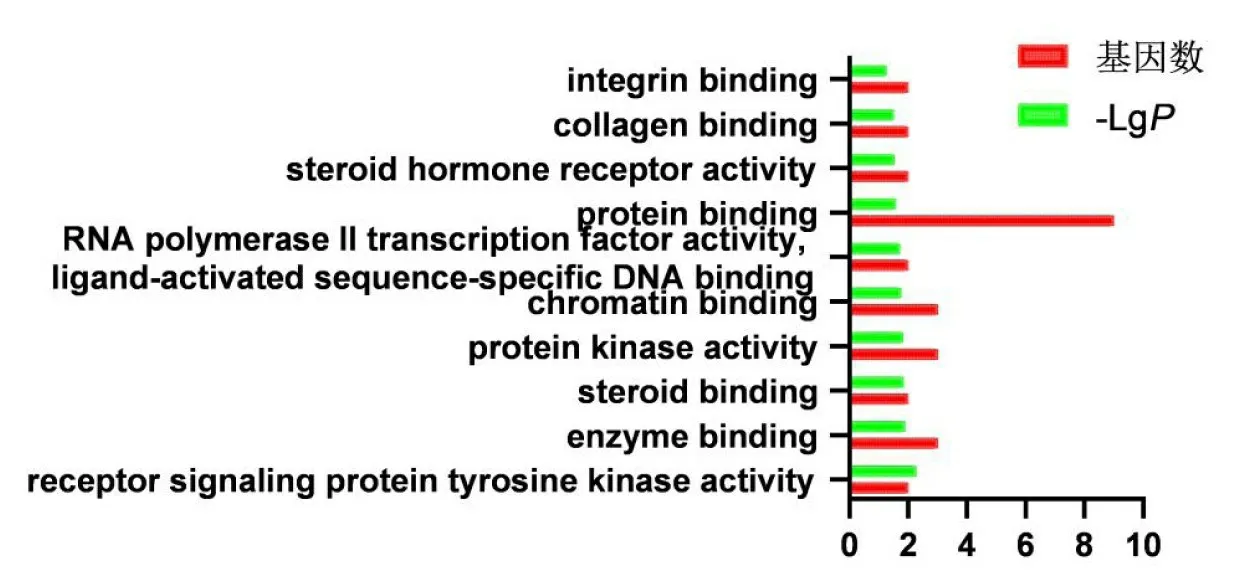
图6 黑沙蒿治疗AR的MF富集分析
2.6 黑沙蒿治疗AR的活性成分-靶点-通路网络模型
将筛选出的黑沙蒿治疗AR的活性成分、靶点及通路,输入Cytoscape 3.7.2软件,构建“活性成分-靶点-通路”网络图。该图有21个节点,55条边,绿色节点为活性成分,粉色节点为潜在靶点,红色节点为调控通路,边为三者之间的作用关系,节点越大,表明黑沙蒿对AR的影响越深(见图8)。分析结果表明,参与治疗AR的信号通路的关键靶点是CHRM2(毒蕈碱乙酰胆碱受体M2)、ESR2(雌激素受体)、MMP9(基质金属肽酶9)、EGFR(表皮生长因子受体)、SYK(酪氨酸激酶)等,表明它们可能是治疗AR过程中的核心作用靶点。由图可以看出黑沙蒿活性成分通过不同的靶点,不同的调控通路,共同发挥抗AR的作用。
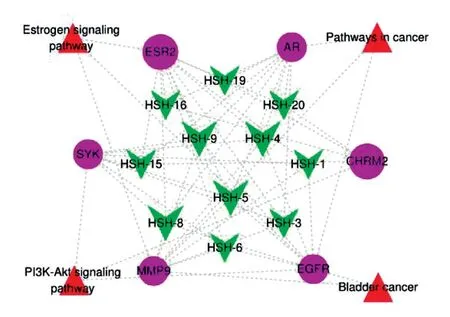
图8 黑沙蒿治疗AR的“活性成分-靶点-通路”
3 讨论
在网络药理学研究过程中,活性化合物筛选大多借助中药系统药理学分析平台(TCMSP)和BATMAN-TCM选取口服生物利用度(OB)≥30%和类药性(DL)≥0.18的成分。但是以上系统中没有收录黑沙蒿化合物相关信息,所以本文通过文献收集整理得到黑沙蒿的化学成分。
过敏性鼻炎(allergic rhinitis,AR)也称为反应性鼻炎,是一种常见的衰弱性疾病,通常指由IgE介导的鼻黏膜I型变态反应。反应机制是IgE抗体与肥大细胞表面Fc受体(FcεRI)结合,通过FcεRI激活肥大细胞和嗜碱性粒细胞,导致其脱颗粒和脱核合成,引起组胺、白三烯、前列腺素和白介素等炎性介质的释放。组胺可提高局部血流量,使血管的通透性增加,引起组织肿胀、瘙痒,从而引起鼻痒、喷嚏和鼻塞等过敏反应[10]。因此,调控气道上皮细胞释放介质是治疗AR的主要靶点。现代药理研究证明[11],中蒙药复方、单味药及其提取物可以抑制IgE的形成,也可抑制组胺等炎性介质的释放等。本文筛选得到的主要活性成分Genkwanin(HSH-4,芫花素)、hydroxygenkwanin(HSH-5,羟基芫花素)、acacetin(HSH-8,金合欢素),cirsimaritin(HSH-9,滨蓟素)都属于黄酮类化合物。研究证明黄酮类化合物具有抗菌、抗病毒、抗氧化自由基、抗炎、镇痛、提高机体免疫力、抗变态反应等多种药理活性。图8中的靶点SYK活化后可调节细胞内信号通路如CJun NH2末端激酶(JNK)途径和有丝分裂原活化蛋白激酶(MAPK)途径[10]。Genkwanin(芫花素)以浓度依赖性方式抑制JNK途径中的磷酸化[12],阻止通过激活SYK依赖的信号通路而导致的肥大细胞脱颗粒释放组胺、白三烯和细胞因子等炎症介质。Acacetin(金合欢素)不仅能够调节Th17/Treg的平衡[13],还可以有效抑制鼻粘膜上Th2细胞分泌IL-4等炎症细胞因子[14],对治疗过敏性鼻炎具有显著的疗效[15]。Duncan F等研究表明,表皮生长因子受体(EGFR)及其酪氨酸激酶(tyrosine kinase)可上调MUC基因表达,参与粘液合成,促进鼻粘膜和下呼吸道杯状细胞增生,EGFR受体通过Th2细胞因子和氧化应激反应增强气道粘液分泌。基质金属肽酶(MMPs)既能降解细胞外基质,又能介导蛋白酶活化和细胞因子分泌,从而影响炎症过程。有研究表明,在炎症反应后期,过敏原刺激鼻腔,导致MMP9的释放。Lim等报道长期过敏原激发可引起鼻粘膜和肺组织相关的气道重塑,同时MMP9和组织金属蛋白酶抑制剂1(Timp-1)表达增加。过敏性鼻炎患者外周血淋巴细胞CHRM2受体蛋白表达明显升高,CHRM2受体表达增加与疾病严重程度相关。过敏性鼻炎中毒蕈碱乙酰胆碱能受体(CHRM2)表达的变化证明了免疫细胞胆碱能系统在过敏性气道疾病中的作用。
KEGG通路分析,富集到4条通路。Lin Hai等研究发现抑制PI3K-Akt signaling pathway(磷脂酰肌醇3激酶信号通路)能有效地抑制肥大细胞的活性,从而稳定肥大细胞膜防止其脱颗粒,抑制组织胺等过敏介质的释放。Fan Z等研究证实,雌激素引起免疫反应偏离,促进Th2极化诱导过敏反应,促进肥大细胞和嗜碱性粒细胞的脱颗粒,引起组胺等炎性介质的释放。雌激素与雌激素受体ESR2(见图8)结合活化雌激素信号通路,能够降低炎症因子水平,减轻细胞浸润。因此,雌激素信号通路(estrogen signaling pathway)可能是治疗过敏性炎症疾病的关键通路。由此推测黑沙蒿活性成分可能通过雌激素信号通路、PI3K-Akt信号通路等治疗AR。在本研究中,癌症信号通路与膀胱癌通路均与靶点EGFR(表皮生长因子受体)和MMP9(基质金属肽酶9)相关联,可能与AR发病过程有关,具体机制需要后续实验进一步验证。
本文通过网络药理学方法预测了蒙药黑沙蒿有效成分及靶点,并通过生物学分析,构建“活性成分-靶点-通路”关系网络、揭示黑沙蒿活性成分-靶点-通路之间的协同作用,初步探索了黑沙蒿治疗AR的作用机制,为进一步研究黑沙蒿治疗过敏性鼻炎提供理论参考。
