黄腐酚对蛛网膜下腔出血后神经炎症影响及机制研究
2021-09-18李佳朔潘鹏宇陈立刚杨新宇李侑埕梁国标
李佳朔, 潘鹏宇, 陈立刚, 邹 正, 杨新宇, 孔 睿, 李侑埕, 梁国标
北部战区总医院 神经外科,辽宁 沈阳 110016
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是一种发病率高,且病死率高达50%的脑卒中疾病,常伴有永久性的神经功能损伤[1]。有研究表明,早期脑损伤是导致SAH后死亡、残疾等不良预后的重要原因[2]。炎症反应、氧化应激损伤、神经元细胞凋亡等在内的病理、生理变化是造成早期脑损伤的主要原因[3]。SAH后过激的炎症反应刺激炎症因子激活,通过各种炎症通路造成脑细胞病理性凋亡,进而造成脑水肿,血脑屏障破坏等诸多损伤[4]。因此,通过抑制SAH后的炎症反应可以减轻早期脑损伤,保护神经,改善预后。Toll样受体(Toll-like receptors,TLR)是PRR家族的一部分,可以识别微生物病原体,激活先天及获得性免疫反应,引起多种促炎症细胞因子的表达[5-6]。因此,通过抑制TLR可以发挥抗炎的生物活性。在Toll样受体的众多受体中,TLR4是最重要的脂多糖受体[7]。作为TLR4的下游因子,NF-κB同样具有多种生物活性,如调节炎症、细胞凋亡及免疫应答[8]。在刺激状态下,NF-κB通过IκBα的磷酸化及核转位进行活化,发挥其生物活性[9]。因此,通过TLR4/NF-κB通路抑制TLR4及NF-κB,可以减少炎症细胞因子表达,发挥抗炎作用。黄腐酚(xanthohumol,XN)是一种异戊二烯基黄酮类物质,具有抗炎、调节凋亡及自噬、抗癌、抗糖尿病在内的多种生物活性[10-11]。这些发现在脑缺血性卒中的研究中也得到了证实[12]。目前,XN在SAH动物模型中的神经保护作用的研究少见报道。本研究旨在探讨XN对SAH早期脑损伤动物模型神经炎症的影响。现报道如下。
1 材料与方法
1.1 实验动物 SPF级雄性KM小鼠120只,体质量28~30 g,购自辽宁长生生物技术股份有限公司,许可证号SCXK(辽)2015-0001。实验小鼠饲养于恒温室中,每12 h光暗交替1次,日常给予充足的食物和清水,术前自由进食、进水,1周后进行手术。所有实验动物饲养与处理均严格按照“National Institutes of Health Guide for the Care and Use of Laboratory Animals”标准进行。将小鼠随机分为假手术(Sham)组(n=24)、模型(SAH)组(n=24),XN组(n=72)。将XN组小鼠分为XN 10 mg/kg组,XN 25 mg/kg组,XN 50 mg/kg组,每组各24只,于术前30 min腹腔注射相应剂量的XN。SAH组注射等量的溶剂(0.5% DMSO)。
1.2 实验试剂 XN质量分数≥97%,购自阿拉丁试剂有限公司;SDS-PAGE凝胶配制试剂盒,TUNEL细胞凋亡检测试剂盒,肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、NF-κB p65、p-IκBα、TLR4抗体购自碧云天公司;NeuN抗体购自Abcam公司;白细胞介素1β(interleukin-1β,IL-1β)抗体购自Santa公司。
1.3 研究方法
1.3.1 建立小鼠SAH模型 运用改良颈内动脉线穿刺法模拟SAH,建立SAH模型[13]。术前腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉,充分显露颈总动脉、颈内动脉、颈外动脉,夹闭颈总动脉及颈内动脉,结扎并剪断颈外动脉,于起始部剪“V”形口,将尼龙线导入颈内动脉,当有阻力时继续插入2 mm,迅速退出尼龙线,结扎缝合,置于37℃保温板上直至恢复。Sham组进行相同手术,但不刺破血管。
1.3.2 SAH严重程度评分 根据Sugawara评分标准评价SAH严重程度[14]。将基池分为6部分,根据每个节段内的凝块数量分为0~3级,将6个节段分数相加得出评分。评分越高表示出血量越大,SAH越严重。
1.3.3 神经功能评分 术后24 h根据平衡木试验及改良Garcia评分对小鼠进行神经功能评分,评估小鼠神经功能缺损程度。
1.3.4 脑组织含水量测定 术后24 h进行脑组织含水量测试。将小鼠处死后迅速取出完整的脑组织,称量其湿重。用110℃烘箱持续烘干72 h,重量不再变化后称量其干重。
脑含水量=(湿重-干重)/湿重×100%
1.3.5 蛋白免疫印迹法 术后24 h摘取小鼠脑组织,置于冰上迅速研磨匀浆,于4℃静置30 min,12 000 r/min 4℃恒温离心10 min取上清液。根据说明书利用BCA试剂盒进行蛋白定量,加入5×loading buffer后100℃恒温水浴5 min;每孔加入40 μg总蛋白样品,使用10% SDS-聚丙烯胺进行电泳,湿转至PVDF膜后5% BSA室温封闭1 h;加入一抗TNF-α(1∶1 000)、IL-1β(1∶1 000)、NF-κB p65(1∶1 000)、p-IκBα(1∶1 000)、TLR4(1∶1 000)、β-actin(1∶1 000)4℃孵育过夜;次日TBST清洗3次后,1∶800稀释二抗,室温孵育1 h,洗膜。利用ECL化学发光法显示结果。
1.3.6 免疫荧光法 小鼠处死后取新鲜脑组织,于10%多聚甲醛溶液中固定24 h,于30%蔗糖溶液中脱水,制成冷冻4 mm切片,选用IL-1β(1∶100),TUNEL细胞凋亡试剂,NeuN(1∶100)于4℃孵育过夜,次日PBS清洗3次,每次5 min。在37℃避光孵育相应二抗60 min后PBS洗涤3次,每次5 min,滴加抗荧光淬灭封片液封片,在荧光显微镜下观察。
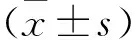
2 结果
2.1 各组Sugawara评分、神经功能评分、脑组织含水量及免疫荧光结果比较 Sham组Sugawara评分、脑组织含水量低于SAH组、XN 10 mg/kg组、XN 25 mg/kg组、XN 50 mg/kg组,平衡木试验评分、改良Garcia评分高于SAH组、XN 10 mg/kg组、XN 25 mg/kg组、XN 50 mg/kg组,差异均有统计学意义(P<0.05)。SAH组Sugawara评分高于XN 50 mg/kg组,平衡木试验评分低于XN 50 mg/kg组,改良Garcia评分低于XN 25 mg/kg组、XN 50 mg/kg组,脑组织含水量高于XN 25 mg/kg组、XN 50 mg/kg组,差异均有统计学意义(P<0.05)。免疫荧光检测细胞凋亡结果发现,SAH处理后神经元细胞凋亡增加,XN处理后神经元细胞凋亡减少,XN 50 mg/kg组效果最优。见图1。

图1 各组Sugawara评分、神经功能评分、脑组织含水量及免疫荧光结果比较(a.Sugawara评分;b.平衡木试验评分;c.改良Garcia评分;d.脑组织含水量;e.免疫荧光染色结果)
2.2 各组TLR4蛋白表达情况比较 SAH组、XN 10 mg/kg组、XN 25 mg/kg组TLR4蛋白表达水平明显高于Sham组,差异有统计学意义(P<0.05)。SAH组TLR4蛋白表达水平明显高于XN 10mg/kg组、XN 25 mg/kg组、XN 50 mg/kg组,差异有统计学意义(P<0.05)。见图2。

图2 各组TLR4蛋白表达情况比较
2.3 各组IκBα、NF-κB蛋白表达情况比较 Sham组IκBα、NF-κB蛋白表达低于SAH组、XN 10 mg/kg组、XN 25 mg/kg组、XN 50 mg/kg组,差异有统计学意义(P<0.05)。SAH组IκBα、NF-κB蛋白表达高于XN 10 mg/kg组、XN 25 mg/kg组、XN 50 mg/kg组,差异有统计学意义(P<0.05)。见图3。
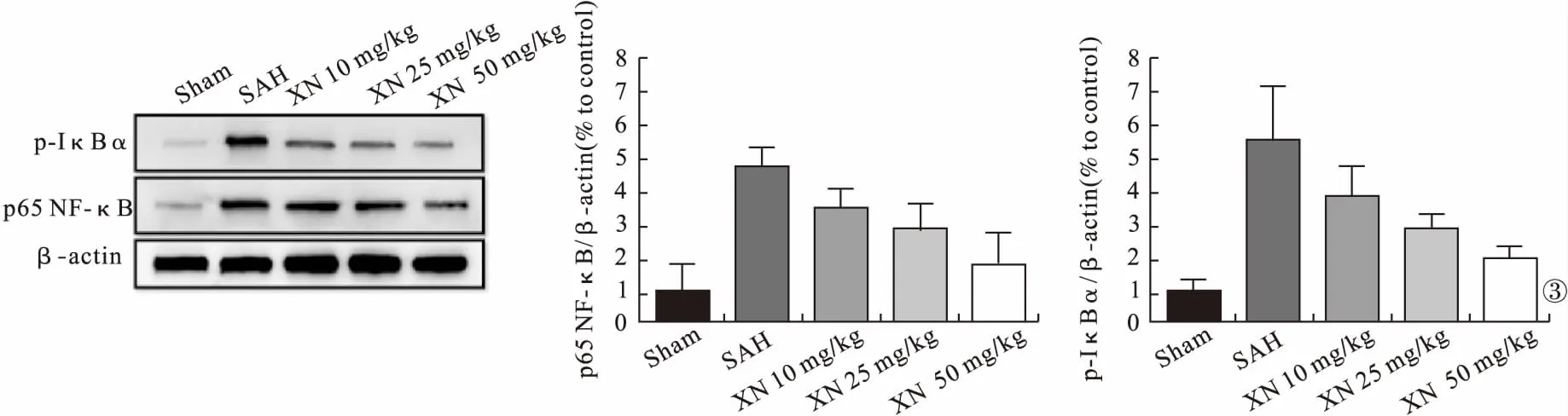
图3 各组IκBα、NF-κB蛋白表达情况比较
2.4 各组炎症因子表达情况比较 Sham组TNF-α、IL-1β表达低于SAH组、XN 10 mg/kg组、XN 25 mg/kg组、XN 50 mg/kg组,差异有统计学意义(P<0.05)。SAH组TNF-α、IL-1β表达高于XN 10 mg/kg组、XN 25 mg/kg组、XN 50 mg/kg组,差异有统计学意义(P<0.05)。见图4。

图4 各组炎症因子表达情况比较
3 讨论
SAH是一种危重的临床急性脑卒中疾病,在发病的患者中,约12.4%的患者立即死亡,约50.0%患者出现不同程度的永久性神经功能损伤,且出血后前几日的病死率也高达30.0%[15]。早期脑损伤是指SAH后72 h内的一系列病理、生理变化,包括颅内压升高,血脑屏障破坏,脑水肿,血管痉挛,氧化应激,炎症等[16],对患者病死率以及致残率有着极大的影响。这些最终导致了SAH后的细胞损伤及功能障碍。因此,在SAH发生的早期甚至发生前给予干预可以减轻患者出血后的早期脑损伤,对于改善预后有一定的积极作用。
XN具有抗炎、抗氧化、抗凋亡、预防肿瘤、保护神经等多种生理作用[17]。TLR是XN发挥其生理作用的最重要作用因子,可调节机体的免疫、炎症、凋亡等[13-14]。因此,抑制TLR4可以作为一种抑制过激炎症反应的治疗方法。本研究中,SAH处理后TLR4表达水平升高,而随着XN药物浓度的升高,TLR4蛋白表达水平逐渐降低,提示XN可以通过抑制TLR4的表达保护神经功能。既往研究发现,激活TLR4可产生转录因子NF-κB,进而发挥其重要的生理作用[18]。因此,抑制TLR4可以下调NF-κB,抑制过激的炎症反应。NF-κB是由Rel蛋白的二聚体组成,具有多种生物活性效应,如调节炎症、免疫反应、细胞凋亡等[19]。作为调节促炎基因表达的关键因子,NF-κB可引起炎性细胞的募集及炎症因子的释放[20]。有研究报道,XN可通过NF-κB发挥其抗炎、抑癌等生理作用[21-22],而NF-κB发挥作用与IκBα的磷酸化、NF-κB磷酸化及核转位相关[9]。因此,检测p-IκBα、p-65 NF-κB的表达水平可有效地反映NF-κB的活化程度。本研究发现,XN可以显著地抑制IκBα磷酸化及p65 NF-κB表达,说明XN可以抑制NF-κB活化程度,而高浓度XN(50 mg/kg)处理后对TLR4有显著的抑制作用。这提示,XN可以通过抑制TLR4的表达来下调NF-κB活化。
有研究报道,SAH后的炎症反应在出血发生的24 h内即可发生,其相关的炎症因子TNF-α、IL-1β均有明显升高,且由于其具有显著的细胞毒性、启动凋亡、破坏血脑屏障等危害,下调相关炎症因子的表达对神经功能具有正向的保护作用[23],与本研究结果一致。本研究中,SAH处理后,TNF-α、IL-1β的蛋白表达水平显著升高,而这种升高会被XN逆转,且随着XN药物浓度的增加,小鼠的出血严重程度、神经功能、脑水肿、细胞凋亡均得到改善,提示XN可能通过TLR4/NF-κB途径抑制SAH后炎症因子的表达,起到神经保护作用。
综上所述,XN可以通过抑制TLR4表达进而下调IκBα及NF-κB的磷酸化,降低NF-κB的活化,抑制SAH后的神经炎症反应,减轻神经损伤,起到保护神经的作用。本研究存在一定的局限性,首先,SAH后的各种脑损伤机制并非相互独立,而是同时发生,且可以相互作用,而本研究仅分析炎症这一独立因素,有一定的局限性;同时,XN是否可以通过其他通路起到缓解炎症反应的作用还需进一步的研究。
