基于探针技术的广义加标校正策略用于复杂体系中ATP的定量检测
2021-09-18李旻熹陈增萍
李旻熹 陈增萍
湖南大学
化学化工学院
化学生物传感与计量学
国家重点实验室
湖南 长沙 410082
1 研究背景
三磷酸腺苷(adenosine triphosphate,ATP)是一种高能磷酸化合物,作为生物体中化学能的主要载体,在调节细胞代谢、细胞内信号的传递和各种生理生化过程中都具有至关重要的作用[1-2]。已有报道表明,许多人体疾病如低血糖、缺氧、贫血、神经再生紊乱、恶性肿瘤等与ATP的异常代谢有关[3-4]。因此,准确检测生物样本中ATP的含量在生化研究和临床诊断中具有重要意义。
核酸适配体(aptamer)是对目标物具有特异性识别能力的单链DNA或RNA。目标可以是小分子、蛋白质、病毒、细胞等[5-7]。由于适配体具有良好的选择性和稳定性,目前已经发展了多种基于适配体的ATP检测方法,如:化学比色法[8]、电化学法[9]、化学发光法[10]、荧光光谱法[11-13]等。其中,利用荧光光谱法对生物体系中ATP进行定量检测,充分结合了适配体特异性识别能力和荧光光谱灵敏度高、操作简单、快速的优点[14]。
荧光光谱法,通常是根据标准样本的光谱数据,以特定波长下的光谱强度对目标物浓度建立单变量模型,从而对待测样本中目标物浓度进行定量分析。而在实际待测体系中(如细胞液、血浆等),由于组成成分较为复杂,普遍存在背景干扰和基质效应。背景干扰可以通过减去待测样本中空白溶液的光谱贡献[15]或将标准样本和待测样本的光谱投影到与待测样本背景光谱所张成空间的正交补空间[16]上进行消除。此外,对样本进行适当预处理,可以一定程度上缓解因基质不同导致的光谱强度与目标物浓度之间严重偏离单变量校正模型的问题; 但繁琐耗时的处理过程,在一定程度上会抵消荧光检测分析快速的优势。分析化学领域通常采用经典标准加入法进行处理[17]。广义标准加入法(generalized multivariate standard addition method,GSAM),在响应值和被分析物浓度间建立多项式关系模型:
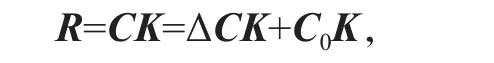
式中R、K、C、ΔC和C0分别为响应值矩阵、系数矩阵、浓度矩阵、标准加入矩阵和未知浓度矩阵。
利用多次线性回归,可以同时进行多组分分析求解[18-19]。标准加入法通常与单变量或多变量校正模型结合使用[20-21],其要求被测样本不包含具有光谱响应的背景干扰或具有和待测样本相同的基质成分但不含目标物的空白溶液。然而以上两点在实际检测过程中通常很难达到。因此采用经典标准加入法与单变量模型相结合的方法,对实际待测样本中目标物进行定量分析可能产生明显误差。此外,经典标准加入法通常需要4个以上加标样本,限制了对微量样本的定量分析。本文通过荧光标记的ATP适配体探针,结合基于探针技术的广义标准加入多元校正策略[22],解决复杂体系对荧光信号的干扰问题,从而实现对复杂体系中ATP的快速准确定量分析。
2 检测原理与方法
2.1 检测原理
基于探针技术的ATP检测原理如图1所示。实验中使用的DNA序列分别为3末端标记6-羧基荧光素(6-carboxy-fluorescein,FAM)的探针序列ATP-F和5末端标记黑洞猝灭基团(black hole quencher 1,BHQ1)的ATP-Q。其中,ATP-F为ATP适配体,从3端开始与ATP-Q部分互补。
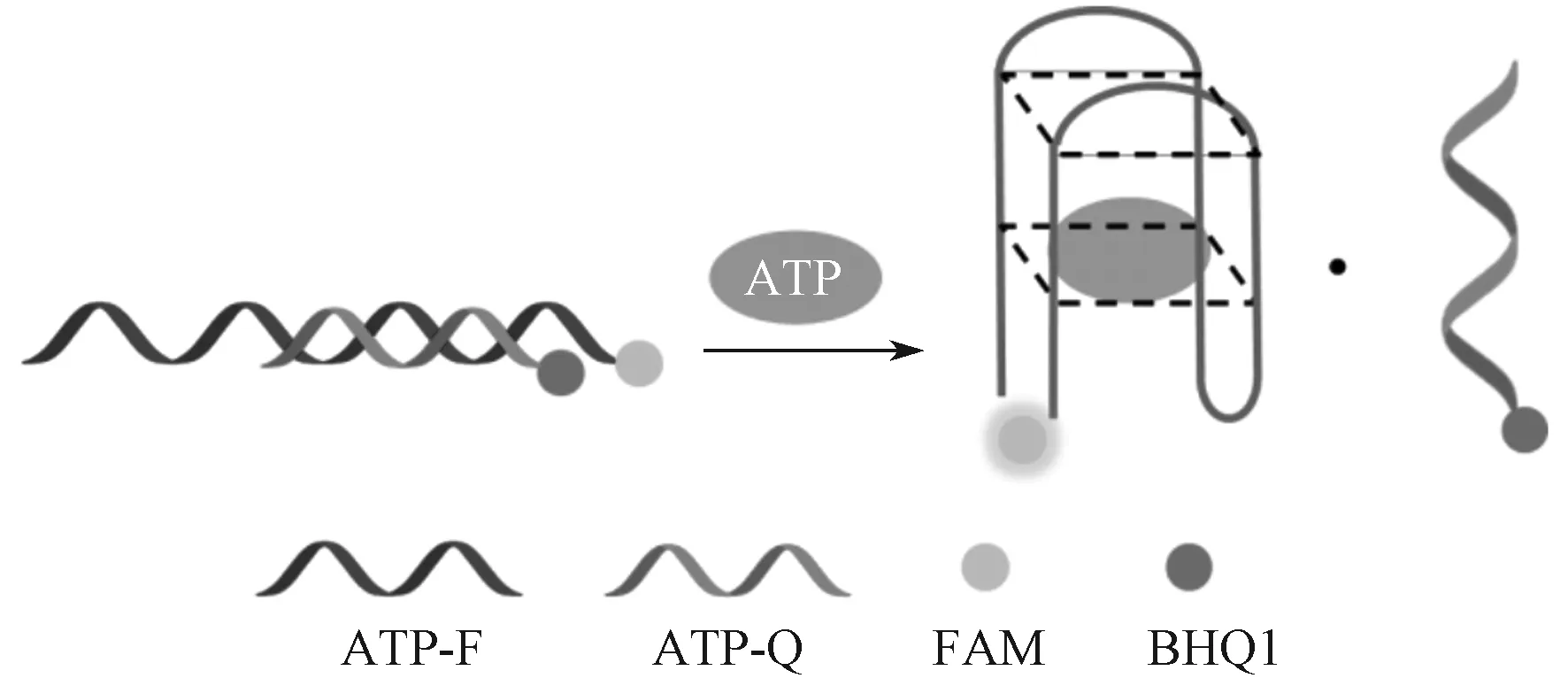
图1 基于探针技术的ATP检测原理示意图Fig. 1 Schematic diagram for the detection of ATP based on probe technique
反应体系中未加入ATP时,两条DNA杂交形成双链结构,FAM的荧光信号被BHQ1猝灭。当加入ATP反应时,ATP与ATP-F结合,使双链结构发生解离,FAM的荧光信号得到恢复。
2.2 数据分析方法
为了准确测定实际样本中ATP的含量,以标准样本的荧光光谱建立了GSAMprobe模型。通过加标样本的最小平均绝对百分比误差(mean absolute percentage error,MAPE)来优化并确定针对细胞裂解液和血清样本的GSAMprobe模型参数。GSAMprobe的详细说明如下。
假设xi(i=1, 2, …, N) 是第i个标准样本的荧光光谱响应,它可以表示为ATP探针序列(ATP-F)3末端标记的FAM荧光基团的信号与背景信号的线性组合,即
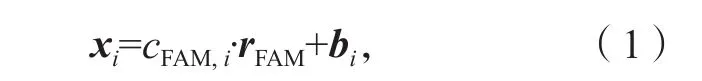
式中:cFAM,i为第i个样本中FAM的浓度;
rFAM为单位浓度的FAM荧光响应;
bi为反应溶液中可能存在的背景干扰,bi对所有样本都是恒定的。
当目标物质ATP的浓度越高时,会与越多的探针序列形成复合物,破坏原本与互补序列(ATP-Q)形成的双链结构,使FAM荧光信号得到恢复。因此,第i个样本中FAM的浓度cFAM,i与ATP的浓度cATP,i之间存在线性关系,可以表示为
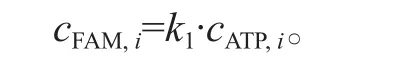
因此,可以将式(1)改写为
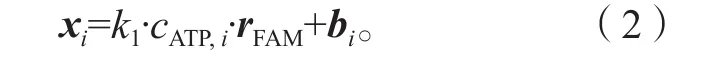
实际待测样本和它的加标样本可类似地表示为
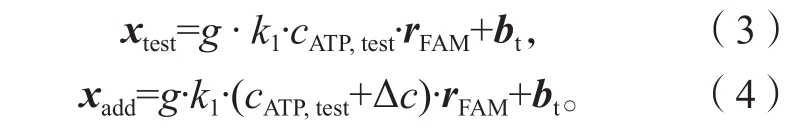
式(3)~(4)中:xtest为实际待测样本荧光光谱响应;
xadd为标准加入样本荧光光谱响应;
g为由于基质效应引起的荧光信号差异的参数;
cATP,test为实际待测样本中ATP的浓度;
Δc为添加到加标样本中的ATP标准溶液浓度;
bt为待测样本的背景干扰。
待测样本和标准样本背景干扰的差异,可以通过将xi和xtest投影到bt所张成空间的正交互补空间来缩小。
通过偏最小二乘法(partial least-square method,PLS),在变换后的xi上建立多元校正模型[23]。待测样本的PLS模型对ATP浓度的预测结果可以表示为

式中e0为待测样本PLS模型的预测误差。
加标样本PLS模型的预测浓度为

式中ei为加标样本PLS模型的预测误差。

3 实验
3.1 实验试剂与药品
核酸探针由大连宝生物工程有限公司合成,采用高效液相色谱(high performance liquid chromatography,HPLC)纯化方式,具体序列为(ATP-F:5’-AACCTGGGGGAGTATTGCGGAGGAAGGTFAM-3’,ATP-Q: 5’-BHQ1-ACCTTCCTCCGCAA-3’)。ATP溶液、三磷酸鸟苷(guanosine-5’-triphosphate,GTP)溶液、三磷酸胞苷(cytidine-5’-triphosphate,CTP)溶液、三磷酸尿苷(uridine-5’-triphosphate,UTP)溶液,浓度均为100 mmol/L,购于上海生工生物工程股份有限公司。三羟基甲基氨基甲烷(Tris,纯度为99.9%)、氯化钠(NaCl)、氯化镁(MgCl2)、盐酸(HCl),均购于上海阿拉丁生化科技股份有限公司。健康人血清购于长沙血站中心。肝癌细胞(HepG2)按常规方法培养。实验中未特别说明的试剂纯度均为分析纯。所有试剂无需进一步纯化,实验用水均为灭菌水。
3.2 实验仪器及参数设置
pH计,PHS-3C型,上海仪电科学仪器有限公司。
圆二色光谱仪,MOS-500型,法国Bio-Logic公司。圆二色测试条件设置:光谱狭缝宽度为5 nm,扫描波长范围为210~320 nm,光谱扫描速度为300 nm/min,间隔0.5 nm记录一个数据点,使用石英比色皿(10 mm,3.5 mL),缓冲溶液的背景从圆二色光谱中扣除。
荧光分光光度计,F-7000型,日本Hitachi公司。荧光测试参数设置:光电倍增管(photomultiplier tube,PMT)电压为900 V,激发和发射的狭缝宽度均为5 nm,激发波长为480 nm,发射波长范围为500~650 nm,光谱扫描速度为240 nm/min,间隔1 nm记录一个数据点。
3.3 实验过程
1)细胞裂解液制备。选胰酶消化密度为105~106mL-1的细胞,加入3 mL的生理盐水,移液器吹打混匀后1 000 r/min离心5 min收集细胞;用3 mL的生理盐水漂洗一次,再次1 000 r/min离心5 min收集细胞;上清液弃去,加入200 μL超纯水裂解细胞,冻存于-80 ℃冰箱。待完全解冻后,细胞将全部裂解。
2)模拟实际样本制备。将细胞裂解液和血清分别稀释100倍,向其中添加ATP母液,模拟样本中ATP最终浓度为 200 μmol/L。
3)标准样本制备。将ATP-F和ATP-Q分别加入适量灭菌水溶解,配制成浓度为1 μmol/L的工作液。将浓度为100 mmol/L的ATP母液加入适量灭菌水,配制成 200 μmol/L 的 ATP 工作液。将 10 μL ATP-F工作液、20 μL ATP-Q 工作液 、20 μL Tris-HCl缓冲液(200 mmol/L Tris,1.5 mol/L NaCl,50 mmol/L MgCl2,pH值为7.2)、不同体积ATP 工作液充分混匀,并加灭菌水定容至200 μL,于37 ℃ 水浴反应2 h。最终标准样本浓度分别为0, 5, 10, 15, 20, 30, 35, 40,45, 50, 55, 60, 65 μmol/L。
4)实际样本配制。将10 μL ATP-F工作液、20 μL ATP-Q工作液、20 μL Tris-HCl缓冲液、不同体积ATP 工作液、20 μL HepG2细胞裂解液或血清模拟样本,充分混匀并加灭菌水定容至200 μL,于37 ℃ 水浴反应2 h。细胞样本和血清样本中添加的ATP最终浓度分别为 10, 30 μmol/L。
4 结果与讨论
4.1 实验可行性
通过荧光光谱和圆二色光谱,对实验的可行性分别进行了验证。不同溶液的荧光光谱和圆二色光谱分别如图2和图3所示。
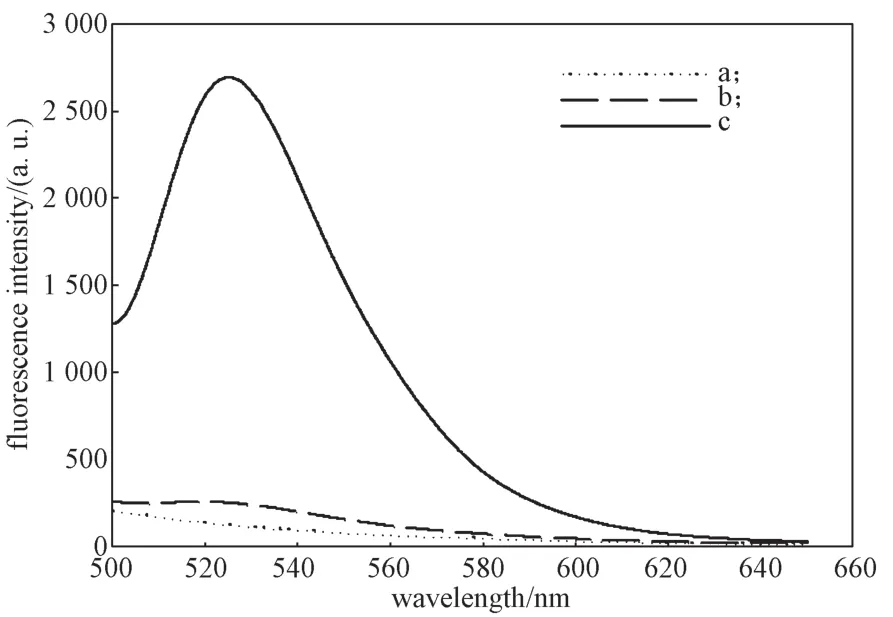
图2 不同溶液的荧光光谱Fig. 2 Fluorescence emission spectra of different mixtures
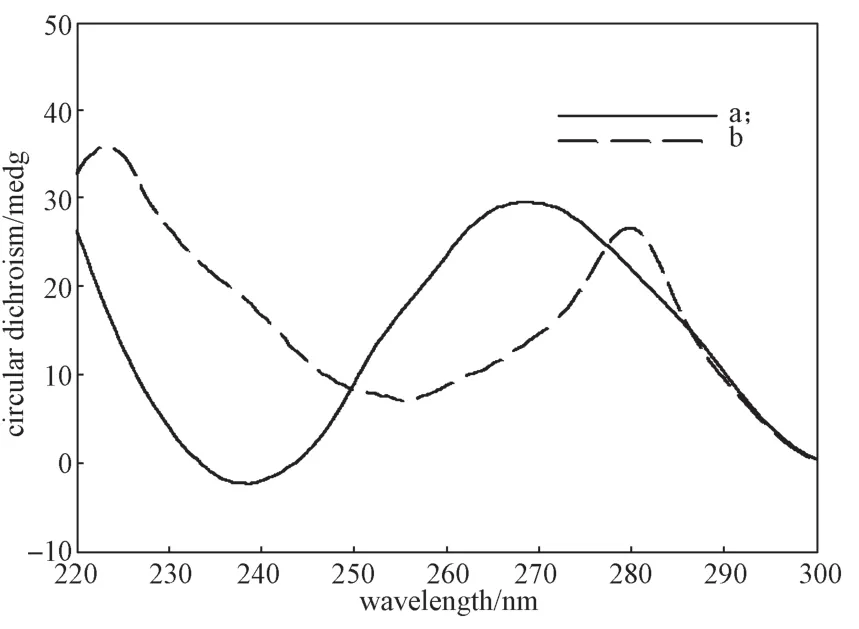
图3 不同溶液的圆二色光谱Fig. 3 Circular dichroism spectra of different mixtures
从图2的荧光光谱图中可以看出,反应体系中未加入ATP反应时,520 nm处未发现明显的荧光信号,与缓冲溶液的背景信号基本一致,说明FAM的荧光信号被BHQ1完全猝灭。当加入ATP反应时,520 nm处有明显的荧光信号,说明ATP与适配体结合破坏了双链结构的稳定性,使FAM的荧光信号得到恢复。图3中的圆二色光谱也进一步验证了上述结论。
从图3的圆二色光谱图可看出,反应体系中未加入ATP反应时,在243 nm和276 nm处获得很强的圆二色吸收峰,这是DNA双链的特征峰。加入ATP反应后,光谱形状发生了改变,圆二色吸收峰迁移至258 nm和281 nm处。根据文献[24]报道,这是由于ATP和适配体作用后,导致适配体形成反平行G-四联体结构的特征峰。这表明ATP可以与互补链ATP-Q竞争结合适配体ATP-F用于ATP浓度的检测。
4.2 DNA杂交比例优化
ATP-F和ATP-Q的杂交比例对ATP的检测性能有很大影响。ATP-Q对ATP-F的杂交比值过小,会导致FAM信号猝灭不完全,使得背景信号增大;反之比值过大,会影响ATP与适配体的结合。实验中,固定ATP-F浓度为50 nmol/L和不同浓度的ATP-Q杂交,记录加入ATP(1 mmol/L)反应后,荧光信号强度(F)与空白样本荧光信号强度(F0)的比值,结果如图4所示。
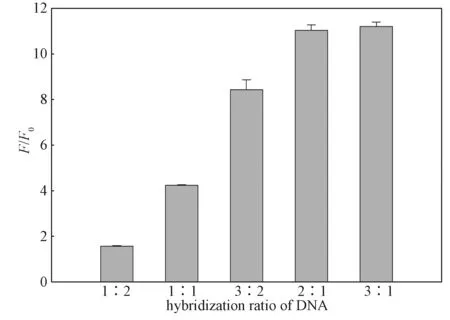
图4 荧光强度比值与DNA杂交浓度比的关系Fig. 4 Relationship between fluorescence intensity ratio and DNA hybridization ratio
由图4可知,当ATP-Q和ATP-F杂交浓度比为2:1时,荧光信号比值达到较大值,且当杂交浓度比继续增大,信号比变化趋于平衡。因此,最终选择ATP-Q和ATP-F杂交浓度比为2:1。
4.3 反应时间优化
在ATP-F浓度为50 nmol/L和ATP-Q浓度为100 nmol/L的5个平行样本中,均加入浓度为1 mmol/L的ATP分别反应不同时间,并记录反应后荧光信号强度(F)与空白样本荧光信号强度(F0)的比值,结果如图5所示。由图5可知,当反应时间为2 h时,荧光信号强度比值最大,因此最终选择2 h作为与ATP的反应时间。
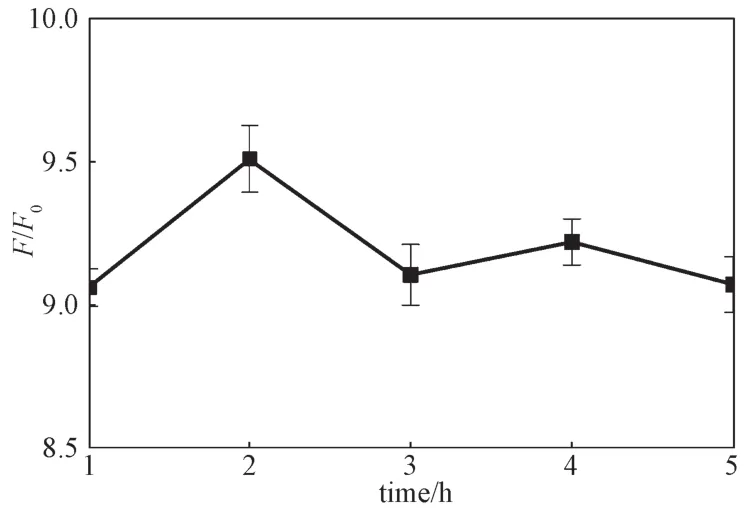
图5 荧光强度比值与反应时间的关系Fig. 5 The relationship between fluorescence intensity ratio and reaction time
4.4 反应体系对ATP的选择性
为了验证实验反应体系对ATP的选择性,选择了3种常见的ATP类似物(CTP、GTP、UTP)以及类似物与ATP的混合物代替ATP加入到反应体系中。通过比较反应后荧光信号强度(F)与空白样本荧光信号强度(F0)的比值变化,判断反应体系对ATP的选择性,结果如图6所示。
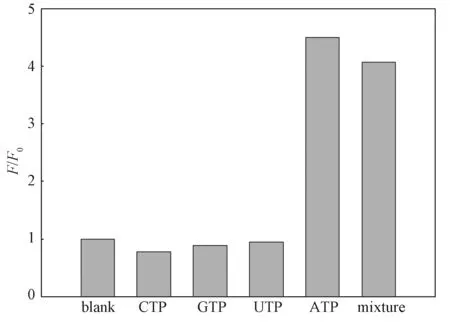
图6 不同溶液反应前后荧光强度比值对比Fig. 6 Comparison of fluorescence intensity ratio before and after the reaction of different solutions
由图6可知,添加ATP类似物(浓度为500 μmol/L)不会引起明显的光谱强度变化,和空白样本的荧光信号强度比值基本一致。添加ATP(浓度为50 μmol/L)能使反应前后的荧光比值发生明显变化,类似物与ATP的混合物同样能引起荧光比的变化,并且比值基本与ATP相同,说明类似物对反应体系不会造成显著干扰。这说明该反应体系对ATP具有良好的选择能力。
4.5 F/F0随ATP浓度线性变化的范围
在反应体系中改变ATP的浓度,考察加入ATP和未加入ATP反应时荧光信号强度的比值(F/F0)与ATP浓度的关系,结果如图7所示。由图7可知,在ATP浓度为0~100 μmol/L的范围内,F/F0随ATP浓度的增大而逐渐增大;ATP的浓度进一步增大至100~200 μmol/L范围时,F/F0趋于平稳,没有明显改变。如插图所示,在5~65 μmol/L的浓度范围内,F/F0与ATP的的浓度具有良好的线性关系,相关系数为R2=0.987。
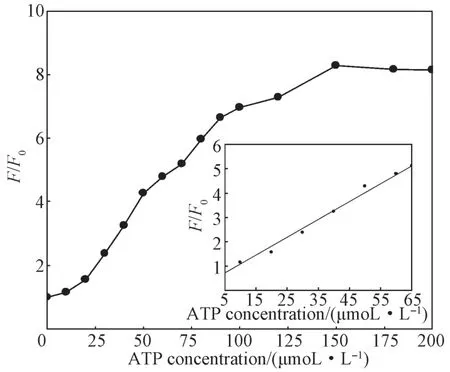
图7 荧光信号强度比与ATP浓度的关系Fig. 7 The relationship between fluorescence intensity ratio and ATP concentration
4.6 实际样本中ATP的定量分析
用传统单变量模型、偏最小二乘法(PLS)和GSAMprobe模型,对HepG2细胞裂解液和血浆样本进行检测,结果如表1~2所示。
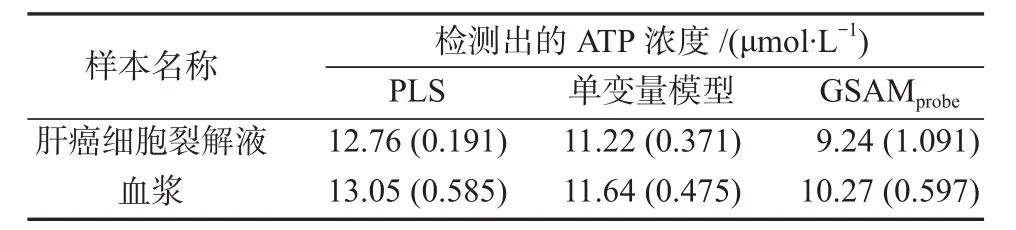
表1 使用1个标准加入样本时3种方法的检测结果Table 1 Quantitative results of 3 methods when using 1 standard addition sample
由表1可知,由于细胞裂解液和血浆会对光谱信号强度产生干扰,PLS和传统单变量模型的预测结果与实际含量存在明显偏差;相比之下,仅使用1个标准加入样本的GSAMprobe模型,能准确预测细胞液和血浆样本中ATP的浓度,定量分析结果优于其他两种方法。
对比表1和表2的结果可知,增加标准加入样本的数量,能适当提高GSAMprobe模型定量检测结果的准确性;但1个标准加入样本足以使GSAMprobe模型提供令人满意的定量分析结果,这对于检测微小体积或珍惜样本很有意义。
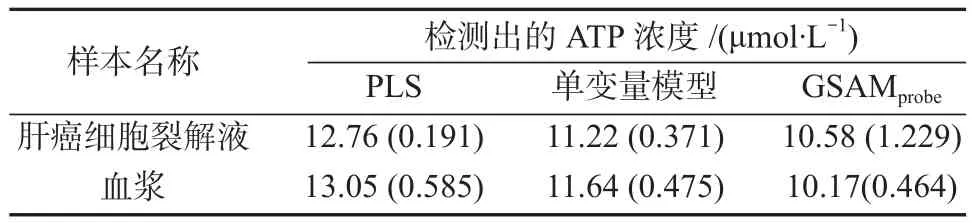
表2 使用2个标准加入样本时3种方法的检测结果Table 2 Quantitative results of 3 methods when using 2 standard addition samples
5 结语
用光化学生物传感技术对复杂样本中目标物进行定量分析时,由于样本组成成分通常较为复杂,光谱信号容易受到样本中未知物质的干扰,从而对定量检测结果的准确性造成影响。本文利用基于探针技术的广义标准加入多元校正策略,结合荧光标记的ATP探针,以细胞裂解液和血浆为复杂样本模拟体系,对其中的ATP进行定量分析。实验结果表明,1个标准加入样本足以解决复杂实际样本对荧光信号造成干扰的问题,且能对实际样本中ATP的浓度进行准确定量。同时,相较于传统标准加入法,该方法所需的待测样本体积更小。因此,该校正策略有望应用于其他微量复杂样本或珍惜样本中目标物的快速、准确地定量分析。
