奈达铂对肿瘤患者骨髓巨核细胞及血小板相关凋亡蛋白 影响的研究
2021-09-16韩忠丽于柏清李和义卜梦昕张晓杰王武龙
韩忠丽,于柏清,李和义,卜梦昕,张晓杰,王武龙
(包头医学院第二附属医院 肿瘤科,内蒙古 包头 014030)
0 引言
奈达铂(Nedaplatin)是目前第二代铂类化合物,具有类似于顺铂的抗实体瘤活性,相比传统的顺铂类药物,其肾脏毒性和胃肠道反应均更低,且无需水化,操作便捷[1]。但其仍属于化疗药物,所产生的不良反应仍然存在,其中血小板下降(Chemotherapy Induced Thrombocytopenia,CIT)在奈达铂化疗中较为常见,究竟奈达铂对恶性肿瘤患者巨核细胞与血小板的体内抑制作用至今未见任何报道,而本课题组前期的研究表明奈达铂显示出很强的抗肿瘤效果[2]。因此,本研究拟从骨髓巨核细胞及外周血血小板两个研究层面检测奈达铂对肿瘤患者骨髓巨核细胞及血小板相关凋亡情况,初步明确奈达铂对恶性肿瘤患者血小板下降的细胞凋亡机制,同时也有助于开发出新的策略来有效防止血小板下降的发生,也指导临床探究更加适宜、简便的预测血小板下降发生的预测因素而应用于临床。
1 资料与方法
1.1 一般资料
选取包头医学院第二附属医院2020年1月至2020年6月使用奈达铂化疗后第7~14d,并发生Ⅱ至Ⅲ度血小板抑制的恶性肿瘤患者30例作为研究对象,纳入研究组,其中男20例,女10例;年龄35~75岁,平均(56.48±5.32)岁;病程1~5年,平均(3.12±0.68)年。另选取同期健康人群30例,纳入对照组,其中男16例,女14例;年龄35~75岁,平均(56.48±5.32)岁;病程1~5年,平均(3.12±0.68)年。两组患者一般资料对比,差异无统计学意义(P>0.05),具有可比性。纳入标准:①均与相关恶性肿瘤的诊断标准相符[3]。②接受奈达铂化疗后出现血小板抑制;③具备正常的认知能力,可配合完成此次研究。④均取得研究对象知情同意。排除标准:拒绝或者无法配合此次研究者。
1.2 方法
1.2.1 主要试剂与仪器
注射用奈达铂(齐鲁制药有限公司 国药准字H20050563);Partec PAS流式细胞仪(德国PARTEC公司),Stat Fax 2100酶标仪(美国Awareness公司);caspase -3抗体和caspase-9抗体(美国CST公司),β-actin抗体和β-tubulin抗体(北京博奥森公司),Protein A/G PLUS-Agarose (美国SANTA CRUZ公司),HRP标记的山羊抗鼠IgG(北京中杉金桥公司)和HRP标记的山羊抗兔IgG(北京中杉金桥公司),ECL显影试剂盒(美国Milipore公司),PVDF膜(美国Milipore公司),ANA(美国sigma公司)。
1.2.2 检测方法
流式细胞仪检测PS膜外表达。ELISA检测可溶性P-选择素的释放,Western biot检测Caspase-3和Caspase-9的表达以及免疫共沉淀分析Bci-XL和Bak蛋白的相互作用。
1.3 统计学处理
全文数据使用SPSS 19.0软件计算,所有统计检验均符合正态分布。计量资料将采用“均数±标准差”,计数资料以率(%)表示,根据资料类型,行描述性统计分析、两个独立样本t检验,多个样本采用F检验,以P<0.05为差异有统计学意义。
2 结果
2.1 奈达铂对Caspase-3和Caspase-9的表达影响
研究组PS膜外表达阳性率及可溶性P选择素均低于对照组,差异有统计学意义(P<0.05),见表1。
表1 奈达铂对 Caspase-3和Caspase-9的表达影响(±s)
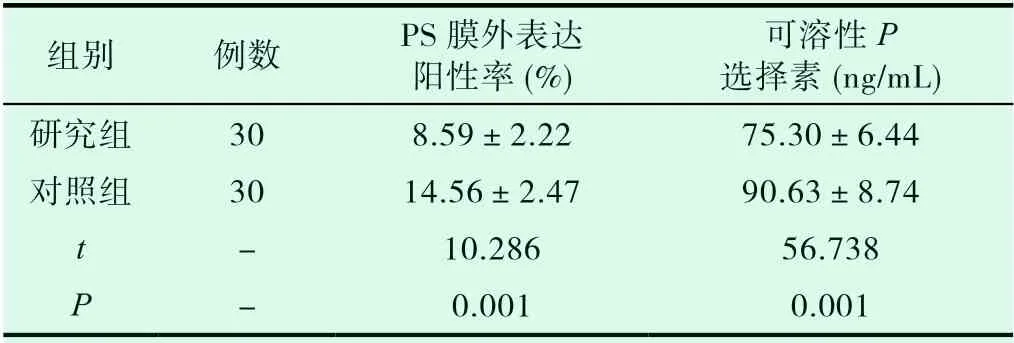
表1 奈达铂对 Caspase-3和Caspase-9的表达影响(±s)
可溶性P 选择素(ng/mL)研究组 30 8.59±2.22 75.30±6.44对照组 30 14.56±2.47 90.63±8.74 t - 10.286 56.738 P - 0.001 0.001组别 例数 PS膜外表达 阳性率(%)
2.2 免疫共沉淀检测
在血小板裂解液中不加BCL-XL抗体为阴性对照然后进行共沉淀实验。Western blot杂交后没有发现BCL-XL和Bak条带,保存7d的血小板,研究组中BCL-XL和Bak蛋白的结合量较高,约为对照组的2.6倍,与对照组相比差异有统计学意义(t=16.89,P<0.05),见图1。

图1 免疫共沉淀检测
2.3 奈达铂对 Caspase-3和Caspase-9的表达影响
保存7d的血小板,研究组中Caspase-3、caspase-9活性形式占总量的百分比均明显小于对照组,差异有统计学意义(P<0.05),见表2。

表2 奈达铂对 Caspase-3和Caspase-9的表达影响
3 讨论
我国居民主要死亡原因之一为恶性肿瘤,俨然成为危害国民生命健康、制约社会经济发展重大疾病之一[4]。而化疗是恶性肿瘤治疗中不可替代的治疗手段之一,而铂类药物则作为临床不可或缺的化疗药物在基础科研与临床应用中发挥着重要的作用。自1965年Rosenberg发现第一代铂类药物顺铂(Cisplatin)以来,铂类药物的基础研发和临床应用研究发展迅速,目前已经有顺铂、卡铂(Carboplatin)、奥沙利铂(Oxaliplatin)、奈达铂(Nedaplatin)和洛铂(Lobaplatin)等药物被广泛临床应用[5]。铂类药物自临床应用以来,其治疗的不良反应也一直是临床关注的重点和热点,尤其是卡铂、奈达铂和洛铂所致的CIT尤为显著,已经成为限制铂类药物临床应用的主要原因。临床上对于CIT的处理主要包括:减少铂类药物的使用剂量和(或)延迟化疗的进程,血小板悬液的输注以及各种促血小板生长的生物学因子,如rhIL-11、rhTPO、SCF的应用[6]。这些方法均存在着各自不同的不良反应和高昂的价格,这些均极大地限制了其临床使用。因此,基础与临床医务人员均渴望探寻出CIT的发生机制,并寻求更加适宜、简便的预测CIT发生的预测因素而服务于临床。
研究认为[7],铂类药物中的铂原子与DNA结合形成的不同结构的化合物是铂类药物产生生物学效应的主要因素,这些结构、亲和力不同的化合物也是铂类药物产生毒副反应的主要原因,在骨髓抑制发生的任何环节,血小板的生成和成熟都可能会受到明显的抑制。铂类药物在诱导细胞DNA损伤时可以激活多种细胞凋亡的信号传导途径,这样,如果传导途径被异常激活或者被抑制的时候,就会产生相应的生物学效应。包括巨核细胞在内的骨髓中的多种细胞也会受到影响。研究表明,Bcl-xL蛋白对于巨核细胞的存活具有非常重要的作用,在肿瘤患者化疗后,由于促凋亡蛋白Bax和Bak被活化,包括巨核细胞在内的骨髓中多种细胞会受到影响,因此,化疗对血小板和巨核细胞的毒性与其血小板数量减少相关。Benjamin T. Kile研究发现,CIT与Bcl-2家族蛋白相关,Bcl-2家族凋亡蛋白会促进细胞死亡,而一些蛋白则促使细胞存活。这一研究可能会颠覆传统的认为巨核细胞发生类似细胞死亡的过程后才形成血小板的理论。由此研究提示,血小板并不是由巨核细胞发生类似细胞死亡后形成的。巨核细胞形成血小板这一过程中,Bcl-2家族中促凋亡蛋白并非关键蛋白。化疗通过激活Bcl-2家族蛋白来影响巨核细胞,从而影响了化疗期间血小板的生成数量和功能。由此证实了此效应与Bcl-2蛋白在血小板形成过程中的作用,以及对CIT作用的影响[8]。
综上所述,奈达铂对恶性肿瘤患者血小板下降的细胞凋亡机制与Caspase-3、caspase-9活性形式减少有关,同时受BCL-XL和Bak蛋白结合量升高的影响。
