系统性红斑狼疮患者全血中羟氯喹及其代谢产物浓度 与疾病活动度的关系
2021-09-16潘梦璐帅宗文
潘梦璐,帅宗文
(安徽医科大学第一附属医院风湿免疫科,安徽 合肥 230022)
0 引言
羟氯喹(hydroxychloroquine,HCQ)是一种抗疟药,因其安全性较好,目前已经作为一线用药在系统性红斑狼疮(systemic lupus erythematosus,SLE)患者中广泛应用[1]。有研究表明,HCQ血药浓度与SLE患者的疾病活动度相关,并将HCQ血药浓度>500ng/mL作为药物有效的临界点[2]。但即使是服用相同剂量HCQ的患者,其血药浓度的差异也较大,我们推测,可能与其代谢有关。研究表明,30%-60%的HCQ在口服后经肝脏分解代谢,形成三种主要代谢产物,分别为去乙基羟氯喹(desethylhydroxychloroquine,DHCQ)、去乙基氯喹(desethylchloroquine,DCQ)和双去乙基氯喹(bisdesethylchloroquine,BDCQ)[3]。DHCQ血药浓度与疗效具有一定的相关性,然而,关于另外2种代谢产物与疗效的关系尚不明确。因此,本研究将探讨服用HCQ≥6月的SLE患者全血中HCQ及其3种代谢产物浓度与SLE疾病活动指数(SLE disease activity index,SLEDAI)之间的关系。
1 对象与方法
1.1 临床资料
收集2017年6月至2019年6月在安徽医科大学第一附属医院门诊就诊并规律服用HCQ至少6月的SLE患者148例,所有患者符合美国风湿病学会1997年修订的SLE分类标准[4],排除合并有其他结缔组织病者。收集患者的临床资料包括性别、年龄、病程、体重、羟氯喹的用量及疗程、不良反应、合并用药情况等,评估患者的SLEDAI评分[5]。所有患者均知情同意。本研究获得安徽医科大学第一附属医院伦理委员会批准。
1.2 HCQ及其代谢产物浓度的检测
使用EDTA抗凝管留取入选者的全血2mL,采用高效液相色谱-质谱联用法(HPLC-MS/MS)检测HCQ及其代谢产物浓度。
1.3 统计学处理
所得的数据采用SPSS 22.0软件包进行分析。计数资料间比较使用卡方检验;正态分布的计量资料以(±s)表示,非正态分布的计量资料以M(P25,P75)表示,两组间比较使用Mann-Whitney U检验。相关性分析使用Spearman法。P<0.05为差异有统计学意义。
2 结果
2.1 入选者特点
共纳入SLE患者148例,女性136(91.9%)例,男性12(8.1%)例,年龄14~74岁,平均(37±12)岁,病程6~474月,平均(83±74)月,使用HCQ的日剂量为100mg/天、200mg/天、300mg/天、400mg/天 的 患 者 分 别 为3(2%)例、46(31.1%)例、70(47.3%)例、29(19.6%)例。使用强的松剂量0~30mg/天,平均(5.34±4.47)mg/天,合并使用免疫抑制剂类型及剂量见表1。所测HCQ血药浓度为39.68~1936.46ng/mL,平均(606.75±345.13)ng/mL,DHCQ血药浓度为22.47~1017.73ng/mL,平均(367.74±206.06)ng/mL,DCQ血药浓度为8.88~551.48ng/mL,平均(70.69±77.07)ng/mL,BDCQ血药浓度为2.81~90.98ng/mL,平均(28.04±18.78)ng/mL,SLEDAI为0~14分,平均(2.28±2.35)分。根据患者所测HCQ血药浓度,结合既往研究报道[2,6],将所有患者分为低浓度组(HCQ血药浓度≤500ng/mL)和高浓度组(HCQ血药浓度>500ng/mL)。两组间性别、年龄、合并用药等情况差异均无统计学意义(P>0.05)。

表1 入选患者免疫抑制剂使用情况
2.2 2组患者间疾病活动度、HCQ使用剂量及疗程比较
本研究纳入的患者服用羟氯喹剂量为100~400mg/天,平均(284.46±75.33)mg/天。高浓度组患者的羟氯喹使用剂量显著高于低浓度组,其疗程及SLEDAI评分显著低于低浓度组,差异具有统计学意义(P<0.05),见表2。

表2 2组受试者间羟氯喹使用剂量及疗程比较
2.3 SLEDAI与HCQ及其代谢产物血药浓度间相关性分析
使用Spearman相关分析显示:SLE患者的SLEDAI分别与全血中HCQ、DHCQ、DCQ和BDCQ的血药浓度呈显著正相关(P<0.05),与年龄、病程、疗程、日剂量无关(P>0.05),见表3。
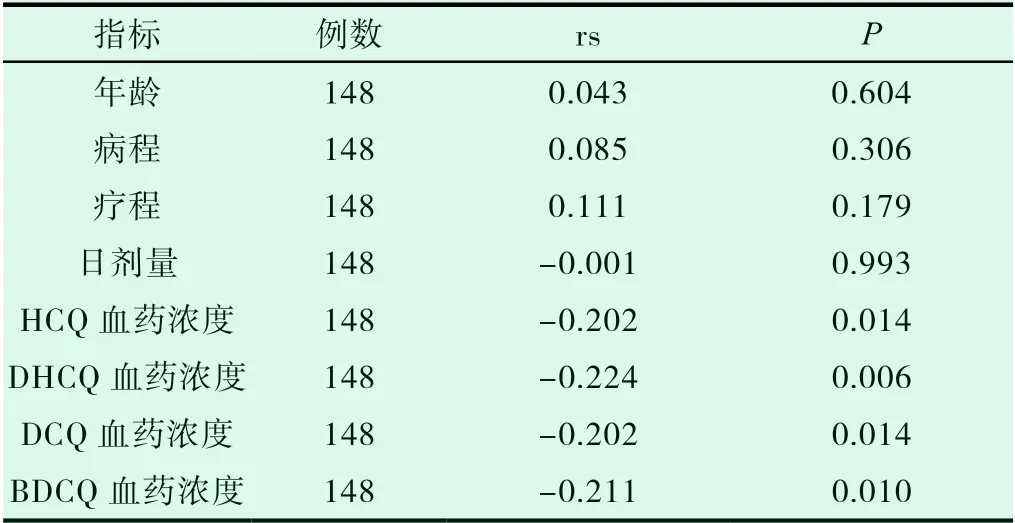
表3 各观察指标与SLEDAI的相关性分析结果
3 讨论
HCQ血药浓度是检测患者依从性的重要指标之一。Durcan等[2]认为HCQ血药浓度小于15ng/mL为依从性差的表现。在本研究中,全血中HCQ的浓度范围为39.68~1936.46ng/mL,没有浓度低于15ng/mL的患者,因此在本研究中所选择的病例均为依从性良好的患者,从而进一步分析不同HCQ血药浓度的患者间临床疾病活动度有无差别。
已有多项研究证明,HCQ血药浓度与疾病活动度相关。一项纳入276例中国人的纵向队列研究使用HPLC-MS/MS法检测了服用HCQ≥6月的SLE患者HCQ血药浓度,发现浓度范围在10~500ng/mL的患者占主要部分,同时患者服用HCQ的剂量越大,其HCQ血药浓度越高,而具有较高浓度的患者疾病活动的可能性较小[6]。本研究与上述研究采用了相同HCQ浓度的检测方法,同样发现高浓度组的患者服用HCQ的日剂量高于低浓度组,但相反的是,高浓度组的患者数量多于低浓度组。本研究与上述研究的差异可能是由于本研究样本量的数量偏少,且我们所纳入的患者HCQ日剂量大多数(47.3%)为300mg/天,而上述研究所纳入的主要(58.3%)为HCQ日剂量为200mg/天的患者。此外我们的研究还发现,在2组患者中服用HCQ的疗程也有差别,具有较低HCQ血药浓度的患者,服用HCQ的疗程较长,结合我们所纳入的患者主要为稳定期的患者,考虑除个体差异、服药剂量外,疗程越长的患者较难完全遵医嘱进行治疗,因此对于影响HCQ血药浓度的因素,未来还需要进一步研究。与上述研究类似的是,在另一项横断面调查的研究中同样发现,较低的HCQ血药浓度是影响SLE患者高疾病活动度的独立因素[7]。我们的研究中所纳入的2组患者合并使用激素及免疫抑制剂的剂量差异无统计学意义,考虑两组合并用药对于HCQ浓度及疾病活动度的影响无差异。我们发现,SLE患者全血中HCQ浓度与SLEDAI评分呈显著负相关,具有较高HCQ血药浓度的患者其SLEDAI评分显著降低,该结果与上述研究一致。因此,在临床工作中检测患者的HCQ血药浓度,除了可以评估患者的依从性,还可以帮助临床医生评估疾病活动情况并及时对药物的使用剂量进行调整。
在本研究中也发现,服用相同剂量HCQ的患者间其浓度及疾病活动度存在较大差异,正如前文所述,我们考虑HCQ的三种代谢产物也参与影响SLE患者的临床疾病活动性。虽然现在已经有研究表明HCQ的代谢产物与疗效有相关性,但主要集中在其主要代谢产物DHCQ与疗效间的关系,可能与既往采用的检测方法多为高效色谱法,检测范围较小,而全血中DCQ、BDCQ的浓度较低有关。Munster等[8]人发现,RA患者服用HCQ的疗效与DHCQ血药浓度呈正相关。而在SLE患者中,Yeon等[9]检测了血清HCQ、DHCQ血清药物浓度,发现二者密切相关,同时,DHCQ血药浓度越高,SLEDAI评分越低。在我们的研究中,我们使用了LC-MS/MS方法,同时检测全血中HCQ及其代谢产物浓度,既往的文献中,已经验证了该方法的可靠性[10,11]。在本研究中,HCQ的三种代谢产物浓度均与SLE患者的临床疾病活动度负相关,提示这3种物质可能均对SLE患者的疾病活动度具有一定的影响。
综上所述,本研究提示在SLE患者中,全血中HCQ浓度>500ng/mL的患者具有更低的疾病活动度,此外,全血中DHCQ、DCQ和BDCQ浓度也影响SLE患者的疾病活动度。
