Y染色体性别决定区相关高迁移率组盒蛋白1联合电压门控钙通道抗体阳性的副肿瘤综合征1例报告并文献复习
2021-09-16于莹陈志聪路名芝张娜蔡萍萍王君梅张慜
于莹,陈志聪,路名芝,张娜,蔡萍萍,王君梅,张慜
副肿瘤综合征(PNS)是肿瘤细胞通过远隔效应攻击神经系统而引起的一系列综合征。Y染色体性别决定区相关高迁移率组盒蛋白1(SOX1)是抗胶质细胞核抗体阳性血清识别的抗原,常见于伴有和不伴PNS的小细胞肺癌(SCLC)。电压门控钙通道(VGCC)抗体是抗突触前膜电压依赖性的钙通道抗体,常见于Lambert-Eaton肌无力综合征(LEMS)。日本学者[1]曾报道1例LEMS合并副肿瘤小脑变性(PCD)的患者,VGCC抗体效价存在不同程度的升高,但未检测抗SOX1抗体。本院收治1例同时表现为LEMS、PCD及副肿瘤性周围神经病的抗SOX1抗体、VGCC抗体双阳性的PNS患者,国内外文献尚未见类似报道,现报告如下。
1 临床资料
患者,男性,58岁,主因“双下肢无力17 d,加重伴言语含糊8 d”于2019年11月18日入院。患者腹泻3 d后,于2019年11月1日渐出现双下肢无力,表现为行走不稳,但可勉强行走,易疲劳,无晨轻暮重现象,伴左手持物抖动。就诊于当地医院,予以“氯吡格雷、阿托伐他汀”等治疗,上述症状逐渐加重。至11月10日患者渐出现言语含糊、吐字不清,偶有饮水呛咳,自觉下肢无力加重,运动耐量进一步下降,步行约100 m后出现双下肢酸软无力,行走需他人搀扶,双手持物抖动较前明显加重,左手为著;伴头晕及双上肢麻木感。11月18日到我院就诊。发病以来体重下降5 kg;既往吸烟史30余年(平均20支/d),长期间断咳嗽、咳痰,2年来偶有痰中带血丝。入院查体:神志清楚,构音障碍,吟诗样语言,右侧鼻唇沟变浅,余颅神经查体未见明显异常;左下肢肌力Ⅳ+级,余肢体肌力Ⅴ级,四肢肌张力正常。双侧深浅感觉正常,双侧指鼻试验、跟-膝-胫试验差,尤以左侧为著。Romberg征阳性。双侧肱二、三头肌反射、桡骨膜反射、膝腱反射及跟腱反射均未引出,左侧Babinski征阳性。颈软,无抵抗。共济失调等级量表(SARA)(左侧肢体)评分18分(表1)。入院后完善腰穿CSF检查:压力110 mmH2O(1 mmH2O=0.0098 kPa),白细胞数16.8×106/L(正常值:0~8.0×106/L),以单核细胞为主;CSF微量总蛋白357.7 mg/L(正常值:150.0~450 mg/L);CSF副肿瘤抗体全套(抗神经元抗体免疫印迹法):抗SOX1(±)。血清副肿瘤抗体全套(抗神经元抗体免疫印迹法):抗SOX1(+),Hu、Yo、Ri、Ma2/Ta、CV2/CRMP5、Amphi-physin(-)。血清VGCC抗体158.491 pmol/L(正常值≤30 pmol/L)。肿瘤标志物:癌胚抗原6.884 ng/ml(正常值:0~5.00 ng/ml),细胞角蛋白CK19片段(CK-19)6.37 ng/ml(正常值≤3.3 ng/ml)。神经节苷脂抗体、血常规、生化、风湿及类风湿全套、抗中性粒细胞胞浆抗体、抗心磷脂抗体、叶酸、维生素B12、甲状腺功能六项、痰结核杆菌DNA、痰结核菌涂片均正常。头颅MRI平扫+增强:脑内未见明显异常信号。胸部CT平扫:左肺门增大伴纵隔淋巴结肿大,双肺陈旧性结核伴右上肺支气管轻度扩张。胸部增强CT示左肺门恶性肿瘤伴纵膈淋巴结转移可能性大。双肺陈旧性结核伴右上肺支气管轻度扩张。PET-CT:右侧声带增厚伴糖代谢增高;纵膈及左肺门多发肿大高代谢淋巴结(图1)。电子喉镜示双侧声带稍充血,喉腔杓区轻度水肿充血,反流性咽喉炎可能。运动神经传导速度(MNCV):双侧正中神经、尺神经、桡神经、肌皮神经、腋神经、腓总神经波幅均降低;双侧胫神经未见异常。感觉神经传导速度(SNCV):右侧腓浅神经、左侧腓肠神经传导速度减慢。双侧胫神经H反射潜伏期延长。双侧正中神经、尺神经、胫神经F波未见异常。EMG示左侧三角肌、右侧肱二头肌、双侧腓肠肌、胫前肌未见明显异常。重复频率电刺激:双侧腋神经、副神经可见低频刺激波幅递减。刺激双侧尺神经,低频刺激波幅递减,高频刺激(大力收缩)可见波幅递增(158%)。新斯的明试验(-)。纵膈肿物穿刺病理检查提示SCLC(图2)。诊断:(1)PNS(LEMS叠加PCD及副肿瘤性周围神经病);(2)左肺中央型肺癌(cT2aN2M0小细胞癌ⅢA期)。患者入院第3 d开始接受地塞米松15 mg静脉滴注,1周后改为醋酸泼尼松龙片50 mg口服渐减量;入院第5 d联用丙种球蛋白(IVIG)(0.4 g/kg),疗程5 d。治疗30 d后,患者在接受化疗前评估走路无需搀扶,步行1 km左右后出现疲劳感,左侧肢体SARA评分8分(表1),神经系统症状明显改善。患者入院第31 d接受依托泊苷、顺铂化疗,化疗结束后无不适主诉,后规律4周期化疗。半年后随诊,患者神经系统症状同出院时,未见明显进展,后患者未再规律随诊及化疗;发病1年后随诊已发生脑转移,现姑息治疗中。
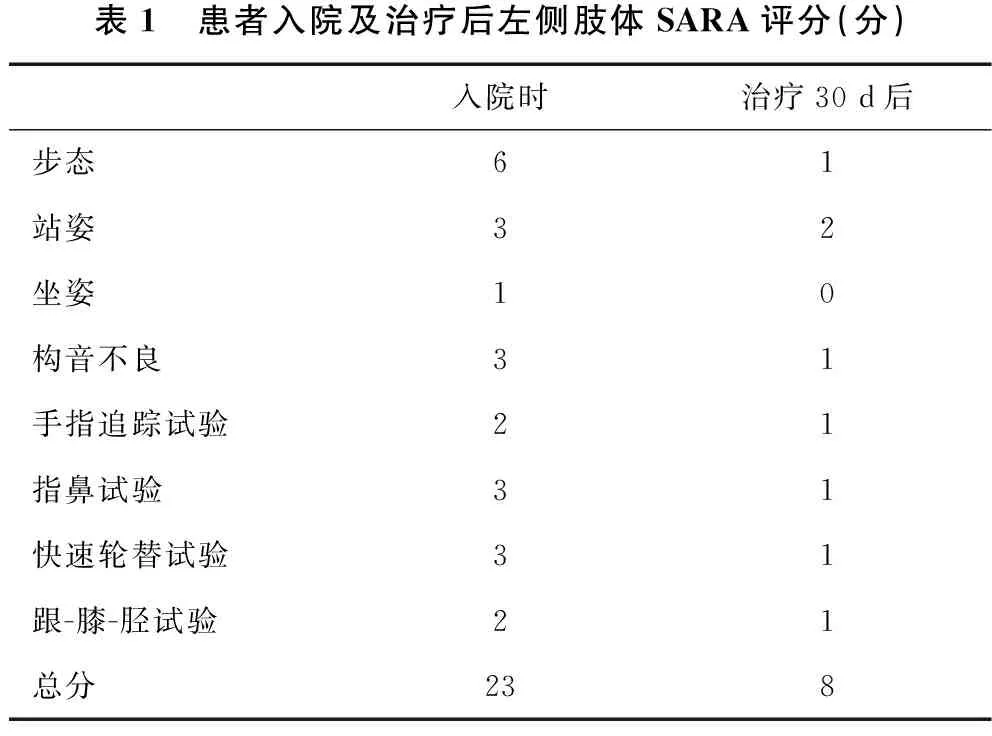
表1 患者入院及治疗后左侧肢体SARA评分(分)入院时治疗30 d后步态61站姿32坐姿10构音不良31手指追踪试验21指鼻试验31快速轮替试验31跟-膝-胫试验21总分238
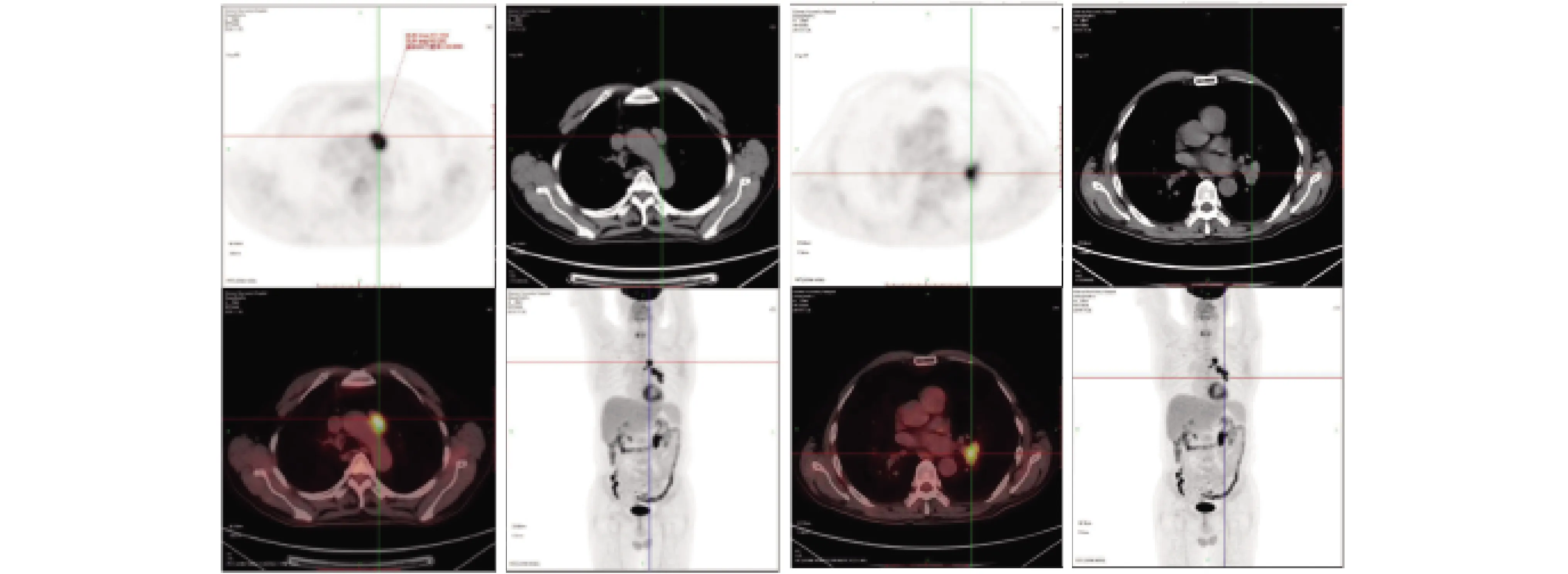
图1 PET-CT检查 纵膈区及左肺门见数枚肿大淋巴结,其糖代谢明显增高(SUVmax11.1,SUVav10.6),延迟1 h显像呈轻度增高(SUVmax2.3,SUVav10.6)

图2 纵膈肿物穿刺病理检查 肿瘤组织形态学为小细胞肿瘤,核形不规则,胞质少量,呈小片状及镶嵌状结构(HE染色)(A);免疫组化显示肿瘤细胞弥漫核表达CD56(B),肿瘤细胞高表达,高增殖Ki-67(C),肿瘤细胞弥漫核表达TTF-1(D)
2 讨 论
本例患者腹泻后出现双下肢近端无力,疲劳可致症状加重,后渐出现言语含糊、饮水呛咳、行走不稳、双上肢麻木等症状。查体示构音障碍、吟诗样语言、左下肢肌力Ⅳ+级,四肢腱反射未引出,左侧Babinski征(+),双侧指鼻试验、跟-膝-胫试验差,Romberg征(+)。定位在神经肌肉接头、周围神经、小脑多个系统,周围神经和共济系统的损害最为突出。本例急性起病逐渐进展,有腹泻诱因,定性考虑免疫性、代谢性、中毒性,其中需要考虑Guillain-Barré综合征的特殊类型,故首先完善神经电生理、重复频率电刺激等检查。神经传导速度提示广泛的周围神经髓鞘和轴索损害,但根性损害不突出,另外重频低频递减,高频递增提示LEMS也不支持最初的假设。随着实验室检查回报,排除代谢性、中毒性因素,吸烟史和肿瘤标志物CK-19增高透露出肿瘤的线索。CK-19是SCLC、肝癌相关的肿瘤标志物,而副肿瘤形式的LEMS(P-LEMS)绝大多数伴SCLC,约85%~90%的LEMS患者可检出VGCC抗体,因此腰穿送检了CSF和血清副肿瘤抗体谱以及血清VGCC抗体,同时行胸部CT增强以及进一步的PET-CT检查。最终,CSF副肿瘤抗体谱中SOX1及血VGCC抗体阳性进一步支持PNS的诊断,PET-CT提示纵膈及左肺门多发肿大高代谢淋巴结,通过穿刺活检获取病理明确诊断。
LEMS是一种罕见的神经肌肉接头疾病,临床上以近端肌无力、腱反射减弱和自主神经功能障碍为主要表现,有P-LEMS及自身免疫形式(A-LEMS)。P-LEMS与恶性肿瘤有关,50%~60%的患者合并SCLC,发病年龄在50岁以上;A-LEMS通常与其他免疫异常疾病有关[2]。约90%的LEMS患者可检出VGCC抗体,这些抗体直接与疾病的病理生理有关,可在神经末梢引起乙酰胆碱减少,导致肌肉无力。LEMS的诊断标准为:(1)临床表现:近端肌无力,自主神经功能障碍,腱反射减低。(2)VGCC抗体阳性。(3)重复神经电刺激异常:复合肌肉动作电位(CMAP)波幅降低;低频刺激(1~5 Hz)CMAP波幅下降>10%;大力自主收缩或高频刺激后CMAP波幅增高>100%[3]。2011年Titulaer等[4]提出LEMS肿瘤相关预测评分(DELTA-P)判断LEMS合并肿瘤的可能性。该评分将存在以下临床情况各记1分:球部症状(构音障碍、吞咽困难、饮水呛咳、颈肌无力等)、勃起功能障碍(男性患者)、体重下降≥5%、吸烟史、发病年龄≥50岁、Karnofsky功能状态评分0~60分(需要他人帮助生活才能自理)。DELTA-P评分的总分为6分,评分0~1分时存在SCLC的概率为0~2.6%,基本可排除P-LEMS,而评分3~6分时存在SCLC的概率为83.9%~100%。本例患者双下肢近端无力,疲劳可致症状加重,查体四肢腱反射未引出,重复频率电刺激提示低频递减,高频刺激递增,血清VGCC抗体阳性,支持LEMS诊断。DELTA-P评分5分,SCLC的概率高,PET-CT指引下的纵隔肿物穿刺、病理检测提示SCLC。
PCD是PNS的常见亚型之一,起病多早于肿瘤,最多见于SCLC,其次是卵巢癌、乳腺癌及霍奇金淋巴瘤。2005年Graus等[5]在SCLC相关的PCD患者血清中首次发现了一种能特异性结合小脑浦肯野细胞层Bergmann星形胶质细胞核的细胞内自身抗体,即AGNA,随后发现SOX1为其相应的抗原。目前已报道的SOX1抗体相关PNS包括LEMS、PCD、边缘叶脑炎、感觉性神经病及感觉运动性神经病。2013年Sabater等[6]对PCD和SCLC是否具有特定抗体库进行研究,分析了39例PCD合并SCLC的患者发现,72%至少检出一种抗体,其中抗SOX1抗体检出率为49%、VGCC为44%、HU为31%、ZIC4为13%,提示SOX1抗体是PCD潜在SCLC的良好预测指标。抗SOX1抗体阳性在VGCC抗体阳性患者中占76%,在VGCC抗体阴性患者中为27%,提示这些患者的SOX1抗体和VGCC抗体紧密相关。Titulaer等[7]提出,SOX1抗体对区分SCLC-LEMS和非肿瘤LEMS具有诊断价值,但该抗体阳性与SCLC患者的生存率无关。近期一项针对PNS中SOX1抗体的系统评价[8]显示,LEMS是抗SOX1抗体最常见的临床综合征,其次是PCD,并且多达47.1%的患者有多个胞内抗体和细胞表面自身抗体共存,其中细胞表面抗体VGCC和胞内抗体抗Hu是最多见的。SCLC仍是抗SOX1抗体阳性患者最常见的肿瘤(85.2%)。作为神经内分泌肿瘤,SCLC肿瘤细胞含有神经系统中存在的多种神经元抗原,这和其产生多种自身抗体簇导致PNS有关。
在2004年Graus等[9]提出的PNS诊断标准中,PCD为经典的临床综合征:在不到12周内出现的严重小脑综合征,包括小脑性共济失调、眩晕、构音障碍、眼球震颤,Rankin评分至少3分(症状显著干扰生活或阻止完全独立),MRI不显示小脑萎缩(除外年龄因素导致的)。目前的共识是多数PCD患者MRI上没有异常的小脑信号。然而有病例报告[10-11]显示,通过18F-脱氧葡萄糖PET(18F-FDG PET)可以在PCD的早期阶段发现小脑高代谢,随着时间流逝,MRI显示小脑萎缩,而18F-FDG PET显示代谢下降。本例患者存在小脑性共济失调,腰穿CSF检查未见炎症证据,SOX1抗体和VGCC抗体双阳性,MRI未见小脑异常信号,符合PCD诊断。虽然PET-CT无明显小脑葡萄糖高代谢表现,但考虑与患者起病时间短、及时接受IVIG及糖皮质激素治疗有关。
副肿瘤性周围神经病多发生于抗Hu抗体阳性的SCLC患者,以双下肢疼痛、麻木等症状起病,不对称分布,进行性发展,逐渐累及上肢,电生理检查多为感觉神经传导异常,表现为波幅下降或缺失[12]。本例患者双上肢麻木,远端为著,查体示腱反射消失,神经传导速度检查提示周围神经损害,对称性感觉受累,根性损害不突出,而LEMS及PCD均无法解释肢体麻木及神经传导速度的减慢,故考虑患者叠加副肿瘤性周围神经病。
PNS的治疗包括肿瘤本身治疗、免疫调节治疗及支持对症治疗。免疫调节治疗包括肾上腺皮质激素、静脉注射IVIG、血浆置换及免疫抑制剂(例如硫唑嘌呤、环磷酰胺)的应用。目前认为,抗神经元细胞表面蛋白或突触蛋白抗体(VGCC、NMDA抗体)相关疾病的免疫调节治疗效果较抗胞内抗原抗体(SOX1、Hu、Yo、Amphiphysin)要好,前者被认为是抗体介导(B细胞介导),而后者被认为是细胞毒性T细胞介导。没有证据表明免疫调节治疗会刺激肿瘤的生长,当然肿瘤的早期治疗对于取得良好的结果至关重要[13]。IVIG治疗PNS的机制尚不完全清楚,但可能包括以下内容:(1)与宿主效应细胞(例如中性粒细胞、自然杀伤细胞)上的Fc受体相互作用,从而分散这些细胞的注意力,减少攻击被副肿瘤抗体标记的自身细胞;(2)中和PNS自身抗体;(3)增加维持自身免疫耐受性的调节性T细胞的数量和作用[14]。虽然SOX1抗体阳性的PCD对于免疫调节治疗通常无效,但合并VGCC阳性的LEMS患者仍应给予IVIG治疗观察疗效,并通过后续化疗治疗原发肿瘤。
综上所述,以往认为PNS多表现为某种综合征或每种PNS都会有特定的标志性自身抗体,而实际上,绝大多数PNS可表现为多水平、多病灶的神经系统损害,同一患者也可能同时存在多种副肿瘤性自身抗体。同时表现为LEMS、PCD、副肿瘤性周围神经病的抗SOX1、VGCC双抗体阳性的PNS合并SCLC的病例在国内外尚未见报道。该例患者从出现神经系统症状至就诊17 d,病程短,感染诱发,既往无呼吸系统肿瘤病史,对于早期明确诊断及查找出原发肿瘤存在很大难度,重点需鉴别Guillain-Barré综合征、重症肌无力等,血清及CSF副肿瘤抗体谱的检测阳性为本病例的诊断提供了重要帮助,最终PET-CT及肺组织病理活检确诊SCLC。患者入院后及时接受免疫调节治疗、肿瘤化疗,神经系统症状得到明显改善,提示PNS的早期诊断及有针对性的治疗可明显提高患者生活质量,延长生存时间,为患者带来获益。
