消化道细胞内镜的临床应用价值
2021-09-14张菂李兆申
张菂,李兆申
海军军医大学第一附属医院消化内科,上海200433
消化内镜技术的发展,为消化道疾病的诊治开辟了全新领域。利用内窥镜对消化道黏膜的直视观察已经成为大多数消化道疾病的首选检查方法。在胃肠道早期肿瘤的检测和诊断中,尽管组织病理学检查仍然是金标准,但近年来内窥镜成像新技术的进步和普及极大地拓展了消化道黏膜病变的识别和检出的应用场景,例如有放大功能的窄带成像内 镜(narrow−band imaging,NBI),色 素 内 镜(chromoendoscopy)等[1]。近年来,随着临床对消化道早期肿瘤检出率要求的不断提高,如何实现细胞水平的内窥镜观察,使消化道黏膜病变的识别和判读逐步减少对有创病理活检的依赖,提高细胞学诊断效能,逐步成为国际上备受关注的研究热点。本文就细胞内镜(endocytoscopy,EC)在胃肠道检查的临床应用价值进行一个综述。
1 EC内镜的简介
具备超放大功能的EC是一种新型的高精度、高倍率放大内镜。它能够将消化道黏膜上皮放大520倍,使得“光学活检(optical biopsy)”成为可能,实现活体细胞水平的观察评价,不仅能够观察到微小血管、腺泡腔等微结构,还能够对细胞核的异型性进行评价。2003年,日本学者首次成功地利用EC内镜观察到活体正常鳞状细胞和食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)细胞[2],随后历经不断改进,发展了四代机型,功能不断增强,从最初的内镜附件模块逐渐发展成为与内镜镜身整合一体的内镜系统(表1)。目前第四代EC系统集成传统高清胃镜,窄带成像(NBI),细胞染色放大等功能,通过握柄变焦杆实现连续变焦放大,能够胜任食管、胃和直结肠检查的应用场景,超大的放大倍率(大于500×),较之传统内镜约80×的倍率有巨大的优势,相较前几代产品也能获得更优质的图像[3]。
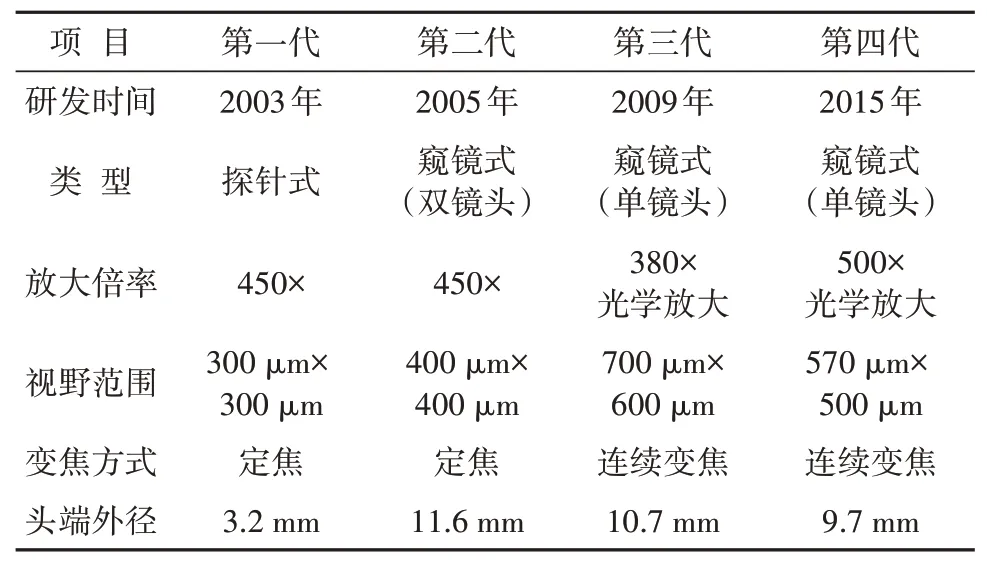
表1 四代EC的比较Tab.1 Comparison of four EC systems
2 EC的观察流程
目前,第四代EC系统集成了传统内镜高清白光检查模式。推荐的检查流程为:白光观察—NBI观察—放大/NBI(EC−NBI)观察—染色EC放大观察这四个步骤。依据内镜医师操作水平的差异,检查时间可能需要10~20 min,因此可以考虑在静脉镇静下进行。这样的检查流程能够有助于内镜医师完成从黏膜大体到微结构再到组织细胞学的观察和判断,形成清晰的诊断思路[4]。EC和传统放大胃镜的操作类似,依靠手柄的变焦杆进行放大观察,区别在于,当需要使用最大倍率(500×)放大时,需要先将内镜头端紧贴在病变表面倾斜固定(利用黑色硅胶帽附件),而后再拨动变焦杆到底进行观察。需要指出的是,在进行EC−NBI放大观察时,紧贴操作可能会压迫浅表血管影响血管评价的准确性,尤其是对于易出血病变部位的紧贴放大观察可能导致出血风险增加,进而影响后续重要的染色放大效果,因此在临床实践中,要根据具体情况酌情调整甚至取消EC−NBI观察步骤直接进行染色观察。
获得良好的可评估EC图像的一个关键因素在于选取合适的染色溶液和方法。目前,最常见的染色溶液有三种:甲苯胺蓝(TB),亚甲基蓝(MB)和结晶紫(CV)。关于哪种染料适合EC观察,有一些研究进行了探索。例如,1%MB用于鳞状细胞异型增生和癌,1%TB用于肠型化生[5]。Goda等[6]的研究结果表明,0.5%的TB和1%的MB最适合于正常十二指肠绒毛和十二指肠上皮肿瘤的染色。但是对于哪种染色剂效果优劣仍有争议。Inoue等[7]则更推荐结晶紫−亚甲基蓝双染色法(CM),这组染色剂由10 mL 0.05%CV和1 mL 1%MB的混合物组成,通过混合喷洒的方式进行染色。MB用于对细胞核进行染色,CV则用于染细胞质,组合原理类似传统病理的HE染色,通过CM法染色后,能够清晰显示腺体结构[8]。值得一提的是,这种配比方法加入CV还能够对MB进行稀释,减少MB对细胞DNA的潜在损伤作用。
3 上消化道EC内镜的临床应用
随着EC的不断升级,在食管和胃黏膜的检查中的细胞分类方法也不断发展[9−10],Inoue教授团队提出了改良的上消化道黏膜EC三分类法,将病变分为非肿瘤性(EC1),交界性(EC2)和肿瘤性(EC3)。这种分类方法还是聚焦消化道黏膜细胞的排列和形态,以及细胞核结构展开。
在食管检查中,由于鳞状上皮排列较为整齐紧密,产生黏液少的特点更适合于进行染色放大观察,因此研究相对更加丰富。多项体外研究都发现,在EC观察下,鳞状细胞癌上皮细胞的核密度比正常鳞状上皮显著增加[11]。也有学者利用EC高倍放大的能力获取了高质量的Barrett食管上皮的鳞状细胞岛的图像,并借此获得较高的诊断准确率。随着技术的不断进步,EC在食管病变的应用前景将更加广阔,病变分类方法也会更加精确合理。
在胃中,EC的应用和研究受到更多的限制,主要是由于胃黏膜分泌黏液相对较多,给获取高质量染色放大图像带来一些影响。这就要求对染色的过程进一步优化,包括使用祛除胃黏液的蛋白酶E和祛泡剂,利用低流量水流辅助冲洗等方法改善染色效果。一系列相关研究描述了正常胃粘膜、慢性胃炎、增生性息肉、肠上皮化生以及胃癌在EC放大下的病理生理特征,其中,杯状细胞的清晰识别和鉴定被认为是胃黏膜肠化生的特征性发现[12],甚至有学者报道了EC在体外试验中观察到幽门螺杆菌运动时的鞭毛摆动的形态[13]。Inoue团队发现核质比超高的“巨核征”细胞,可能与高分化胃癌的识别密切相关[4]。
4 下消化道EC内镜的临床应用
内镜检查和治疗在直结肠肿瘤的总体防治策略中,发挥着不可替代的作用。EC系统不仅能够显示高分辨率的肠黏膜白光图像,还能评估肠上皮的组织学特征,实现“光学活检”功能。2011年,Kudo等[14]发表了结肠病变的EC分类研究。这一分类对识别肠道肿瘤(包括小于5 mm的病变)的准确率达到93.3%~96.8%[15−17],CM染色同样能够有效提升图像获取的质量。此外,利用放大及NBI功能,能够对黏膜的微血管结构及细胞异型性进行分类,即EC−V分类,该分类对鉴别广基锯齿状腺瘤/息肉(SSA/P)和对T1期结肠癌结缔组织增生的检测十分有效。Sako等[18]发现,放大观察到的肠上皮细胞呈现筛孔样的“腺体融合征(FGFE)”,可以为组织学分级诊断提供有价值参考。一份包含4项回顾性研究的系统评价总结了关于EC和传统pit pattern模式进行结肠黏膜深度评估的诊断效能的差异,结果表明,EC的诊断效能优于传统pit pattern诊断(OR=1.31;95%CI:1.00~1.71;I=0%;P=0.05)[19]。
5 EC内镜与人工智能
EC具备获取高分辨率和放大的图像的优势,但是在另一方面,对内镜医师的病理学知识水平提出了很高的要求。对病理图像的识别和判断成为内镜医师应用该技术的一道门槛,因此,利用人工智能(AI)技术来辅助内镜医师进行组织学图像的辅助识别和判读,成为近年的研究热点。在多学科交叉的支持下,计算机辅助EC诊断(EC−CAD)技术应运而生,并且在结肠检查领域进行了诸多探索。目前开发的EC−CAD具有以下特点:(1)能够实现实时诊断;(2)完全接触病变部位,针对目标病变区域放大图像进行识别;(3)对微血管和细胞的识图诊断可以基于现有的病理诊断理论。一项前瞻性研究表明,利用EC−CAD系统(经过6万张以上图片训练)对791例患者的直结肠微小腺瘤(<5 mm)进行诊断,EC−NBI和EC染色的灵敏度及特异度均在90%左右[20]。
EC是利用内镜技术的飞速发展,将传统内镜和病理学诊断有效结合的成功实践,实现了无创、高效、准确的“光学活检”。尽管在染色、病变分类、操作难度等方面还有提升的空间,但是这一技术无疑给消化内镜开辟了一片新的领域,展现出了独特的临床价值。随着内镜技术的不断进步,结合计算机辅助技术,相信这样的跨学科交叉发展,会为消化内镜革新注入新的活力。
