天麻素对幼鼠癫痫的改善及对海马区星形胶质细胞增生的抑制作用研究
2021-09-14郑婷婷金美玉张莉
郑婷婷, 金美玉, 张莉
(大连市儿童医院神经内科,辽宁大连 116000)
癫痫是儿童时期常见的一种慢性神经系统疾病,具有致残率高、发病率高和反复发作等特点,长期反复发作可影响小儿大脑发育以及神经元正常功能,引起远期神经行为发育及突触可塑性相关基因的表达异常,进而造成认知功能障碍,严重威胁患儿身体健康[1-2]。海马组织结构变化与癫痫的发生发展关系密切,其中,星形胶质细胞增生在癫痫发生过程中发挥重要作用,增生的星形胶质细胞参与调节氨基酸代谢和离子浓度,引起癫痫发作。以星形胶质细胞为切入点,抑制其增生,可为临床防治癫痫发作提供新的思路和方法[3-4]。天麻素为中药天麻Gastrodia elataBl.块根提取物,具有镇静、镇痛、催眠、脑保护等作用,可明显缓解神经衰弱、失眠等症状,临床上广泛用于心脑血管病的治疗,其副作用小,疗效显著[5]。动物实验表明,天麻素可改善癫痫动物模型的症状,具有神经保护作用[6]。临床研究显示,天麻素可降低癫痫合并偏头疼患者的发作频率,提高总有效率[7]。 p38 丝裂原活化蛋白激酶(p38MAPK)在癫痫中发挥重要作用,通过抑制p38MAPK 通路可保护受损神经元[8]。既往研究显示,天麻素通过抑制p38MAPK 通路可降低化疗痛大鼠的机械痛阈和热痛阈[9]。但天麻素对癫痫的治疗作用是否与p38MAPK 有关,尚不明确,因此,本研究通过建立幼鼠癫痫模型,探讨天麻素对幼鼠癫痫的改善作用及可能机制,以期为临床治疗小儿癫痫提供实验依据。现将研究结果报道如下。
1 材料与方法
1.1 实验动物SPF 级雄性 SD 大鼠 60 只,2 周龄,体质量(20 ± 1)g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006],饲养于大连市儿童医院实验动物中心,购入后保持环境清洁通风,温度(22±2)℃,相对湿度(50±5)%,适应性饲养3 d。
1.2 药物、试剂和仪器天麻素(分子量:286.28,分子式:C13H18O7,批号:62499-27-8)购自成都瑞芬思生物科技有限公司;p38 MAPK 激活剂茴香霉素购自美国Sigma 公司;匹罗卡品、氯化锂均购自美国Sigma 公司;地西泮注射液(国药准字H12020957,2 mL:10 mg)购自天津金耀药业有限公司;末端脱氧核苷酸转移酶介导的d UTP缺口末端标记(TUNEL)凋亡染色试剂盒购自碧云天生物工程有限公司;兔抗大鼠胶质纤维酸性蛋白(GFAP)抗体购自武汉博士德生物工程有限公司;兔抗大鼠p38MAPK、磷酸化p38MAPK(p-p38MAPK)、B细胞淋巴瘤/白血病-2基因(Bcl-2)、Bcl-2相关X蛋白(Bax)等抗体和辣根过氧化物酶(HRP)标记的山羊抗兔抗体均购自美国Abcam 公司。Mini-Protean4电泳仪(美国Bio-Rad公司)。
1.3 癫痫模型建立与分组随机选取50只幼鼠构建癫痫模型。参照文献[10]进行建模,方法:给予幼鼠127 mg/kg 氯化锂腹腔注射,18 h 后按1 mg/kg腹腔注射东莨菪碱,30 min后按30 mg/kg腹腔注射匹罗卡品,至出现癫痫持续状态,如30 min 后未发作,再按上述剂量注射一次匹罗卡品。采用Racine 分级标准[11]评价痫性发作等级:0 级,无反应;1 级,耳面部肌肉抽搐;2 级,以点头或甩尾为主的肌肉抽搐;3 级,单侧肢体的阵挛及抽搐;4 级,双侧肢体阵挛或全身强直阵挛发作,伴有身体直立;5 级,抽搐,持续站立、身体背曲强直、跌倒。根据以上评分标准,出现4级以上发作,认为造模成功,癫痫持续90 min,腹腔注射地西泮(10 mg/kg)终止癫痫持续状态。建模成功幼鼠44 只,将其随机分为模型组、天麻素组、天麻素+茴香霉素组、茴香霉素组,每组各11只。另将10只正常幼鼠设为对照组,腹腔注射等体积生理盐水。
1.4 药物干预造模结束12 h 后进行干预。天麻素组:腹腔注射120 mg/kg 天麻素;天麻素+茴香霉素组:腹腔注射120 mg/kg 天麻素,腹腔注射5 μg/kg 茴香霉素;茴香霉素组:腹腔注射5 μg/kg茴香霉素;模型组和对照组:腹腔注射等体积溶媒二甲基亚砜(DMSO)。每日1次,连续1周。
1.5 观察指标与方法
1.5.1 行为学观察 造模开始至末次干预期间,观察各组幼鼠行为学变化。
1.5.2 监测脑电图观察脑电波改变情况 末次干预后12 h,以1%戊巴比妥钠(50 mg/kg)腹腔注射麻醉幼鼠,进行脑电图监测。在双侧大脑皮层和海马部位放置电极,使用牙托粉和胶水固定,采用多导生理记录仪记录脑电图变化,连续记录2 h内脑电图变化情况。潜伏期为从开始记录至出现痫波(尖波、棘波、棘慢波)的时间。痫波频率:记录时长1 min脑电波图中出现痫波数值,2 h内共采集10 次,取平均数。大发作次数:连续超过10 s的痫波记为1次大发作,记录2 h内数据。
1.5.3 尼氏染色观察海马组织神经元存活情况 脑电图监测结束后,各组随机选5只幼鼠,开胸于左心室至升主动脉插管,以200 mL生理盐水+40 mL 4%多聚甲醛先快后慢进行灌注2 h,幼鼠出现四肢及全身痉挛、僵硬,表示灌注成功。取出大脑,置于4%多聚甲醛溶液中固定过夜,25%蔗糖脱水至沉底,取前囟后1 ~ 2.5 mm 处的脑组织,切片(厚约20 μm)。室温退冰后,加入尼氏染色液反应10 min,依次乙醇脱水、透明、封片。显微镜下观察海马CA3 区存活神经元数目,随机选择5 个视野,取平均值。
1.5.4 TUNEL 染色观察海马组织神经元细胞凋亡情况 取脑组织切片,二甲苯脱蜡10 min,乙醇脱水,滴加蛋白酶K溶液孵育10 min,磷酸盐缓冲液(PBS)洗涤 3 次,以 3% H2O2室温孵育 10 min,灭活过氧化物酶活性;PBS 洗涤3 次,滴加50 μL 的TdT 标记的反应混合物室温避光孵育90 min,TBS溶液洗涤;终止反应后,DAB显色,PBS洗涤。随机选取5个视野,观察棕褐色TUNEL阳性细胞数。
1.5.5 免疫组织化学法观察海马组织GFAP 表达情况 取海马组织切片,PBS洗涤3次,3%H2O2反应10 min;PBS 洗涤,正常山羊血清封闭15 min,加入1∶200 稀释的兔抗大鼠GFAP 多抗4 ℃孵育过夜;PBS 洗涤3 次,加入1∶150 稀释的生物素标记的二抗 37 ℃孵育 20 min;PBS 洗涤 3 次,加入 1∶150 稀释的HRP 标记的链霉素卵白素室温孵育60 min;PBS 洗涤3 次,DAB 显色,脱水,透明,封片,星形胶质细胞经DAB 显色后呈棕褐色。每只幼鼠随机取3 张切片,每张切片随机取5 个视野,利用Image Pro Plus 6.0图像分析软件对GFAP阳性表达细胞进行计数,取平均值。
1.5.6 蛋白免疫印迹(Western Blot)法检测细胞中p38MAPK、p-p38MAPK、GFAP、Bcl-2、Bax 蛋白表达情况 取各组剩余大脑,分离海马组织,保存于液氮中。取海马组织,加入裂解液,冰上研磨,以12 000 r/min 离心(离心半径10 cm)10 min,取上清,二喹啉甲酸(BCA)法测定蛋白浓度,蛋白水浴变性,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳结束后将蛋白转至聚偏氟乙烯(PVDF)膜,5%脱脂奶粉封闭2 h,TBST 溶液洗膜,分别加入稀释的p38MAPK(1∶1 000 稀释)、p-p38MAPK(1∶1 000 稀 释)、 GFAP(1∶1 000 稀释)、Bcl-2(1∶500 稀释)、Bax(1∶800 稀释)一抗,4 ℃孵育过夜。TBST 溶液洗膜,加入HRP 标记的二抗(1∶2 000稀释),室温孵育1 h。滴加电化学发光(ECL)液,显影定影,晾干后扫描图像,以β-actin为内参,计算目的蛋白相对表达水平(目的蛋白条带灰度值/内参蛋白条带灰度值)。
1.6 统计方法采用SPSS 25.0 统计软件分析数据,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,两两组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 行为学观察对照组幼鼠未出现癫痫发作;其余4 组幼鼠注射匹罗卡品后出现转圈、肌肉抽搐、四肢痉挛、节律性点头,直至出现癫痫持续状态。随着干预时间延长,天麻素+茴香霉素组和天麻素组大鼠发作次数逐渐减少。
2.2 各组幼鼠脑电图变化比较对照组幼鼠脑电波以α、β 波为主,偶有散在θ 波;模型组出现以尖波、棘波、棘慢波为主的痫波;茴香霉素组与模型组脑电波相似,以痫波为主,痫波密度更大;天麻素+茴香霉素组、天麻素组波幅较模型组明显降低,痫波密度明显减小,仍有散在尖波,其中,天麻素组较天麻素+茴香霉素组改善更明显。具体结果见图1。

图1 各组幼鼠脑电波改变情况比较Figure 1 Comparison of the changes of brain waves of young rats in various groups
各组幼鼠潜伏期、痫波频次和大发作次数比较,差异有统计学意义(P<0.05)。与模型组比较,茴香霉素组潜伏期缩短,痫波频次和大发作次数增加,天麻素+茴香霉素组、天麻素组潜伏期延长,痫波频次和大发作次数减少(P<0.05);与茴香霉素组比较,天麻素+茴香霉素组、天麻素组潜伏期延长,痫波频次和大发作次数减少(P<0.05);天麻素组潜伏期长于天麻素+茴香霉素组,痫波频次和发作次数少于天麻素+茴香霉素组(P<0.05)。具体结果见表1。
表1 各组幼鼠潜伏期、痫波频次和大发作次数比较Table 1 Comparison of the incubation period,frequency of epileptic waves and frequency of major attack of young rats in various groups ()
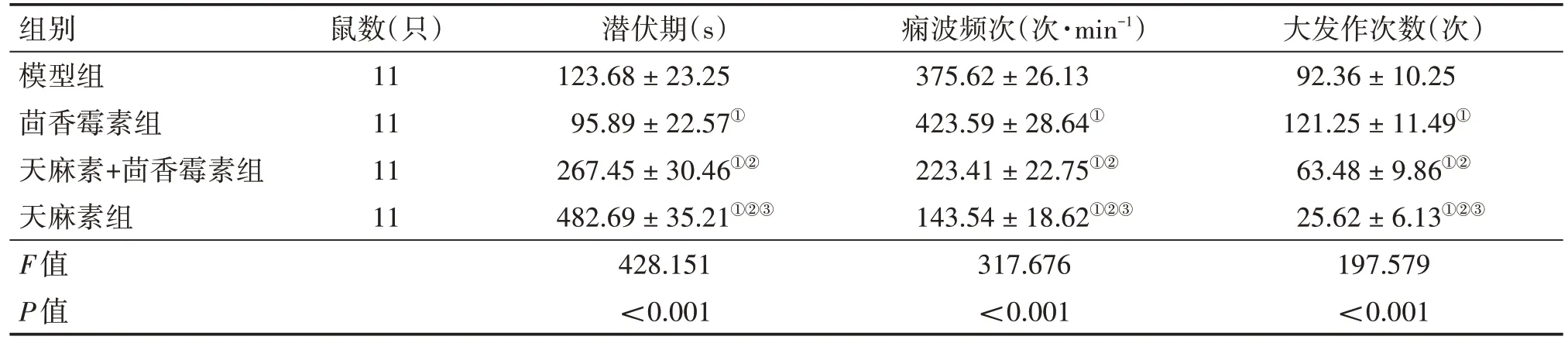
表1 各组幼鼠潜伏期、痫波频次和大发作次数比较Table 1 Comparison of the incubation period,frequency of epileptic waves and frequency of major attack of young rats in various groups ()
①P<0.05,与模型组比较;②P<0.05,与茴香霉素组比较;③P<0.05,与天麻素+茴香霉素组比较
组别模型组茴香霉素组天麻素+茴香霉素组天麻素组F值P值大发作次数(次)92.36±10.25 121.25±11.49①63.48± 9.86①②25.62 ± 6.13①②③197.579<0.001鼠数(只)11 11 11 11潜伏期(s)123.68±23.25 95.89±22.57①267.45± 30.46①②482.69 ± 35.21①②③428.151<0.001痫波频次(次·min-1)375.62±26.13 423.59±28.64①223.41± 22.75①②143.54 ± 18.62①②③317.676<0.001
2.3 各组幼鼠海马组织存活神经元数比较海马存活神经元数组间比较,差异有统计学意义(P<0.05)。与对照组比较,模型组、茴香霉素组、天麻素+茴香霉素组、天麻素组存活神经元数减少(P<0.05);与模型组比较,茴香霉素组存活神经元数减少,天麻素+茴香霉素组、天麻素组存活神经元数增加(P<0.05);与茴香霉素组比较,天麻素+茴香霉素组、天麻素组存活神经元数增加(P<0.05);天麻素组存活神经元数较天麻素+茴香霉素组增加(P<0.05)。见表2、图2。
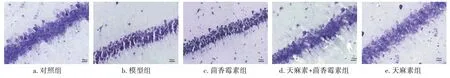
图2 各组幼鼠海马组织CA1区神经元存活情况(Nissl染色法,×400)Figure 2 Comparison of the survival of neurons in hippocampal CA1 region in young rats of various groups(by Nissl staining method,×400)
表2 各组幼鼠海马组织存活神经元数比较Table 2 Comparison of the number of survival neurous in hippocampus of young rats in various groups()

表2 各组幼鼠海马组织存活神经元数比较Table 2 Comparison of the number of survival neurous in hippocampus of young rats in various groups()
①P<0.05,与对照组比较;②P<0.05,与模型组比较;③P<0.05,与茴香霉素组比较;④P<0.05,与天麻素+茴香霉素组比较
存活神经元数(个·视野-1)352.40±20.13 93.60±15.25①61.40± 10.33①②168.40 ± 17.59①②③246.80 ± 19.42①②③④243.475<0.001组别对照组模型组茴香霉素组天麻素+茴香霉素组天麻素组F值P值鼠数(只)5 5 555
2.4 各组幼鼠海马组织凋亡神经元数比较凋亡神经元数组间比较,差异有统计学意义(P<0.05)。与对照组比较,模型组、茴香霉素组、天麻素+茴香霉素组、天麻素组凋亡神经元数增加(P<0.05);与模型组比较,茴香霉素组凋亡神经元数增加,天麻素+茴香霉素组、天麻素组凋亡神经元数减少(P<0.05);与茴香霉素组比较,天麻素+茴香霉素组、天麻素组凋亡神经元数减少(P<0.05);天麻素组凋亡神经元数较天麻素+茴香霉素组减少(P<0.05)。见表3、图3。

图3 各组幼鼠海马组织CA1区神经元凋亡情况(TUNEL染色法,×400)Figure 3 Comparison of the apoptosis of neurons in hippocampal CA1 region of young rats in various groups(by TUNEL staining method,×400)
表3 各组幼鼠海马组织凋亡神经元数比较Table 3 Comparison of the number of apoptotic neurons in hippocampus of young rats in various groups ()

表3 各组幼鼠海马组织凋亡神经元数比较Table 3 Comparison of the number of apoptotic neurons in hippocampus of young rats in various groups ()
①P<0.05,与对照组比较;②P<0.05,与模型组比较;③P<0.05,与茴香霉素组比较;④P<0.05,与天麻素+茴香霉素组比较
凋亡神经元数(个·视野-1)4.20±2.31 33.60±3.43①41.20 ± 3.12①②22.80 ± 3.06①②③14.60 ± 2.89①②③④58.535<0.001组别对照组模型组茴香霉素组天麻素+茴香霉素组天麻素组F值P值鼠数(只)5 5 5 5 5
2.5 各组幼鼠海马区GFAP 表达阳性细胞数比较GFAP 阳性表达细胞数组间比较,差异有统计学意义(P<0.05)。与对照组比较,模型组、茴香霉素组、天麻素+茴香霉素组、天麻素组凋亡GFAP 阳性表达细胞数增加(P<0.05);与模型组比较,茴香霉素组GFAP 阳性表达细胞数增加,天麻素+茴香霉素组、天麻素组凋亡GFAP 阳性表达细胞数减少(P<0.05);与茴香霉素组比较,天麻素+茴香霉素组、天麻素组GFAP 阳性表达细胞数减少(P<0.05);天麻素组GFAP阳性表达细胞数较天麻素+茴香霉素组减少(P<0.05)。见表4、图4。

图4 各组幼鼠海马组织GFAP表达阳性细胞数(DAB染色法,×400)Figure 4 Comparison of the number of GFAP positively expressed cells in hippocampus of young rats in various groups(by DAB staining method,×400)
表4 各组幼鼠海马区GFAP阳性表达细胞数比较Table 4 Comparison of the number of GFAP positively expressed cells in hippocampus of young rats in various groups ()
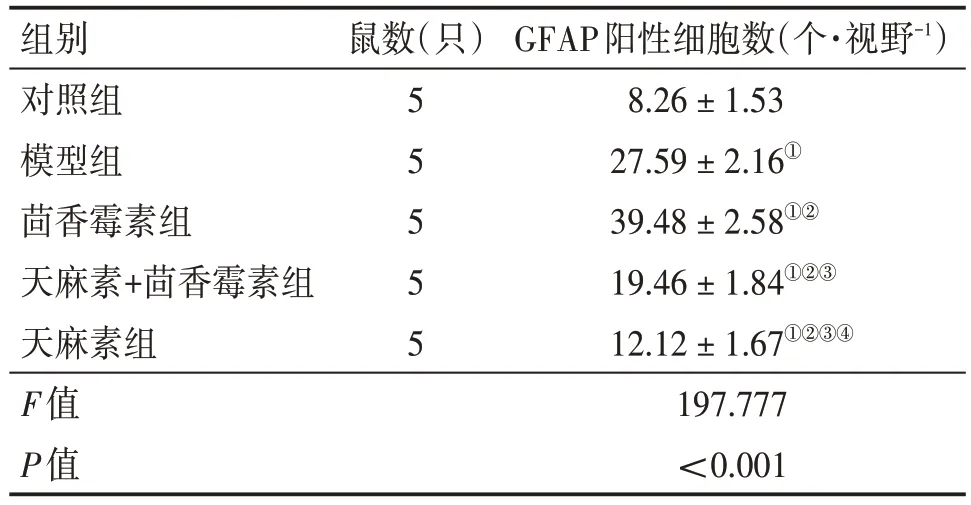
表4 各组幼鼠海马区GFAP阳性表达细胞数比较Table 4 Comparison of the number of GFAP positively expressed cells in hippocampus of young rats in various groups ()
①P<0.05,与对照组比较;②P<0.05,与模型组比较;③P<0.05,与茴香霉素组比较;④P<0.05,与天麻素+茴香霉素组比较
GFAP阳性细胞数(个·视野-1)8.26±1.53 27.59±2.16①39.48± 2.58①②19.46 ± 1.84①②③12.12 ± 1.67①②③④197.777<0.001组别对照组模型组茴香霉素组天麻素+茴香霉素组天麻素组F值P值鼠数(只)55 5 5 5
2.6 各组幼鼠海马组织相关蛋白表达水平比较海马组织p-p38MAPK、GFAP、Bcl-2、Bax 蛋白相对表达量组间比较,差异有统计学意义(P<0.05)。与对照组比较,模型组、茴香霉素组、天麻素+茴香霉素组、天麻素组p-p38MAPK、GFAP、Bax 蛋白相对表达量升高,Bcl-2 蛋白相对表达量降低(P<0.05);与模型组比较,茴香霉素组p-p38MAPK、GFAP、Bax 蛋白相对表达量升高,Bcl-2 蛋白相对表达量降低,天麻素+茴香霉素组、天麻素组p-p38MAPK、GFAP、Bax 蛋白相对表达量降低,Bcl-2 蛋白相对表达量升高(P<0.05);与茴香霉素组比较,天麻素+茴香霉素组、天麻素组p-p38MAPK、GFAP、Bax 蛋白相对表达量降低,Bcl-2 蛋白相对表达量升高(P<0.05);天麻素组p-p38MAPK、GFAP、Bax 蛋白相对表达量低于天麻素+茴香霉素组,Bcl-2 蛋白相对表达量高于天麻素+茴香霉素组(P<0.05)。各组p38MAPK 蛋白相对表达量比较,差异无统计学意义(P>0.05)。见表5、图5。

图5 各组幼鼠海马组织相关蛋白的Western Blot电泳条带比较Figure 5 Comparison of the Western Blotting electrophoresis strips of related proteins in hippocampus of young rats in various groups
表5 各组幼鼠海马组织相关蛋白表达比较Table 5 Comparison of the related protein expression in hippocampus of young rats in various groups()

表5 各组幼鼠海马组织相关蛋白表达比较Table 5 Comparison of the related protein expression in hippocampus of young rats in various groups()
①P<0.05,与对照组比较;②P<0.05,与模型组比较;③P<0.05,与茴香霉素组比较;④P<0.05,与天麻素+茴香霉素组比较
Bax 0.62±0.06 0.97±0.09①1.12± 0.11①②0.83 ± 0.08①②③0.71 ± 0.07①②③④31.640<0.001组别对照组模型组茴香霉素组天麻素+茴香霉素组天麻素组F值P值鼠数(只)56666 p38MAPK 1.01±0.11 0.98±0.10 0.95±0.11 1.02±0.12 0.97±0.10 0.413 0.798 p-p38MAPK 0.36±0.05 0.81±0.08①0.92± 0.09①②0.63 ± 0.07①②③0.47 ± 0.05①②③④60.659<0.001 GFAP 0.48±0.06 0.86±0.09①1.13± 0.11①②0.71 ± 0.07①②③0.59 ± 0.07①②③④53.338<0.001 Bcl-2 0.85±0.08 0.35±0.07①0.21± 0.06①②0.62 ± 0.06①②③0.73 ± 0.07①②③④87.093<0.001
3 讨论
星形胶质细胞是中枢神经系统中数量最丰富的胶质细胞亚型,具有多种功能,不仅参与维持神经元正常代谢活动,为神经元提供结构支持,还参与调节神经递质合成及神经突触的形成[12]。星形胶质细胞增生不仅在形态学上表现为胞体肥大肿胀,突起加粗、延长,而且GFAP 表达增加。星形胶质细胞通过调节离子浓度、谷氨酸释放以及细胞间连接功能变化等多种途径影响神经元的兴奋性,其发生活化后,可诱导局部神经网络兴奋性发生改变,引起异常同步放电,导致癫痫发作[13]。增生的星形胶质细胞还可释放递质和炎症因子,进一步促进细胞活化和增生,导致癫痫反复发作,有效抑制星形胶质细胞细胞增生对于防止癫痫发作至关重要[14]。
研究证实,癫痫过程中伴随神经元病理生理改变,癫痫发作后迅速引起神经元细胞凋亡、坏死,凋亡坏死的神经元释放多种生物活性物质,激活补体,进而诱发邻近神经元溶解、凋亡,表现为神经元丢失,出现凋亡[15-16]。中医学认为,风邪为癫痫主要病机,多与肝有关,若逆气上巅犯脑,内扰脑神,可引发痫证。脑主神,肝主风,而中药天麻具有熄风平肝、祛风通络、醒脑止痫之功效,现代药理学研究[17-18]证明,天麻素可通过血脑屏障,可减轻神经毒性,减少神经元丢失,减轻炎症反应,对神经元具有一定的保护作用。本研究结果显示,模型组大鼠表现出典型的痫样脑电波,经天麻素干预后,潜伏期延长,痫波频次和大发作次数减少,存活神经元数增加,凋亡神经元数减少,亦提示天麻素可保护神经元细胞,具有一定的抗癫痫作用。癫痫发作过程中,大量神经元丢失,激活星形胶质细胞,引起肥大增生,形成胶质瘢痕。有研究显示,天麻素可抑制蛛网膜下腔出血引起的星形胶质细胞增生,减少神经元凋亡[19]。另有研究显示,天麻素可减少脊髓背角灰质中GFAP 表达,抑制星形胶质细胞活化,减轻大鼠化疗痛反应[20]。本研究结果显示,经天麻素治疗后的癫痫大鼠海马组织GFAP 表达较模型组明显降低,亦提示天麻素可抑制星形胶质细胞活化,减轻癫痫发作。
神经元丢失及星形胶质细胞增生在癫痫发作过程中起重要作用,本研究进一步采用Western Blot 法证实了天麻素可减弱GFAP、Bax 蛋白表达,增强Bcl-2 蛋白表达,减少神经元凋亡,抑制星形胶质细胞增生;但其通过何种机制发挥作用尚不清楚。MAPK 通路异常是癫痫大鼠记忆障碍的关键因素。p38MAPK 是MAPK 家族的重要分子,通过凋亡、自噬等多种途径介导癫痫认知障碍,已研究表明,调控p38MAPK 的表达可减少神经元凋亡,改善癫痫症状[21]。本研究在使用天麻素基础上,添加p38MAPK 通路激活剂茴香霉素,观察天麻素是否通过抑制p38MAPK 通路发挥作用,结果显示,天麻素+茴香霉素组较茴香霉素组的癫痫症状减轻,而天麻素组对癫痫改善明显,提示茴香霉素可抵消部分天麻素对p38MAPK 通路的抑制作用,表明天麻素对幼鼠癫痫的改善作用及对星形胶质细胞增生的抑制作用,可能是通过抑制p38MAPK通路发挥作用的。
综上所述,天麻素可有效改善癫痫,并对星形胶质细胞增生具有一定的抑制作用,其机制可能与抑制p38MAPK通路有关。
