NtabEXPA12基因过表达对烟草叶片发育及抗逆性的影响
2021-09-13丁安明陈志华杨懿德余祥文杨洋鄢敏杨兴有王卫锋孙玉合
丁安明 陈志华 杨懿德 余祥文 杨洋 鄢敏 杨兴有 王卫锋 孙玉合


摘 要:细胞壁松弛因子膨胀素在调控植物生长发育和响应非生物胁迫等方面发挥重要作用,克隆烟草膨胀素基因并研究其功能可为烟草叶片发育调控和抗逆育种提供理论依据。本研究从普通烟草K326中克隆了一个膨胀素基因NtabEXPA12及其启动子ProNtabEXPA12,通过实时荧光定量PCR、亚细胞定位和过表达等对该基因进行了功能研究,分析了启动子包含的顺式作用元件和活性。结果表明,NtabEXPA12在烟草叶片中具有较高的表达量;ProNtabEXPA12中包含多个响应高盐、干旱和植物激素的顺式元件,并且其活性受到高盐、干旱和ABA等的诱导;过表达NtabEXPA12通过调控细胞扩展促进转基因烟草叶片的生长发育,并可以提高转基因K326对高盐和干旱的抗性。因此,NtabEXPA12在烟草叶片发育调控及抗逆育种中具有潜在的应用前景。
关键词:膨胀素;基因功能;叶片发育;耐盐;抗旱性
Abstract: Expansins play important roles in plant growth and development and plants responses to abiotic stresses. Cloning and studying the functions of tobacco expansin genes will provide a theoretical basis for regulation of tobacco leaf development and tobacco resistance breeding. In this study, we cloned NtabEXPA12 with its promoter ProNtabEXPA12 from tobacco variety K326, studied its function by qPCR, subcellular localization and gene overexpression assays, and analyzed cis-regulatory elements in ProNtabEXPA12 and its promoter activity. The results showed that NtabEXPA12 was highly expressed in tobacco leaves. Various cis-elements in ProNtabEXPA12 were identified which were related to plants responses to salt, drought and plant hormones. And indeed, the activity of ProNtabEXPA12 was strongly induced by NaCl, ABA and drought treatments. We also found that overexpression of NtabEXPA12 promoted cell and leaf expansion, and enhanced abiotic stress tolerance in transgenic K326 plants. Therefore, NtabEXPA12 has potential application values in manipulating tobacco leaf development and tobacco resistance breeding.
Keywords: expansin; gene function; leaf development; slat tolerance; drought resistance
細胞壁为植物生长发育提供基础支撑,也是植物响应环境变化的一道防御屏障,其主要由纤维素、半纤维素和果胶质多糖构成,还包含少量的离子和细胞壁蛋白如膨胀素等[1-3]。植物生长包括细胞数目增加和细胞体积扩展两个方面,细胞体积的扩展受其内部膨胀压力和细胞壁可塑性的协同调控。事实上,细胞壁在为植物细胞提供支撑和保护作用的同时,也是限制细胞生长的主要因素之一[4-5]。因此,植物通过松弛细胞壁多糖之间的相互交联对细胞壁进行结构重塑,是其调控细胞生长的关键环节。
膨胀素(expansin, EXP),又被称为植物细胞壁扩展蛋白,是参与细胞壁松弛与重构的主要因子之一[6]。研究发现,EXP参与植物生长发育及响应环境变化等多个过程,包括种子萌发[7]、根系建成[8]、植株营养生长[9]、生殖生长及果实的膨大和成熟[10-11]等植物共性发育过程及植物抵抗病虫侵害[12]、干旱、高盐[7,13-14]等生物和非生物胁迫过程;也包括某些植物特有的发育现象,如豆科植物根瘤的形成[15]、棉花棉纤维的伸长[16]等。因此,鉴定植物EXP基因的功能对农业生产具有重要的潜在应用前景。
本研究在普通烟草品种K326中克隆了一个烟草膨胀素基因NtabEXPA12,并对其启动子序列和活性进行了分析;通过基因过表达分析,初步鉴定了NtabEXPA12在调控烟草生长发育和抵抗非生物胁迫等过程中的生物学功能,为烟草叶片发育调控和抗逆育种提供理论依据。
1 材料与方法
1.1 试验材料
普通烟草品种K326,拟南芥哥伦比亚生态型。
1.2 试验方法
1.2.1 试验材料的种植 将烟草种子点播于清水浸润的滤纸上或花盆中,种植于中国农业科学院烟草研究所温室,自然光条件下生长。在苗期、团棵期、旺长期和花期,分别收集发芽的种子、植株的根、茎、叶和花等组织。将拟南芥种子播种到育苗基质上,置于23 ℃人工气候室中生长,收集莲座叶片。收集的组织经液氮速冻后放置于?80 ℃冰箱保存备用。
1.2.2 核酸提取及反转录 利用北京全式金生物技术有限公司(TransGen Biotech, Beijing)生产的DNA和RNA提取试剂盒及反转录试剂盒依照说明书的步骤分别提取基因组DNA和总RNA,并将1 μg总RNA反转录为cDNA,稀释20倍后放置-20 ℃冰箱保存备用。
1.2.3 基因及其启动子克隆与载体构建 依据中国烟草基因组数据库中基因(命名为NtabEXPA12)和启动子(命名为ProNtabEXPA12)的DNA序列设计特异性引物,包括基因序列扩增特异性引物NtabEXPA12-F1 5′-ggtaccATGGCTATTAATGACCA A-3′和NtabEXPA12-R1 5′-ggatccTTAGAATTGA CCTCCTTC-3′及启动子序列扩增特异性引物ProNtabEXPA12-F 5′-ctgcagCATTTCTGTGATTTG TTTTA-3′和ProNtabEXPA12-R 5′-ggtaccTTTGTT ACTTATTGATTGTA-3′,以K326叶片cDNA或基因组DNA为模板,使用南京诺唯赞生物科技股份有限公司(Vazyme Biotech, Nanjing)生产的Pfu高保真酶,按照说明书的体系和步骤进行PCR扩增,将得到的扩增产物利用北京全式金生物技术有限公司(TransGen Biotech, Beijing)的PCR产物纯化试剂盒参照说明书的步骤进行纯化后,利用同源重组的方法将基因序列连接到双元载体p1300-EGFP上,将启动子序列连接到双元载体p1300-GUS上,转化大肠杆菌后利用卡那霉素筛选阳性克隆并送上海派森诺生物科技股份有限公司(Personalbio Biotech, Shanghai)进行测序,得到基因及启动子的DNA序列,并将测序正确的载体命名为35S:NtabEXPA12和ProNtabEXPA12:GUS。
利用基因序列扩增特异性引物NtabEXPA12-F1和NtabEXPA12-R2 5′-ggatccAGAATTGACCTCCT TC-3′及AtPGIP2-F 5′-ggtaccATGGATAAGACAA TGACACT-3′和AtPGIP2-R 5′-ggatccCTTGCAAC TAGGAAGAGGTG-3′分别以K326和拟南芥叶片cDNA为模板,参照上述的方法进行PCR扩增并将扩增片段分别连接到双元载体p1300-EGFP和p1300-ERFP上。测序正确的载体被命名为35S:NtabEXPA12-GFP和35S:AtPIPG2-RFP。
1.2.4 实时荧光定量PCR 以cDNA为模板,利用NtabEXPA12的基因特异引物NtabEXPA12-qF 5′-AATTGGCAGAGTCACTCT-3′和NtabEXPA12- qR 5′-AGTTTGACCAAATTGCCA-3′及大连宝生物工程有限公司(Takara, Dalian)的实时定量PCR试剂盒,按照说明书的步骤在实时荧光定量PCR仪上进行qPCR分析,依据2-ΔΔCt算法处理数据。以烟草26S rRNA基因作为内参对照,引物序列为26S rRNA-qF:5'-CAAGGAAATCACCGCTTTGG-3',26S rRNA-qR:5'-CAAGGAAATCACCGCTTTGG-3'。每个样本设置3个生物学重复、3个技术重复。
1.2.5 启动子序列分析 利用PlantCARE在线分析软件(http://bioinformatics.psb.ugent.be/webtools/ plantcare/html/)对ProNtabEXPA12启动子的DNA序列中潜在的顺式作用元件进行预测分析并绘制顺式元件的位置圖。
1.2.6 遗传转化 利用热击的方法将35S:NtabEXPA12和ProNtabEXPA12:GUS载体分别转入根癌农杆菌感受态LBA4404(适用烟草)和/或GV3101(适用拟南芥),利用农杆菌介导的叶盘法将35S:NtabEXPA12载体转化烟草,利用浸花法将ProNtabEXPA12:GUS载体转化拟南芥。利用潮霉素筛选阳性转基因植株。
1.2.7 启动子活性分析 取转基因拟南芥的幼苗和成株的器官或组织,如根、叶片和花等,利用北京华越洋生物科技有限公司(Huayueyang Biotech, Beijing)生产的GUS染色试剂盒并参照说明书的步骤进行GUS染色,利用解剖镜观察并拍照。利用H2O、NaCl、ABA和PEG6000溶液(模拟干旱)处理幼苗后利用上述方法对幼苗进行GUS染色,设置3次生物学重复,观察不同处理对GUS活性的影响。参照JEFFERSON[17]的方法进行定量分析。
1.2.8 亚细胞定位分析 利用热击的方法将35S:NtabEXPA12-GFP和35S:AtPIPG2-RFP载体转化GV3101感受态细胞,利用农杆菌介导的瞬时转化的方法注射本氏烟草的叶片,培养3 d后,利用激光共聚焦显微镜观察注射叶片中的绿色和红色荧光信号并拍照。
1.2.9 叶片及叶片表皮细胞大小测定 观察温室生长的K326和转基因K326烟株的生长发育情况,取团棵期中部叶片拍照并测量叶片的大小。同时,参照文献[18],在团棵期中部叶片背面涂抹指甲油并利用透明胶带将表皮组织分离,在普通光学显微镜下观察叶片表皮细胞的大小并拍照。利用ImageJ软件测量细胞面积。
1.2.10 种子萌发试验 将烟草种子消毒后,点播于分别添加了0.2、0.8 μmol/L ABA和100、150 mmol/L NaCl的MS培养基上,待种子露白时统计种子的发芽率。每个处理设置3次重复,每个重复点播100粒种子。
1.2.11 干旱胁迫试验 将烟草种子播种于苗穴中,放置于温室自然光条件下生长。在30 d时对幼苗一次性浇足水后进行干旱处理,30 d后复水,并于复水两周后观察烟苗的生长情况并拍照。
2 结 果
2.1 NtabEXPA12的表达模式分析
由表1可以看出,在不同发育时期的组织中,NtabEXPA12在幼苗期和旺长期叶片中的表达量最高,其次是打顶后第5、10和15位叶片,而在根和茎中的表达量相对较低。此外,它在腋芽中也有相对较高的表达量。幼苗在受低温胁迫时,NtabEXPA12的表达量提高了约16倍;幼苗受干旱胁迫时,其表达量在干旱胁迫第2天达到峰值,随后迅速下降。
利用实时荧光定量PCR对NtabEXPA12在烟叶中的表达进行进一步验证,结果表明,相较于其他组织,NtabEXPA12在烟草不同发育时期的叶片中呈现较高的表达量(图1)。这些结果表明NtabEXPA12具有调控叶片生长发育的功能,在调控烟叶结构中具有潜在的应用价值。
2.2 ProNtabEXPA12启动子序列及顺式调控元件分析
通过克隆和测序获得了NtabEXPA12起始密码子ATG上游1500 bp的启动子序列,命名为ProNtabEXPA12(图2)。对该DNA片段中潜在的顺式元件进行预测,结果表明其包含多个响应高盐(如GT-1)、干旱(如MYC和MYB)及植物激素(如响应ABA的ABRE、响应JA的CGTCAT和响应SA的SARE)等的调控元件(图2),说明NtabEXPA12及其启动子可能在烟草响应非生物胁迫中发挥重要作用。ProNtabEXPA12含有的主要顺式调控元件的位置、序列和可能的功能见表2。
2.3 NtabEXPA12的亚细胞定位
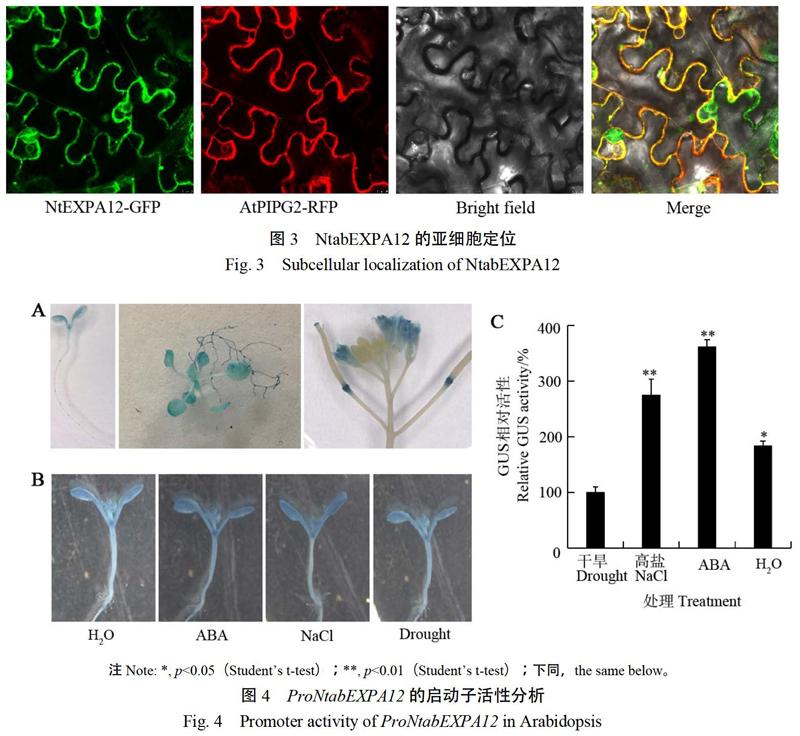
膨胀素属于一类细胞壁蛋白,参与细胞壁结构的重塑[19]。在本氏烟草叶片中瞬时表达NtabEXPA12-GFP融合蛋白,利用激光共聚焦显微镜检测NtabEXPA12的亚细胞定位,结果表明GFP的绿色荧光信号与AtPIPG2-RFP的红色荧光信号重叠(图3)。AtPGIP2是一个已知的细胞壁蛋白[20],二者的共定位说明NtabEXPA12定位于细胞壁上。
2.4 ProNtabEXPA12的启动子活性分析
获得了稳定表达ProNtabEXPA12:GUS的拟南芥转基因株系。对转基因株系不同发育时期、不同组织进行GUS化学染色检测ProNtabEXPA12启动子的表达偏好,结果表明在拟南芥中该启动子可以广泛表达,如在幼苗的叶片、莲座叶、根及花中均有表达(图4A)。
进一步利用高盐、干旱等非生物胁迫和植物激素ABA处理转基因拟南芥幼苗,然后对幼苗进行组织化学染色,结果表明与水处理对照相比在高盐、干旱和ABA处理时幼苗的GUS活性显著升高(图4B和C),说明ProNtabEXPA12的活性受到高盐、干旱和ABA的强诱导,这与该启动子中含有相关响应元件的分析结果一致。
2.5 过表达NtabEXPA12对烟草生长发育的调控
在K326基因组克隆了NtabEXPA12基因的编码序列(图5A),并构建了CaMV 35S启动子驱动NtabEXPA12的表达载体(图5B),获得了稳定表达Pro35S:NtabEXPA12的烟草转基因株系(图5C)。对转基因株系进行分子检测,结果表明株系6(OE-6)和OE-11中NtabEXPA12基因转录本的丰度较WT明显提高(图5D)。进一步对转基因株系进行表型观察,发现与野生型相比过表达NtabEXPA12能显著提高烟株长势(图5C)、促进烟叶扩展(图5E)并增加叶片面积(图5F)。对团棵期中部叶片表皮细胞进行显微观察,结果表明OE-6和OE-11叶片表皮细胞的面积较WT显著增大(图5F和G),说明NtabEXPA12通过促进细胞的扩展调控烟叶等器官的生长。
2.6 过表达NtabEXPA12对转基因烟草抗旱和耐盐性的影响
2.6.1 过表达NtabEXPA12对烟草耐盐性的影响 植物激素ABA在盐胁迫防御中发挥着不可替代的作用[21]。前面的分析结果显示ProNtabEXPA12中包含多个响应ABA信号的ABRE元件,推测NtabEXPA12参与烟草对高盐胁迫的响应。为进一步验证NtabEXPA12的功能,利用ABA处理烟草种子并进行萌发试验(图6A),结果表明在对照组水处理中,K326和转基因株系的种子萌发率均在90%以上,且差异不显著。ABA处理能显著抑制对照K326的种子萌发,其在0.2 μmol/L ABA處理时萌发率约为60%,在0.8 μmol/L ABA处理时萌发率仅为约15%;而OE-6和OE-11的种子萌发率均在70%左右(图6B),说明过表达NtabEXPA12能抑制转基因植株对ABA的敏感性,提高种子发芽率。进一步利用不同浓度的NaCl对种子进行处理,发现100 mmol/L NaCl处理条件下,对照K326种子已经少有萌发,而OE-6和OE-11的种子萌发率仍然达到50%和25%;150 mmol/L NaCl处理条件下,对照K326种子不萌发,而仍然有5%左右的OE-6和OE-11转基因种子可以萌发(图6),说明过表达NtabEXPA12能显著提高转基因烟草对高盐的耐受性。
2.6.2 过表达NtabEXPA12对烟草抗旱性的影响 对穴栽烟苗进行了干旱和复水处理,结果表明干旱处理30 d后K326和OE-11转基因烟苗均表现失水萎蔫、叶片退绿干枯的现象;复水14 d后,OE-11重新长出了新叶,而K326仍然表现为接近死亡的状态(图7),说明过表达NtabEXPA12提高了转基因烟草的抗旱性及干旱条件下烟苗的存活率。
3 讨 论
叶片结构是影响烟草品质的关键因素之一,而关于如何在分子水平上调控和改善烟叶结构的研究仍然较少。植物细胞壁松弛因子膨胀素能够调节细胞壁多糖组份之间的交联程度,通过对细胞壁的物理结构进行重塑参与包括叶片扩展等植物生长发育的多个方面[7-11],因而是进行烟叶结构调控的潜在靶标[22]。我们前期在烟草基因组中鉴定了52个EXP基因,并发现一些EXPs在烟草叶片中偏好表达,是参与烟叶发育的潜在调控因子[23]。因此,对它们进行进一步的功能研究,有助于了解烟叶发育的分子机制,并为烟叶结构的分子调控提供理论支撑。
本研究克隆了一个烟草膨胀素基因NtabEXPA12及其启动子,表达分析发现其在烟草叶片中具有较高的表达量,表明该基因可能参与烟叶生长发育调控。为研究NtabEXPA12的生物学功能,利用转基因技术获得了基因表达量显著增加的过表达株系OE-6和OE-11。通过温室试验发现,与野生型K326相比,过表达NtabEXPA12能够显著促进壮苗培育和叶片扩展。叶片发育受到细胞增殖与细胞体积增大的共同调节。研究认为,膨胀素通过破坏细胞壁结构多糖之间的非共价相互作用使细胞壁的结构变得松弛,引起细胞内部压力降低,而负压可以促进水分进入细胞从而增大细胞体积并使细胞的膨胀压力恢复平衡,完成细胞的扩张和器官体积/面积的增加[24]。为进一步探明过表达株系叶片表型形成的分子基础,通过叶片细胞显微检测,发现NtabEXPA12以促进细胞体积增大的方式促进烟草叶片的扩展。
研究表明,膨胀素能通过调控细胞壁的结构,提高植物对干旱、盐和冷害等非生物胁迫的耐受性或抗性[12-14]。本研究在ProNtabEXPA12启动子序列中发现多个响应高盐、干旱及植物激素的顺式调控元件,并发现该启动子的活性受到高盐、干旱和ABA等的诱导。经过进一步试验验证发现过表达NtabEXPA12能够促进种子在盐胁迫和含ABA培养基上的萌发率,并提高极端干旱胁迫条件下转基因植株的存活率,这与以往的研究结果[12-14]一致。以上结果说明,NtabEXPA12及其启动子在烟草抵御逆境中起到正向调控作用。然而关于NtabEXPA12基因的转录调控模式等问题仍需更加深入的研究。
综上,膨胀素既有促进烟叶发育的作用,又能提高烟株的抗逆性,因此是烟草生物育种中理想的调控对象。然而,过表达NtabEXPA12的转基因烟草由于叶片结构改变,可能会对烟叶的品质造成影响。已有的研究结果表明,膨胀素可以松弛细胞壁的网络结构,使细胞壁的结构变得疏松[2,25-26],从而有利于柔软烟叶的形成和提高烟叶品质。该推测还有待于對转基因烟草进行品质评价来进一步验证。
4 结 论
本研究克隆并初步验证了一个烟草膨胀素基因NtabEXPA12及其启动子的结构和功能。结果表明ProNtabEXPA12含有多个响应高盐、干旱及植物激素的顺式调控元件,且其表达受到干旱、高盐胁迫和ABA的诱导。在K326中过表达NtabEXPA12能通过促进细胞体积增大的方式促进烟叶扩展,并能提高转基因烟草种子在逆境条件下的萌发率,提高转基因植株对高盐、干旱等非生物胁迫的抗性。因此,本研究为烟草叶片发育调控和抗逆分子育种提供了重要的理论依据。
参考文献
[1]张保才,周奕华. 植物细胞壁形成机制的新进展[J]. 中国科学:生命科学,2015,45(6):544-556.
ZHANG B C, ZHOU Y H. Plant cell wall formation and regulation[J]. Scientia Sinica Vitae, 2015, 45(6): 544-556.
[2]COSGROVE D J. Cell wall loosening by expansins[J]. Plant Physiology, 1998, 118(2): 333-339.
[3]WOLF S, MOUILLE G, and PELLOUX J. Homogalacturonan methyl-esterification and plant development[J]. Molecular Plant, 2009, 2(5): 851-860.
[4]黄成,李来庚. 植物细胞壁研究与生物质改造利用[J]. 科学通报,2016,61(34):3623-3629.
HUANG C, LI L G. Understanding of plant cell wall biosynthesis for utilization of lignocellulosic biomass resources[J]. Chinese Science Bulletin, 2016, 61(34): 3623-3629.
[5]HOFTE H, VOXEUR A. Plant cell walls[J]. Current Biology, 2017, 27(17): R865-R870.
[6]COSGROVE D J, LI Z C. Role of expansin in cell enlargement of oat coleoptiles (analysis of developmental gradients and photocontrol)[J]. Plant Physiology, 1993, 103(4): 1321-1328.
[7]YAN A, WU M, YAN L, et al. AtEXP2 is involved in seed germination and abiotic stress response in Arabidopsis[J]. PloS One, 2014, 9(1): e85208.
[8]ZOU H, WEN Y, ZANG G, et al. OsEXPB2, a β-expansin gene, is involved in rice root system architecture[J]. Molecular Breeding, 2015, 35: 41.
[9]CHOI D, LEE Y, CHO H T, et al. Regulation of expansin gene expression affects growth and development in transgenic rice plants[J]. The Plant Cell, 2003, 15(6): 1386-1398.
[10]BRUMMELL D A, HARPSTER M H, DUNSMUIR P. Differential expression of expansin gene family members during growth and ripening of tomato fruit[J]. Plant Molecular Biology, 1999, 39(1): 161-169.
[11]HIWASA K, ROSE J K, NAKANO R, et al. Differential expression of seven alpha-expansin genes during growth and ripening of pear fruit[J]. Physiologia Plantarum, 2003, 117(4): 564-572.
[12]LI W, WANG F, WANG J, et al. Overexpressing CYP71Z2 enhances resistance to bacterial blight by suppressing auxin biosynthesis in rice[J]. PloS One, 2015, 10(3): e0119867.
[13]LU P, KANG M, JIANG X, et al. RhEXPA4, a rose expansin gene, modulates leaf growth and confers drought and salt tolerance to Arabidopsis[J]. Planta, 2013, 237(6): 1547-1559.
[14]GEILFUS C M, OBER D, EICHACKER L A, et al. Down-regulation of ZmEXPB6 (Zea mays β-expansin 6) protein is correlated with salt-mediated growth reduction in the leaves of Z. mays L.[J]. The Journal of Biological Chemistry, 2015, 290(18): 11235-11245.
[15]LI X, ZHAO J, TAN Z, et al. GmEXPB2, a cell wall β-expansin, affects soybean nodulation through modifying root architecture and promoting nodule formation and development[J]. Plant Physiology, 2015, 169(4): 2640-2653.
[16]HARMER S E, ORFORD S J, TIMMIS J N. Characterisation of six alpha-expansin genes in Gossypium hirsutum (upland cotton)[J]. Molecular Genetics and Genomics, 2002, 268(1): 1-9.
[17]JEFFERSON R A. Assaying chimeric genes in plants: the GUS gene fusion system[J]. Plant Molecular Biology Reports, 1987, 5: 387-405.
[18]侯蕾,陳龙俊. 盐胁迫对拟南芥叶片和下表皮细胞大小的影响[J]. 安徽农业科学,2011,39(13):7615-7616.
HOU L, CHEN L J. Effects of salt stress on epidermal cell expansion in leaves of Arabidopsis thaliana[J]. Journal of Anhui Agricultural Science, 2011, 39(13): 7615-7616.
[19]COSGROVE D J. Loosening of plant cell walls by expansins[J]. Nature, 2000, 407(6802): 321-326.
[20]DE CAROLI M, MANNO E, PERROTTA C, et al. CesA6 and PGIP2 endocytosis involves different subpopulations of TGN-related endosomes[J]. Frontiers in Plant Science, 2020, 11: 350.
[21]WASKIEWICZ A, BESZTERDA M, GOLINSKI P. ABA: role in plant signaling under salt stress[M]//AHMAD P, AZOOZ M M, PRASAD M N V. Salt stress in plants (eds). New York: Springer, 2013: 157-173.
[22]MAROWA P, DING A M, KONG Y Z. Expansins: roles in plant growth and potential applications in crop improvement[J]. Plant Cell Reports, 2016, 35(5): 949-965.
[23]DING A M, MAROWA P, KONG Y Z. Genome-wide identification of the expansin gene family in tobacco (Nicotiana tabacum)[J]. Molecular Genetics and Genomics, 2016, 291(5): 1891-1907.
[24]COSGROVE D J. Growth of the plant cell wall[J]. Nature Reviews Molecular Cell Biology, 2005, 6(11): 850-861.
[25]TAIZ L. Expansins: proteins that promote cell wall loosening in plants[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(16): 7387-7389.
[26]COSGROVE D J. Plant expansins: diversity and interactions with plant cell walls[J]. Current Opinion in Plant Biology, 2015, 25: 162-172.
