早产儿自发性肠穿孔临床研究
2021-09-13杨慧洁王政力
杨慧洁 王政力 邓 春
重庆医科大学附属儿童医院新生儿科 儿童发育疾病研究教育部重点实验室 国家儿童健康与疾病临床医学研究中心 儿童发育重大疾病国家国际科技合作基地 儿科学重庆市重点实验室(重庆 400014)
新生儿自发性肠穿孔(spontaneous intestinal perforation,SIP)是仅次于坏死性小肠结肠炎(necrotizing enterocolitis,NEC)的新生儿期严重的胃肠道疾病,是无明显诱因下发生于胃肠道的单个穿孔,或少见的多个穿孔,常见于回肠末端[1]。SIP最常发生在极低出生体质量(very low birth weight,VLBW)儿和超低出生体质量(extremely low birth weight,ELBW)儿中。国外报道,VLBW 新生儿SIP发生率为2.0%,ELBW 新生儿为2.4%~3.6%,病死率为12.4%~39.1%[2-3],需要外科手术治疗者甚至高达50.0%[4],存活者往往可能并发短肠综合征、肠狭窄。此外,SIP 还可导致患儿远期神经发育障碍[5]。
SIP曾被认为是NEC的特殊类型,但随着研究进展,越来越多的证据表明,SIP 是一种不同于NEC 的独立临床疾病,但目前SIP 的病因及危险因素尚不明确。本文采用回顾性病例对照研究,旨在了解早产儿SIP的临床特征,探讨影响SIP发生的危险因素,为减少早产儿SIP的发生提供临床依据。
1 对象与方法
1.1 研究对象
以2010 年1 月至2020 年6 月于重庆医科大学附属儿童医院新生儿诊治中心住院的早产儿为研究对象,其中符合SIP诊断标准的为SIP组。SIP诊断标准:手术证实存在一个或多个孤立的局限性肠穿孔,穿孔周围肠管正常,组织病理学改变未发现NEC证据。SIP组纳入标准:①胎龄<37周;②校正胎龄至42周,发病日龄仍≤28天,影像学证实有消化道穿孔;④通过外科手术确诊SIP。
随机抽取同期、同胎龄、无肠道穿孔的患儿为对照组。两组患儿均排除其中具有重大先天缺陷(如食道闭锁、膈疝、胃肠道发育畸形、严重先天性心脏病等)或存活时间<2天的患儿。
1.2 方法
收集入选患儿住院期间的临床资料。一般情况:胎龄,出生体质量,性别,分娩方式,穿孔日龄,是否为小于胎龄儿(small for gestational age,SGA)、试管婴儿、双胎;出生情况:有无脐带、胎盘、羊水异常,1分钟和5分钟Apgar评分;母孕期情况:母亲孕龄,有无产前使用地塞米松、硫酸镁,有无子痫前期、孕期贫血、妊娠期糖尿病、绒毛膜羊膜炎、胎膜早破≥18 小时;临床表现:有无发热、体温不升、低血压、腹胀、呕吐、胃潴留、血便;新生儿合并症或并发症:穿孔前是否有动脉导管未闭(patent ductus arteriosus,PDA)、Ⅲ级及以上脑室周围-脑室内出血(periventricleintraventricular hemorrhage,PIVH)、早发性败血症、高胆红素血症、感染性休克、低蛋白血症、贫血;治疗措施:是否生后3天内肠道喂养,有无脐静脉置管,是否1周内使用多巴胺或多巴酚丁胺[5~10 μg/(kg·min)]持续24小时以上,是否1周内使用无创呼吸机,穿孔前是否口服布洛芬、换血、输血等。
1.3 统计学分析
采用SPSS 26.0统计软件进行数据处理。符合正态分布的计量资料以均数±标准差表示,两组间比较采用两独立样本t检验;非正态分布计量资料以中位数(四分位数间距)表示,组间比较采用秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2、校正χ2检验或Fisher 精确概率法检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
2010 年1 月至2020 年6 月共收治21 263 例早产儿,其中28 例(0.13%)符合SIP 组纳入标准,为SIP组,男14 例、女14 例,穿孔日龄8.5(2.5~11.0)天;胎龄(32.9±2.5)周,范围28~37 周;出生体质量(1 831.5±475.2)g,范围800~3 100 g;同时纳入对照组61 例,男36 例、女25 例,胎龄(33.2±2.6)周,范围28~37周;出生体质量(1 869.5±493.8)g,范围900~3 000 g。比较两组早产儿的胎龄、出生体质量、性别、分娩方式、SGA、试管婴儿、双胎、脐带异常、胎盘异常、羊水异常、1分钟和5分钟Apgar评分、母亲孕龄、产前使用地塞米松或硫酸镁、子痫前期、孕期贫血、妊娠期糖尿病、绒毛膜羊膜炎、胎膜早破≥18 小时等情况,差异均无统计学意义(P>0.05)。见表1。

表1 SIP与对照组临床资料比较
胎龄28~37周早产儿共18 578例;胎龄28~31+6周、32~33+6周、34~36+6周的SIP发生率分别为0.40%(9/2247)、0.15%(4/2753)、0.11%(15/13578),差异有统计学意义(Fisher 精确概率法,P=0.008)。出生体质量800~3 100 g 早产儿16 679 例;出生体质量800~999 g、1 000~1 499 g、1 500~2 499 g、2 500~3 100 g的SIP发生率分别为0.70%(1/142)、0.30%(6/1986)、0.19%(19/9967)、0.04%(2/4584),差异有统计学意义(Fisher精确概率法,P=0.012)。
2.2 临床表现
SIP组患儿发生穿孔的中位日龄为8.5(2.5~11.0)天,穿孔部位为回肠末端15例(53.6%),此外有2例为回肠多发穿孔。SIP组主要临床表现为腹胀的27例、低血压19例及血便16例,其次为发热14例、呕吐9例和胃潴留9 例。与对照组对比,SIP 组腹胀、血便的发生率更高,差异有统计学意义(P<0.05)。见表2。
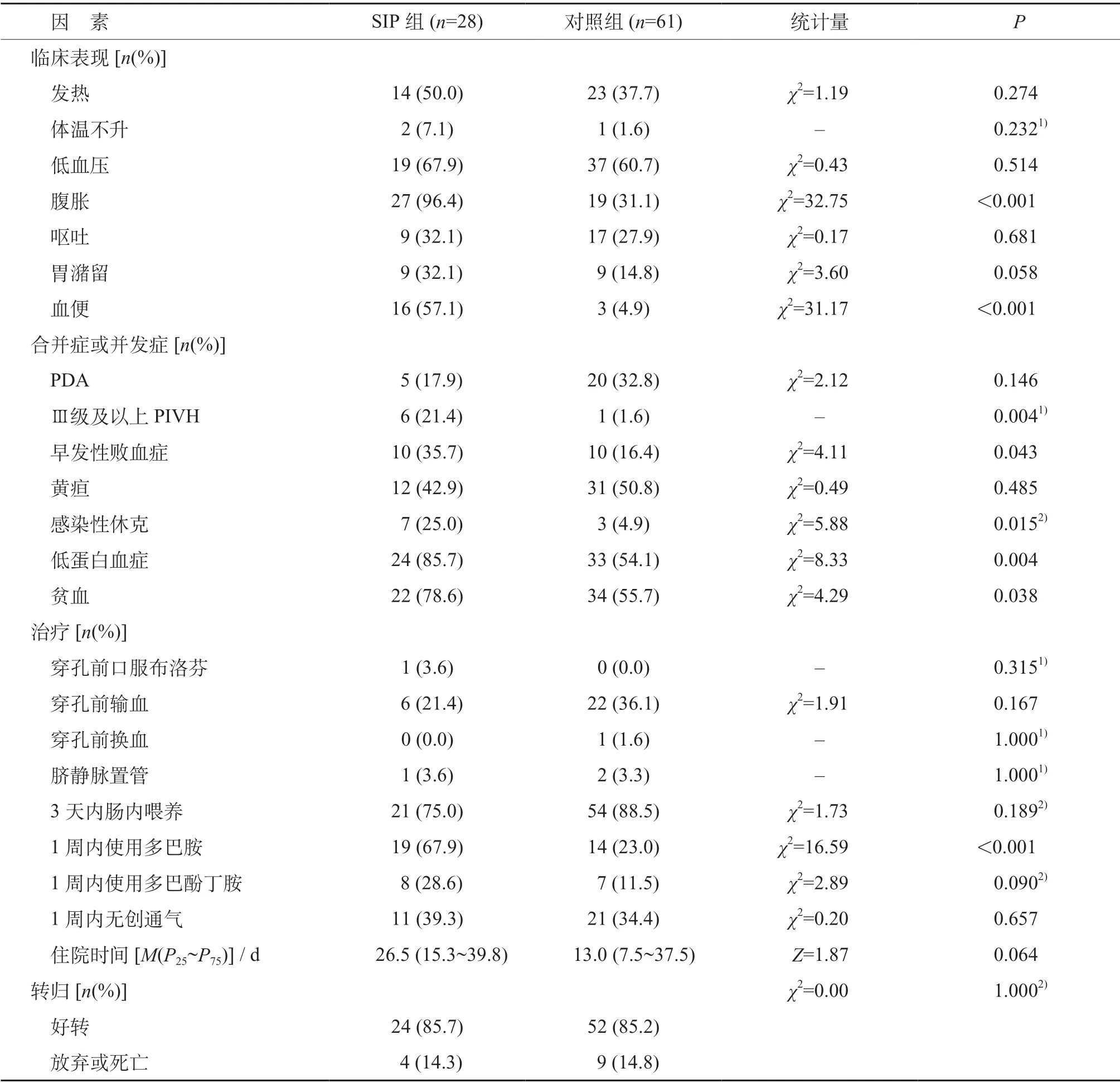
表2 SIP组与对照组临床表现、合并症或并发症、治疗及预后比较
2.3 合并症或并发症
SIP 组患儿在穿孔前或穿孔时更易合并Ⅲ级及以上的PIVH、早发性败血症、感染性休克、低蛋白血症和贫血,与对照组比较差异均有统计学意义(P<0.05)。见表2。
2.4 治疗及预后
SIP组1周内多巴胺使用率高于对照组,差异有统计学意义(P<0.05)。两组间穿孔前脐静脉置管、口服布洛芬、1 周内无创通气、1 周内使用多巴酚丁胺、输注血液及血液制品、3 天内肠内营养的差异均无统计学意义(P>0.05)。SIP 组中有4 例放弃后死亡,其余24例均好转出院,预后情况与对照组比较差异无统计学意义(P>0.05)。见表2。
3 讨论
SIP的临床表现多不典型,既往研究显示,SIP常见症状包括腹胀、腹壁变蓝、低血压、高血糖、呼吸状态改变等[6],且腹部X 线检查多提示有气腹征象。本研究显示,SIP早产儿出现腹胀、便血的比例显著高于对照组,且腹部X 线片均显示气腹。因此,对于出现腹胀、血便的早产儿,应及时进行腹部影像学检查以明确有无SIP,以便尽早治疗。目前已有研究显示,早产、低出生体质量是SIP 发生的危险因素[7]。研究报道,胎龄≤32周早产儿中SIP发生率为3.3%,中位胎龄为26周,平均出生体质量为911 g[7]。也有研究表明,SIP的发生与胎龄、出生体质量呈反比[8];患儿胎龄越小,肠壁固有肌层越薄,越易发生穿孔[9]。本研究中早产儿的SIP 发生率较低,考虑与SIP 组患儿胎龄相对较大有关。
研究报道,缺氧、Ⅲ级及以上PIVH、低血压、脐静脉置管、PDA等可增加SIP的发生风险[6-7]。通常情况下肠道血流丰富,但当发生缺氧、低血压、休克等影响血液动力学的情况时,血液供应会优先满足心脏、脑等重要器官的需要,限制肠道血流灌注,导致肠道缺氧缺血,损伤肠道黏膜,发生SIP。脐静脉置管可能引起空气进入脐静脉,形成空气栓子,阻塞肠系膜血管从而造成肠穿孔。在本研究中,Ⅲ级及以上PIVH、感染性休克、贫血是SIP发生的危险因素,而低血压、脐静脉置管、PDA 在两组间无显著差异,这可能与本研究中样本量较少有关。治疗低血压的正性肌力药,其对血管的收缩作用也可对局部肠壁血流造成影响,触发SIP[10]。曾有研究表明,使用多巴胺是SIP发生的危险因素[11]。但目前尚不清楚其是否是因为肠道灌注不足,还是由于多巴胺的使用。
既往研究表明,出生后24 小时内预防性应用吲哚美辛可导致SIP发生[12],这可能是因为吲哚美辛可减少肠系膜动脉的血流速度,造成肠道缺血损伤。出生24小时后使用吲哚美辛治疗PDA,也可能增加SIP风险;因为严重PDA 会影响血流动力学引起肠道缺血,而同时使用吲哚美辛会进一步减少肠道血流供应[13]。但也有研究显示,预防性及治疗使用吲哚美辛均并不会增加SIP的发生率。布洛芬作为另一种环氧化酶抑制剂,与吲哚美辛一样,可用于促进PDA的关闭,且与吲哚美辛相似,可增加早产儿发生SIP 的风险[14]。在本研究中,口服布洛芬的患儿少,故两组间无显著差异,且本研究中暂无使用吲哚美辛关闭PDA 的病例,需进一步扩大样本量研究。此外,研究报道在VLBW 儿或ELBW 儿中,生后72 小时内开始喂养具有保护作用,可使SIP 的发生风险显著降低[15]。而本研究显示,早期喂养与SIP 发生无关。
研究发现,与无肠穿孔的早产儿相比,患有SIP的早产儿更易合并或并发早发性败血症、低蛋白血症。一方面,可能是因为感染产生大量内毒素及多种炎症介质如肿瘤坏死因子、白介素等,导致肠黏膜的缺血损伤和血浆白蛋白生成减少[16];另一方面,SIP 患儿发生肠道穿孔,造成肠黏膜损伤,进一步引起肠道菌群移位,从而造成肠源性败血症。目前,关于感染到底是SIP穿孔的原因还是结果,仍需进一步探讨。
研究报道,产前硫酸镁的使用可能与早产儿SIP发生有关,其可能的机制是镁可以影响平滑肌的收缩力,引起肠道蠕动减慢及粪便潴留,同时可导致肠系膜动脉阻力增加及肠系膜血流减少,且镁的抗胆碱能作用可进一步降低肠动力[17]。但也有针对极早早产儿的研究显示,产前硫酸镁使用不会增加肠道损伤,且高剂量的硫酸镁可以减少SIP 或NEC 的发生[18-19]。本研究中并未发现产前硫酸镁的使用是SIP的高危因素。目前,关于产前硫酸镁使用与早产儿SIP的发生仍有待进一步研究。既往研究表明,SIP 可能是与胎盘炎症有关的新生儿疾病;另外,产前或产时血流动力学障碍可导致短暂的胎儿缺氧缺血发作,虽然可能不会造成死亡,但可以对未成熟的肠道关键区域造成不可逆的损害,导致早产儿肠道适应能力受损的发生[20]。在本研究中,SIP 组患儿1 分钟或5 分钟Apgar 评分,脐带、胎盘、羊水异常,母孕期绒毛膜羊膜炎,子痫前期,贫血,妊娠期糖尿病,胎膜早破≥18小时,产前使用地塞米松,与对照组相比均无显著差异。
此外,产后早期使用糖皮质激素可增加SIP 的发病风险。在一项meta分析中纳入4项使用地塞米松预防支气管肺发育不良(bronchopulmonary dysplasia,BPD)的研究,结果显示与对照组相比,出生后48 小时内接受地塞米松治疗的VLBW 儿发生SIP 的风险增加(OR=1.91,95%CI:1.21~3.07)[21]。本研究中,生后1周内使用地塞米松防治BPD的病例较少,限于SIP例数少,故早期糖皮质激素应用是否为SIP高危因素有待进一步研究。
综上,Ⅲ级及以上的PIVH、早发性败血症、感染性休克、低蛋白血症、贫血、1周内使用多巴胺可能是SIP的危险因素。
