响应面法优化山慈菇多糖的水提醇沉法工艺
2021-09-13肖秋肖肖红琴康宁芳巩仔鹏王爱民李勇军李月婷
王 静,肖秋肖,肖红琴,康宁芳,巩仔鹏,郑 林,王爱民,李勇军,黄 勇,李月婷*
(1. 贵州医科大学 贵州省药物制剂重点实验室/省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550004;2. 贵州医科大学 药学院,贵州 贵阳 550004;3. 贵州医科大学 民族药与中药开发应用教育部工程研究中心,贵州 贵阳 550004)
0 引言
【研究意义】山慈菇又名毛慈菇,为兰科植物杜鹃兰[Cremastraappendiculata(D. Don) Makino]、独蒜兰[Pleionebulbocodioides(Franch) Rolfe]和云南独蒜兰[PleioneyunnanensisRolfe]的干燥假鳞茎[1],主要分布在贵州、山西、陕西、甘肃、四川等地区,是我国的濒危药用植物[2]。山慈菇中含有黄酮类、生物碱、酚类、糖类等多种化合物[3-5],具有抗肿瘤、抗炎、抗菌、抗血管生成、降低血压血糖等多种药理活性[5-9]。多糖作为山慈菇中的一种天然活性成分,因其具有的多种生物活性(降血脂、抗肿瘤、提高免疫功能)和无毒无害、无抗药性等作用[10],近年来已成为多个行业(食品、农业、医药)关注的焦点。开展山慈菇活性物质提取方面的研究,对进一步促进其在食品加工、生物制药等方面的开发应用具有现实意义。【前人研究进展】目前,提取多糖的新兴工艺主要有超声辅助提取法、酶提取法、超临界流体萃取法等[11-19]。其中超声辅助提取法反应速度快,但只适用于物理稳定性的药材;而酶提取法虽提取率高,但要求酶活力很高,且酶的价格昂贵。【研究切入点】山慈菇多糖的提取工艺鲜有报道,而酶法和超临界流体萃取法要求高、成本高、难以普遍使用;超声波辅助提取法威力过大又容易破坏多糖结构[20]。相比之下,传统的水提醇沉法具有操作简单、成本低、对多糖结构影响小等优点。【拟解决的关键问题】鉴于目前山慈菇多糖提取工艺的研究状况,拟采用经典方法(水提醇沉)对山慈菇的多糖类物质进行提取,为山慈菇多糖进一步应用于食品、医药领域奠定基础。
1 材料与方法
1.1 材料与仪器
1.1.1 山慈菇 购自毫州市永刚饮片厂有限公司。
1.1.2 试剂 无水-D葡萄糖对照品,贵州省贵阳市凯信生物工程有限公司;乙醇、苯酚、浓硫酸等,国产分析纯,均为市购。
1.1.3 仪器设备 FW100高速万能粉碎机,天津市泰斯特仪器有限公司;DK-98-II电热恒温水浴锅,天津市泰斯特仪器有限公司;EL-204电子分析天平,梅特勒-托利多仪器(上海)有限公司;ALLEGRA X-30A离心机,贝克曼库尔特有限公司;UV-2700紫外分光光度计,岛津仪器(苏州)有限公司。
1.2 方法
1.2.1 山慈菇多糖的提取流程 干燥山慈菇药材→粉碎机粉碎→过40目筛(山慈菇粉末)→水浴锅回流提取→转移至容量瓶中定容,过滤→取滤液→加乙醇进行多糖沉淀→冷冻→离心(10 000 r/min,5 min)→取多糖沉淀→真空干燥→山慈菇粗多糖。
1.2.2 山慈菇多糖含量的测定
1) 绘制标准曲线。采用苯酚硫酸法测定山慈菇多糖含量[21]。先配制100 μg/mL的葡萄糖对照品溶液,存于4℃冰箱备用。精密吸取0.2 mL、0.4 mL、0.6 mL、0.8 mL、1 mL上述溶液于5支1 mL的已编号试管中,不足1 mL的加水补足,轻轻晃荡,快速加入5%苯酚溶液1 mL和浓硫酸5 mL,摇匀,将具塞试管置于沸水中保温20 min,取出冷却,在490 nm处测吸光度值,绘制标准曲线,拟合吸光度(y)与多糖浓度(x)的回归方程。
2) 测定山慈菇样品多糖含量。称取0.5 g山慈菇粉末回流提取120 min,将提取液转至量瓶中定容,过滤,在滤液中加醇使醇含量为80%,4℃冰箱醇沉过夜,取出,以10 000 r/min的速度离心5 min,取沉淀放于量瓶中定容,取1 mL置试管中,按上述方法进行山慈菇多糖显色并测定其吸光度,计算多糖的提取率。
提取率=(CVN/m)×100%
式中,C为待测溶液葡萄糖的浓度(μg/mL),V为待测溶液体积(mL),N为稀释倍数,m为山慈菇粉末质量(g)。
1.2.3 山慈菇多糖的提取因素
1) 固液比。称取5份0.5 g山慈菇粉末分别置于5个锥形瓶中,分别按固液比(g∶mL)为1∶20、1∶30、1∶40、1∶50、1∶60加入不同比例的水,沸水浴回流120 min,提取液转至量瓶中定容至50 mL,过滤,分别加95%醇使终浓度含醇量达80%,4℃醇沉过夜备用,3次重复。
2) 提取温度。称取5份0.5 g山慈菇粉末分别置于5个锥形瓶中,按固液比1∶30 加入水,分别在60℃、70℃、80℃、90℃和100℃等不同提取温度下回流提取120 min,提取液转至量瓶中定容至50 mL,过滤,分别加95%醇使终浓度含醇量达80%,4℃醇沉过夜备用,3次重复。
3) 提取时间。称取5份0.5 g山慈菇粉末分别置于5个锥形瓶中,按固液比1∶30加入水,沸水浴中分别回流提取30 min、60 min、90 min、120 min和150 min,提取液转至量瓶中定容至50 mL,过滤,分别加95%醇使终浓度含醇量达80%,4℃醇沉过夜备用,3次重复。
4) 醇沉浓度。称取5份0.5 g山慈菇粉末分别置于5个锥形瓶中,按固液比1∶30加入水,沸水浴回流120 min,提取液移至量瓶中定容至50 mL,过滤,分别加入95%醇使终浓度达70%、75%、80%、85%和90%,4℃冰箱醇沉过夜备用,3次重复。
1.2.4 Box-Behnken试验设计优化提取工艺 根据单因素试验结果结合BOX-Behnken Design设计原理,以固液比、提取温度和提取时间为考察对象,多糖提取率为响应值,运用Design-Expert 8.0.6 进行33的响应面优化试验,以确定山慈菇多糖的最佳提取条件,试验编码详见表1。根据响应面优化试验结果使用Design-Expert 8.0.6进行多元回归拟合。通过响应曲面图和等高线图可反映固液比、提取温度、提取时间对山慈菇多糖提取率的影响,也可同时反应影响因素间的相互作用。响应曲面图曲线越弯越陡,说明该条件对响应值影响越大;反之曲线越平,说明该条件对响应值的影响越小。等高线反应因素间的交互强弱,等高线越密集,呈椭圆状,表示交互越明显,反之则表示交互不明显[22]。
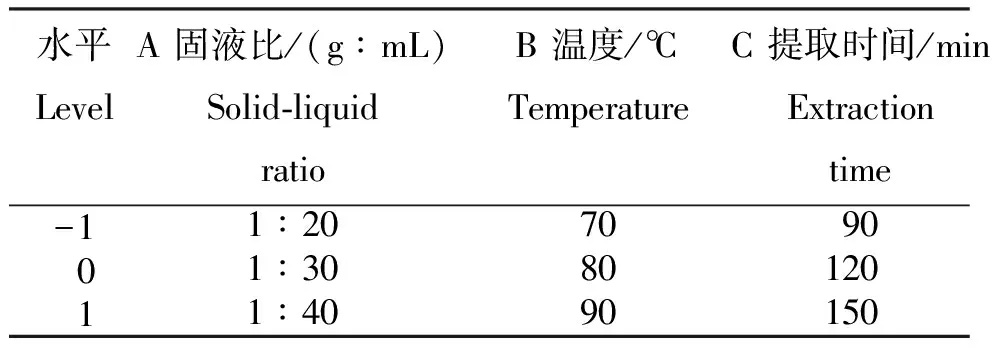
表1 山慈菇多糖提取的山慈菇多糖提取的响应面试验因素与水平
1.3 统计分析
试验所得数据用Design-Expert 8.0.6和Spss进行处理和分析。
2 结果与分析
2.1 山慈菇多糖的标准曲线
在490 nm处测得不同浓度吸光度值,以吸光度(y)为纵坐标,多糖浓度(x)为横坐标绘制得到标准曲线(图1)。经拟合得回归方程:y=0.068 5x+0.038,R2=0.998 5。说明多糖浓度在2.857~14.286 μg/mL时吸光度与多糖浓度存在良好的线性关系。
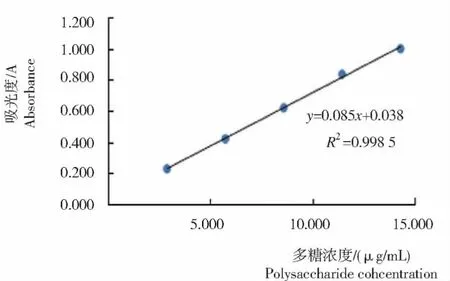
图1 山慈菇多糖的标准曲线
2.2 不同提取条件山慈菇多糖的提取率
从图2可知,固液比、提取温度、提取时间和醇沉浓度等不同提取条件山慈菇多糖的提取率存在差异。
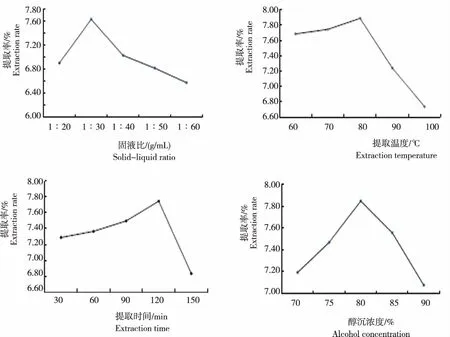
图2 不同提取条件山慈菇多糖的提取率
2.2.1 固液比 随着固液比的增加,山慈菇多糖的提取率呈先增后减趋势,提取率为6.58%~7.63%,其中,固液比为1∶30时多糖提取率最高,1∶40时其次,1∶60时最低,依次为1∶30>1∶40>1∶20>1∶50>1∶60。在固液比1∶30时,多糖的提取率达最大,表明提取山慈菇多糖固液比以1∶30为宜。原因可能是固液比小时,山慈菇多糖溶出不充分;而固液比过大时,受溶解度的影响,山慈菇多糖的提取率变低[23]。因而,选取固液比为1∶20、1∶30和1∶40进行后续试验。
2.2.2 提取温度 山慈菇多糖的提取率随温度升高呈先增后减趋势,提取率为6.74%~7.89%,其中,提取温度为80℃时多糖提取率最高,70℃时其次,100℃时最低,依次为80℃>70℃>60℃>90℃>100℃。温度为80℃时山慈菇多糖的提取率最大,表明提取温度以80℃为宜。原因可能是山慈菇多糖在一定温度范围内,溶解度增加,提取率增高,当温度超过适宜温度时,多糖结构遭到破坏,导致多糖提取率降低[24-25]。因而,选取提取温度为70℃、80℃和90℃进行后续试验。
2.2.3 提取时间 山慈菇多糖的提取率随提取时间延长呈先增后减趋势,提取率为6.83%~7.75%,其中,提取时长为120 min时多糖提取率最高,90 min时其次,150 min时最低,依次为120 min>90 min>60 min>30 min>150 min。在120 min时,山慈菇多糖的提取率最大,表明120 min为最佳提取时间。原因可能是山慈菇回流提取时间过短,多糖溶出不充分,提取率低;当提取时间过度延长时,溶液又达饱和状态,使得多糖溶出减少,且时间过长又会导致山慈菇的糖蛋白变性,析出沉淀,提取率变低[25]。因而,选取提取时间为90 min、120 min和150 min进行后续试验。
2.2.4 醇沉浓度 山慈菇多糖的提取率随醇沉浓度增加呈先增后减趋势,提取率为7.08%~7.85%,其中,醇沉浓度为80%时多糖提取率最高,85%时其次,90%时最低,依次为80%>85%>75%>70%>90%。在浓度为80%时,多糖提取率达最大,表明醇沉浓度以80%为宜。原因可能是一定范围内的醇沉浓度可以降低山慈菇多糖的溶解度,利于山慈菇多糖的沉淀;而当醇沉浓度过高时,会使一些杂质一起沉淀,从而导致多糖不纯,影响提取率[23]。
2.3 响应面试验优化提取工艺
2.3.1 Box-Behnken试验结果 从表2看出,17个处理山慈菇多糖提取率为6.89%~7.77%,其中,处理5和处理17,即固液比1∶30,提取温度80℃,提取时间120 min时山慈菇多糖提取率最高,均为7.77%;处理15、处理1和处理12的试验条件与处理5和处理17相同,但山慈菇多糖提取率稍低,为7.65%~7.75%。各处理山慈菇多糖提取率依次为处理5=处理17>处理15>处理1>处理12>处理14>处理3>处理6=处理16>处理4=处理8>处理13>处理11>处理9>处理2>处理10>处理7。
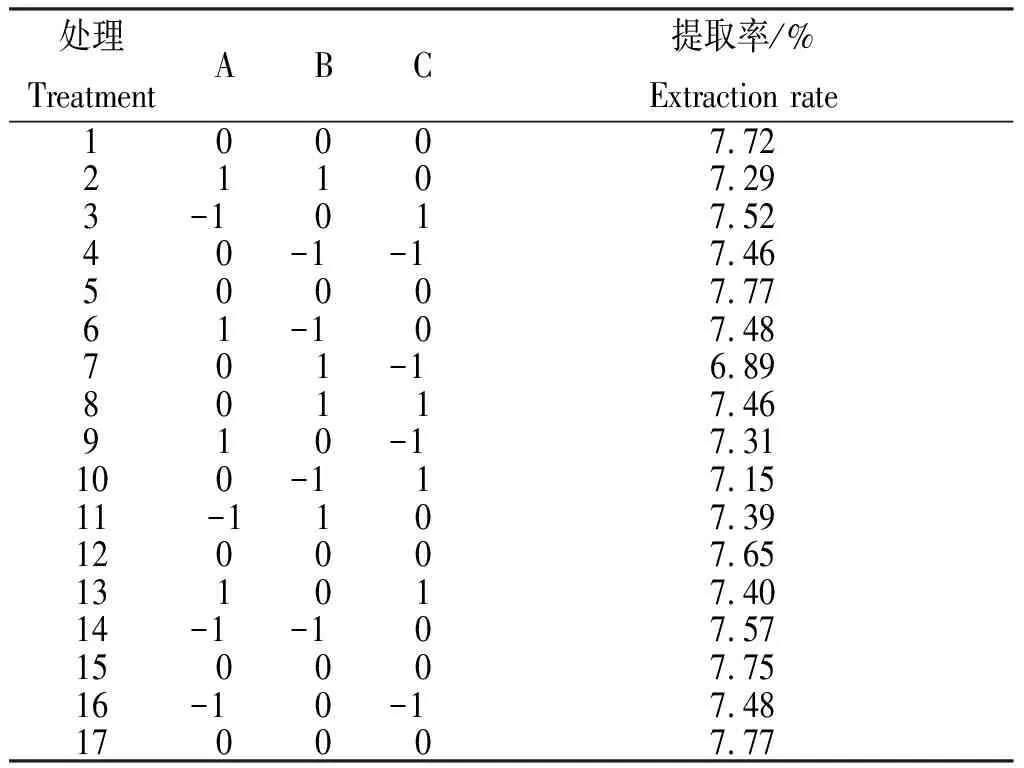
表2 山慈菇多糖提取的响应面试验设计及结果
2.3.2 Box-Behnken模型的建立与统计分析 经对上述提取结果进行多元回归拟合得到山慈菇多糖提取率(Y)与提取因素 固液比(A)、温度(B)和提取时间(C)的回归拟合方程:
Y=7.73-0.060A-0.079B+0.049C-
0.002 5AB+0.013AC+0.22BC-0.056A2-
0.24B2-0.25C2
从表3看出,模型P<0.000 1,F=44.68,表明,试验二次模型可信度高,可用于描述因素与响应值间的变化关系。决定系数R2=0.982 9,校正决定系数Radj2为0.960 9,变异系数CV为0.64%(较小),失拟项0.625 7(>0.05),说明模型拟合好,稳定、可靠。同时,固液比与提取温度的交互、固液比与提取时间的交互对山慈菇多糖提取率无显著影响,而固液比、提取温度、提取时间及固液比的交互对山慈菇多糖提取率影响显著,提取温度交互、提取时间交互及提取温度与提取时间的交互对山慈菇多糖提取率影响极显著。从A、B和C的F值大小可以判断各因素对提取率的影响大小为B>A>C。
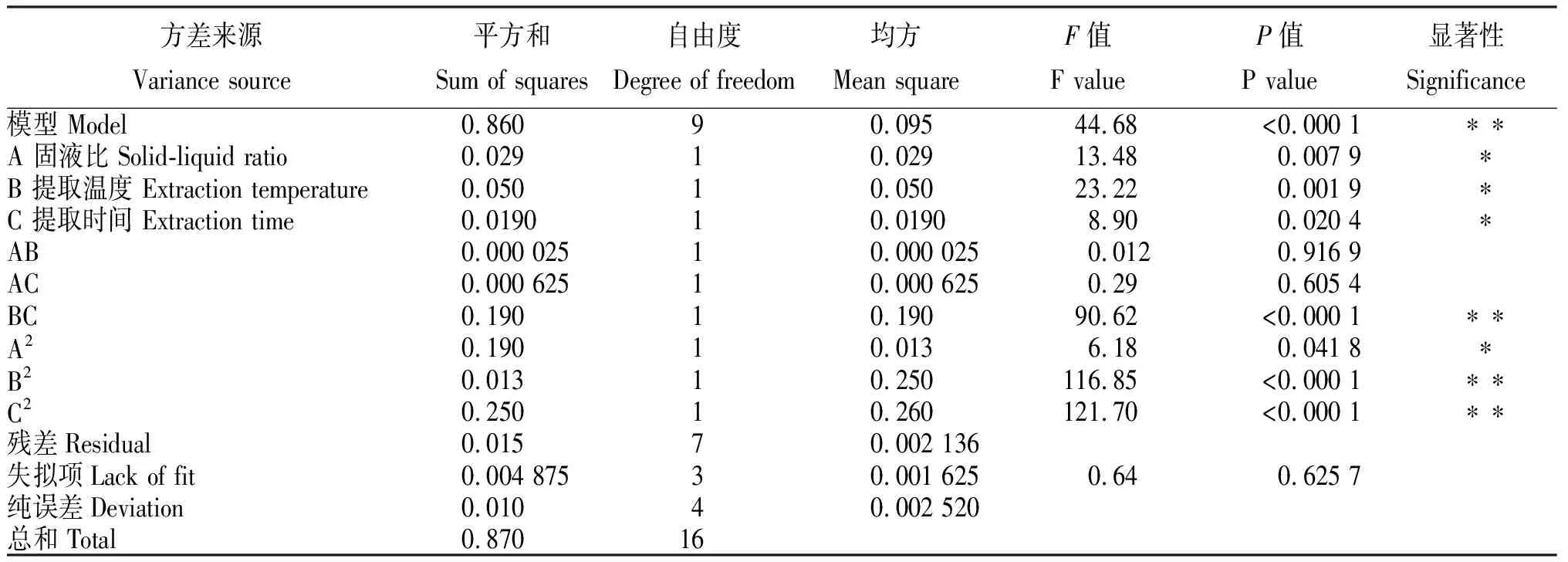
表3 Box-Behnken模型的方差分析结果
2.3.3 响应面因素间交互作用 从图2看出固液比、提取温度、提取时间对山慈菇多糖提取率影响的变化及影响因素间的相互作用。
1) 固液比与提取温度。2个影响因素有交互作用,提取率均随影响因素的递增呈先增后减趋势,曲面图呈现一种弯曲且陡峭的状态。同时,等高线在提取温度侧较多,呈长圆形,说明,回流提取温度对多糖提取率的影响优于固液比。
2) 固液比与提取时间。响应面曲面弯曲,2个影响因素有交互作用,多糖提取率随影响因素的递增呈先增后减趋势。等高线在固液比一侧聚集,呈长圆形,说明,固液比对多糖提取率的影响大于提取时间对多糖提取率的影响。
3) 提取温度与提取时间。响应面曲面弯曲呈弧状,表明温度和提取时间的交互作用十分明显,多糖提取率均随提取温度与提取时间增加呈先增后减趋势。等高线呈长椭圆状,表明,二者交互作用十分明显,但等高线更多聚集在温度侧,说明提取温度对多糖提取率的作用占优势。
综合看,Design-Expert 8.0.6优化出的山慈菇多糖最佳提取工艺为固液比1∶40,提取温度为78.61℃,提取时间为121.85 min,此时山慈菇多糖的预测提取率为7.62%。
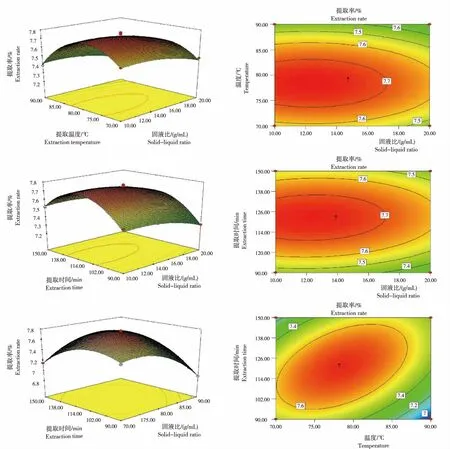
图3 不同处理条件山慈菇多糖提取率及其响应面与等高线
2.4 提取工艺验证
由于试验操作条件有限,将提取工艺稍作修改,在提取条件为固液比1∶40、提取温度79℃、提取时间122 min下重复试验3次,得山慈菇多糖提取率为7.04%,与预测值(7.62%)相比误差小于1%。表明,使用该方法优化山慈菇多糖提取工艺可靠、真实且具有代表性。
3 讨论
山慈菇多糖的提取工艺在我国目前还处于初步阶段,而实际上,国内外研究提取多糖工艺已出现新兴方法[13-20],如水提醇沉法、溶剂提取法、酶提法、超声辅助提取法、微波辅助提取法、超临界流体萃取法、超高压提取法及复合提取法等,每种方法都有各自的优缺点。为了充分利用濒危药用植物山慈菇,为其多糖的进一步开发和应用提供依据,该研究采用传统的水提醇沉法提取山慈菇多糖,通过单因素试验与响应面法相结合优化了山慈菇多糖提取条件,在此最佳提取条件下山慈菇多糖提取率为7.62%。较之房宇坤等[13]的水提醇沉法研究,提取条件得到进一步优化,为提高提取率奠定了一定基础,也为食品、医药等领域利用山慈菇多糖提供了一种提取方式。虽然传统的水提醇沉法简单、方便,但随着时代的发展与进步,今后应顺应时代,尝试多种新方法对提取工艺进行考察、改进,为缩短提取时间,获得山慈菇多糖高提取率提供理论依据。
4 结论
试验采用最经典的水提醇沉法和响应面法结合优化山慈菇多糖的提取工艺,获得最优的提取工艺参数,即固液比(g∶mL)为1∶40、提取温度为78.61℃、提取时间为121.85 min,山慈菇多糖的预测提取率为7.62%。采用响应面法优化山慈菇多糖提取工艺得出,固液比、提取时间及提取温度对山慈菇多糖提取率的影响依次为提取温度>固液比>提取时间,提取温度与提取时间的交互对山慈菇多糖提取率的影响较显著,固液比与提取温度的交互及固液比与提取时间的交互对山慈菇多糖提取率几乎无影响。考虑到实际操作限制,将提取工艺参数修改为固液比(g∶mL)1∶40、提取时间122 min、提取温度79℃,此时山慈菇多糖的实际提取率为7.04%,与预测值基本一致。表明,该方法结果可靠,准确,且具有操作简单、方便、经济等优点,适用于山慈菇多糖的提取。
