枸杞多糖的水提醇沉法工艺优化
2021-09-13胡玲玲乌雪燕
胡玲玲, 乌雪燕
(安康学院 化学化工学院, 陕西 安康 725000)
0 引言
【研究意义】枸杞属茄科植物,主要产于宁夏、甘肃及新疆等地,其成熟的浆果干燥后称为枸杞子,是一种较名贵且历史悠久的药食同源中药材。中医认为,枸杞具滋补肝肾、保健明目的功效[1-2]。药理研究表明,枸杞含有多糖、生物碱及类胡萝卜素、黄酮多酚等多种复杂的生物成分[3]。其中,枸杞多糖是枸杞中最主要的生物活性物质之一,具有调节免疫、清除自由基、调节血糖血脂等生理功效,因而倍受关注,也是评价枸杞质量的重要依据之一[4-5]。开展枸杞多糖等活性物质提取方面的研究,对扩大其在食品加工、生物制药等方面的开发利用具有现实意义。【前人研究进展】提取植物多糖的方法主要有传统的水提醇沉提取法、超声波辅助提取法、微波辅助提取法、酶辅助提取法和超临界流体萃取法等[6-12]。郭锦涛等[10]研究发现,经53%vol白酒浸泡20 d后枸杞浸提酒的黄酮含量和多糖含量分别为0.031 mg/mL和5.83 mg/mL,浸提效果最佳。许英瑞等[11]研究得到超声提取黑枸杞(LyciumruthenicumMurray)多糖的最佳工艺条件:液料比(mL∶g)41.50∶1,提取时间16 min,超声功率418 W,此时黑枸杞多糖的提取率达14.13%。吴佳欣等[12]对枸杞多糖提取工艺进行优化,提出其最佳提取工艺:液料比(mL∶g)36.6∶1,温度93.2℃,时间3.9 h,此时多糖提取率为4.28%。【研究切入点】每种方法各有特点,酶法除考虑影响酶活性的各种因素外,还要考虑酶浓度、底物浓度等因素对提取物的影响,对实验条件要求较高;微波法一般对水的穿透深度为2~3 cm,穿透深度有限;超临界流体萃取法需要有高温高压的技术条件,均不利于工厂化生产。传统的水提醇沉法提取时间长,温度高,对多糖的生物活性有不利影响,而超声波空化效应可以缩短提取时间,避免长时间的高温提取操作对有效成分的破坏。【拟解决的关键问题】采用单因素试验与正交试验相结合,以枸杞多糖的得率为评价指标,通过超声波辅助优化传统水提醇沉法提取工艺,以期为枸杞多糖的提高提供理论依据。
1 材料与方法
1.1 材料
1.1.1 枸杞 中药材枸杞,产于宁夏中宁县,购于安康。
1.1.2 仪器 主要仪器包括Uv-6100PC紫外可见分光光度计(上海美普达仪器有限公司),FW177中草药粉碎机(天津市泰斯特仪器有限公司),HH-2型电热恒温水浴锅(上海科伟永兴仪器有限公司),KH-100E超声波清洗仪(昆山禾创超声波仪器有限公司),FD-1A-80台式冷冻干燥机(上海予腾生物科技有限公司),AE224电子分析天平(上海舜宇恒平仪器有限公司),DZF-6020真空干燥箱(苏州江东精密仪器有限公司)。
1.1.3 试剂 无水乙醇(AR)(天津市天力化学试剂有限公司),苯酚(AR)(天津市东丽区新中村),无水葡萄糖(AR)(西王药业有限公司)。
1.2 方法
1.2.1 材料预处理 取中药材枸杞50 g于真空干燥箱中60℃干燥12 h,碾碎过筛(24目),用100 mL有机溶剂(V氯仿∶V甲醇=2∶1)60℃下回流2 h,抽滤,滤渣用相同的方法再重复处理1次,充分除去枸杞中的色素、脂类及低聚糖[13]。滤饼冷冻干燥制成枸杞样品并称重(ms),备用。
1.2.2 绘制标准曲线 无水葡萄糖粉末干燥至恒重,准确称量25 mg,去离子水溶解后,转移至250 mL的容量瓶并定容,配制成浓度为100 mg/L葡萄糖标准溶液。分别移取0.20 mL、0.40 mL、0.60 mL、0.80 mL、1.00 mL、1.20 mL的葡萄糖标准溶液于6个10 mL具塞比色管中,补去离子水至2.00 mL。再分别加入 6%苯酚溶液1.00 mL、浓硫酸6 mL,充分摇匀后,90℃水浴15 min,迅速冷却至室温,然后采用紫外分光光度计在波长(λ)300~800 nm扫描,λ=490 nm处有最大吸光度。因此,可在此处测定枸杞多糖的吸光度[14-15]。以吸光度值为纵坐标(y)、葡萄糖标准溶液浓度(x)为横坐标,绘制标准曲线。
1.2.3 不同因素对枸杞多糖得率的影响 用精度0.01 g的电子秤准确称取枸杞样品2.00 g置于100 mL圆底烧瓶,按照超声提取→浓缩→冷冻干燥→测定吸光度并计算得率的流程进行单因素提取试验,分别考察液料比(mL∶g)、超声提取时长(min)、超声温度(℃)及提取次数等因素对提取得率的影响。
1) 提取时间。分别设定为10 min、15 min、20 min、25 min和30 min;试验条件:液料比为20∶1,提取温度设定为50℃。
2) 提取温度。分别设定为30℃、40℃、50℃、60℃和70℃;试验条件:液料比为20∶1,超声提取时长设定为25 min。
3) 液料比(mL∶g)。分别设定为10∶1、15∶1、20∶1、25∶1和30∶1;试验条件:超声提取温度和提取时长固定为50℃和25 min。各处理2次重复提取,合并滤液并用旋转蒸发仪浓缩至10 mL,加入40 mL 95%乙醇,4℃下静置沉淀24 h,抽滤,滤渣分别用少量乙醇、丙酮各洗涤1次,得枸杞多糖粗产品。
1.2.4 正交试验设计优化提取工艺 根据上述单因素试验结果,采用L9(34)正交试验设计(表1),对枸杞多糖水提醇沉法提取工艺中主要影响因素液料比,超声提取时长和提取温度进行优化,筛选最佳提取工艺。
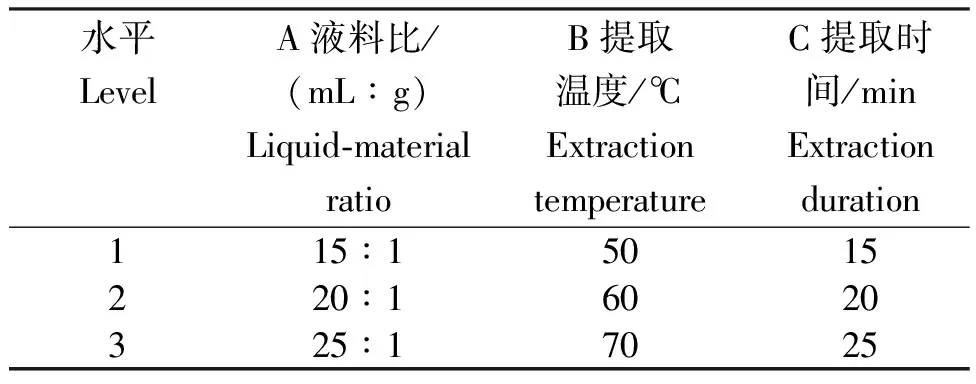
表1 枸杞多糖提取试验因素及水平
1.2.5 测定枸杞多糖含量 枸杞粗多糖冻干品,用去离子水溶解配置成250 mL多糖溶液,吸量管移取1.00 mL多糖溶液于10 mL容量瓶中,去离子水定容。再从中取出1.00 mL溶液于比色管中补去离子水至2.00 mL。然后加入6%苯酚溶液1.00 mL、浓硫酸6.00 mL,充分摇匀,沸水浴15 min,迅速冷却至室温,测量其吸光度并计算枸杞多糖的提取率。
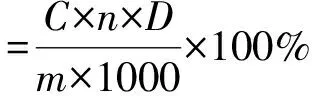
式中,C由回归方程所得枸杞粗多糖的浓度(mg/L),n为稀释倍数,D为换算系数(ms/50);m为枸杞供试品的质量(g)。
2 结果与分析
2.1 枸杞多糖的标准曲线
以吸光度值为纵坐标(y)、葡萄糖标准溶液浓度(x)为横坐标绘制得到标准曲线(图1)。经拟合得回归方程:
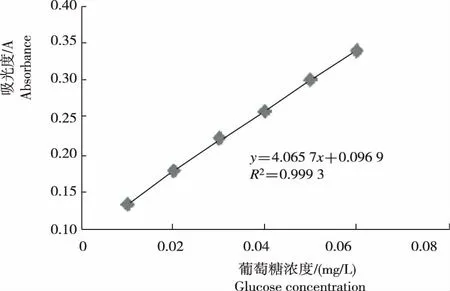
图1 枸杞多糖的标准曲线
y=4.0657x+0.096 9(R2=0.999 3)
说明,葡萄糖标准溶液的浓度在10~60 mg/L,吸光度与葡萄糖浓度存在良好的线性关系。
2.2 不同提取因素处理枸杞多糖的提取率
从图2看出,不同提取时间、温度和液料比处理枸杞多糖的提取率存在差异。
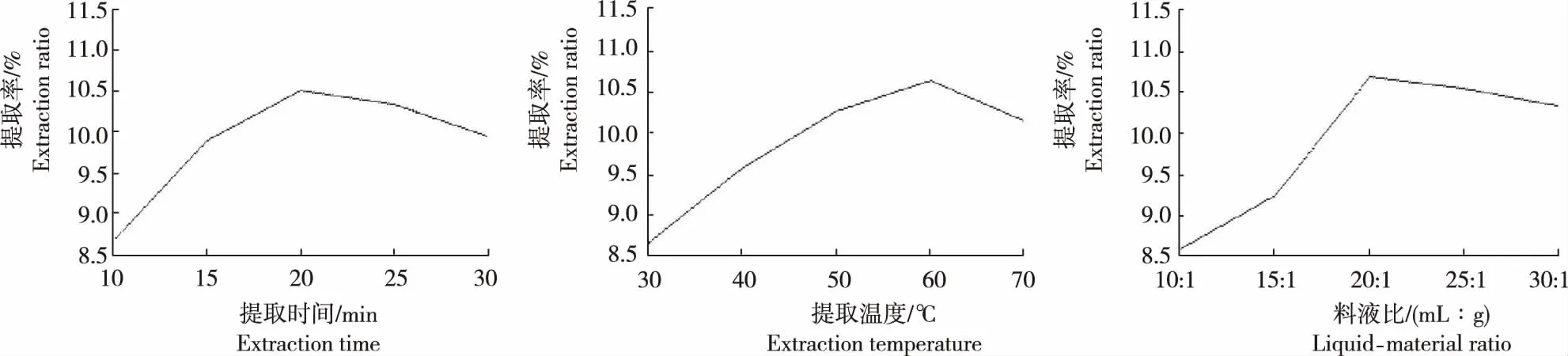
图2 不同提取时间、温度和液料比处理枸杞多糖的提取率
2.2.1 提取时间 不同处理枸杞多糖的提取率为8.68%~10.51%,其中,提取时长为20 min时多糖提取率最高,25 min时其次,10 min时最低,依次为20 min>25 min>30 min>15 min>10 min。枸杞多糖提取率随提取时间的增加呈先升后降趋势,当提取时长为20 min时达最大,之后下降,可能是随着提取时间的增长,多糖在溶剂中不断溶出;随时间延长,其他杂质在溶剂中溶出也快速增多,使得多糖提取率下降。表明,20 min是较为合适的提取时长。因此,选取提取时间15 min、20 min和25 min进行后续试验。
2.2.2 提取温度 不同处理枸杞多糖的提取率为8.67%~10.66%,其中,提取温度为60℃时多糖提取率最高,50℃时其次,30℃时最低,依次为60℃>50℃>70℃>40℃>30℃。随溶剂温度升高,多糖提取率呈先升后降趋势,在提取温度为60℃时达最大,之后下降,可能是枸杞多糖在低温时溶出较少,随温度升高,多糖溶出逐渐增大;温度较高时多糖易降解,从而使多糖提取率下降。表明,最佳提取温度以60℃较为适宜。因而,选取提取温度50℃、60℃和70℃进行后续试验。
2.2.3 液料比 不同处理枸杞多糖的提取率为8.61%~10.71%,其中,液料比(mL∶g)为20∶1时多糖提取率最高,25∶1时其次,10∶1时最低,依次为20∶1>25∶1>30∶1>15∶1>10∶1。随液料比增大,多糖提取率呈先升后降趋势,当液料比大于20∶1之后,提取率又略有下降。原因可能是液料比太小时,溶剂不能完全浸润药材,多糖提取不完全。为提高效率,节省能耗,选择20∶1的液料比较为适宜。因而,选取液料比15∶1、20∶1和25∶1进行后续试验。
2.3 枸杞多糖提取条件优化
从表2看出,9个处理枸杞多糖提取率为8.79%~10.66%,其中,处理5(A2B2C3),即液料比20∶1,提取温度60℃,提取时长25 min时枸杞多糖提取率达最高,为10.66%;处理4(A2B1C2)和处理9(A3B3C2),即液料比20∶1,提取温度50℃,提取时长20 min时和液料比25∶1,提取温度70℃,提取时长20 min时枸杞多糖提取率其次,分别为10.34%和10.32%。从表3和表4可知,各因素对枸杞多糖提取率的影响为A因素(液料比)>C因素(提取时间)>B因素(提取温度);液料比和超声提取时间对提取率影响显著,而提取温度对提取率无显著影响。由K值可知:枸杞多糖提取最佳操作方案为A2B2C2,即超声辅助提取枸杞多糖的最优方案为加入所称量的枸杞供试品质量20倍的蒸馏水,在60℃条件下超声提取20 min。

表2 枸杞多糖提取正交试验设计及结果

表3 枸杞多糖提取条件正交试验结果的极差分析结果
2.4 方案验证
由于正交试验设计中缺少A2B2C2的试验方案,需进行重复性验证试验对优选出的A2B2C2处理进行可信性检验。从表4看出,在此最佳方案下提取枸杞多糖的平均提取率为10.61%,与正交设计中方案5的提取率接近,且RSD仅为1.13%,说明,优选出的提取方案(A2B2C2),即加入称量的枸杞供试品质量20倍的蒸馏水,在60℃条件下超声提取20 min合理、可行。

表4 枸杞多糖正交试验方差分析结果

表5 枸杞多糖提取的重复性试验结果
3 讨论
水提醇沉法在中药材的提取分离中应用较广,该研究利用枸杞多糖溶于水的性质进行水提,随提取温度的升高,提取时间的增长,枸杞多糖在提取液中溶解度提高的同时,多糖的水解率也会提高,使得枸杞多糖的提取率较低。超声波能够在植物组织内部形成空化作用,以及本身的振动作用大大促进了多糖的溶解、扩散,不仅缩短了提取时间,也不需要太高的提取温度。在提高提取率的同时,对多糖结构的破坏较小。将超声法与传统的水提法结合,保留了水提的优点,缩短了提取时间长,提高了提取率,且提取过程简单、易操作。该研究经优化得到提取枸杞多糖的最佳方案为液料比(mL∶g)20∶1,超声提取温度60℃,超声提取时间20 min。较之吴佳欣等[12]的研究,该研究既减少了液料比,降低了提取温度,缩短了提出时间,还提高了多糖提取率。
4 结论
试验采用传统的水提醇沉结合超声波法提取枸杞多糖,选择液料比、提取时间和提取温度3个因素,结合L9(34)正交表优选枸杞多糖的提取方案。提取枸杞多糖的最佳方案为液料比(mL∶g)20∶1,超声提取温度60℃,超声提取时间20 min。在此方案下,枸杞粗多糖的提取率较高,均值达10.61%。提取线路简单、易操作,多糖提取率较高,为枸杞粗多糖进一步纯化研究奠定了基础。
