固相萃取-高效液相色谱-串联质谱法测定蜂蜜中残留的酞丁安
2021-09-12王玉涵王欣然李熠周金慧
王玉涵,王欣然,李熠,2,3,4,周金慧,2,3,4*
(1.中国农业科学院蜜蜂研究所,北京 100093;2.农业农村部蜂产品质量安全控制重点实验室,北京 100093;3.农业农村部蜂产品质量安全风险评估实验室(北京),北京 100093;4.农业农村部蜂产品质量监督检验测试中心(北京),北京 100093)
在养蜂业中,蜂群易受到病毒的侵害,其中包括由慢性麻痹病毒或急性麻痹病毒引起的蜜蜂麻痹病(又叫“瘫痪病”、“黑蜂病”)[1],这种成年蜜蜂传染病,对蜜群的危害大,如不及时防治,会引起蜂蜜减产蜜蜂死亡等严重损失。酞丁安是一种抗病毒药物,具有抗沙眼衣原体、疱疹病毒、金黄色葡萄球菌、链球菌、肺炎双球菌和皮肤癣菌的作用,多用于单纯疱疹、带状疱疹等[2-3]。酞丁安的化学结构式见图1。

图1 酞丁安的化学结构式Fig.1 Chemical structures of ftibamzone and chromatographic conditions
由图1可知,结构中的双缩氨硫脲基团为抗病毒的活性成分[4],其作用机制主要是抑制病毒DNA和早期蛋白质合成,对正常细胞的DNA合成几乎无影响[5-6]。蜂农通常通过饲喂含有酞丁安的饲料或在水溶液中加入酞丁安来防治蜜蜂麻痹病,但酞丁安药物的不当使用可能导致蜜蜂产生耐药性,同时含有酞丁安残留的蜂蜜被消费者食用后可能引发系列过敏症状如皮肤的灼烧感、瘙痒、红肿等,所以建立蜂蜜中酞丁安残留检测方法,对蜂蜜质量进行严格监控,保障消费者的身体健康是十分必要的。
目前为止,关于酞丁安类药物的测定方法均为利用高效液相色谱法对酞丁安类药物的成分含量以及纯度的测定研究[6,7-9],通过顶空气相色谱法测定酞丁安中二氧六环来对酞丁安药品进行质量控制,但世界各国尚没有食品中残留的酞丁安类药物检测方法的相关研究报道。因此,为保证我国蜂蜜的质量安全和减少进出口过程中的贸易壁垒,有必要建立一种准确、可靠的分析方法,对蜂蜜中酞丁安残留量进行检测。随着质谱检测技术的发展,高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)的广泛适用性、灵敏度、分析速度以及定量准确度,可满足在食品复杂基质中进行痕量目标分析物准确筛查定量要求[10-12]。本研究中建立了对蜂蜜基质快速高效的提取残留酞丁安药物的方法并采用HPLC-MS/MS法进行定性、定量分析;考察了提取溶剂、固相萃取柱以及淋洗、洗脱条件等因素对蜂蜜中残留酞丁安的提取、净化效率的影响;对色谱和质谱分析条件进行了优化,以达到分析样品基质中目标物所需的分离、灵敏度和稳定性。同时,本方法的建立可为其它食品中酞丁安残留测定分析提供方法指导。
1 材料与方法
1.1 材料与试剂
1290 HPLC高效液相色谱仪/6495三重四极杆串联质谱仪(配电喷雾电离源):美国Agilent公司;G560E涡动仪:美国Scientific Industries公司;1-15PK离心机:美国Sigma公司;Milli-Q纯水发生器:美国Millipore公司;BSA124S电子天平:德国赛多利斯有限公司。
1.2 仪器与设备
酞丁安(CAS:210165-00-7,纯度≥95%):美国BioRuler公司;甲醇(色谱纯):美国MREDA公司;乙腈(色谱纯):赛默飞世尔科技(中国)有限公司;甲酸(色谱纯):上海安谱试验科技有限公司;二氯甲烷(分析纯):国药集团化学试剂有限公司;PH苯基固相萃取柱(200 mg,6 mL):美国 Agilent公司;0.22 μm 聚四氟乙烯(poly tetra fluoroethylene,PTFE)滤膜:上海安谱实验科技有限公司;超纯水为符合GB/T 6682—2008《分析实验室用水规格和试验方法》中规定的一级水。
1.3 标准溶液制备
准确称取酞丁安标准品10 mg,用乙腈-二甲基亚砜(95∶5,体积比)溶解,配制成1 mg/L的标准储备液,于-20℃棕色瓶中避光保存。根据检测样品中酞丁安的测定要求,用乙腈配制成 5、10、50、100、200、500、1000 μg/L的系列标准工作溶液,于4℃棕色瓶中避光保存。
1.4 样品前处理
1.4.1 样品制备
未结晶的蜂蜜试样将其用力搅拌均匀;对有结晶析出的蜂蜜样品可将样品瓶盖塞紧后,置于不超过50℃的水浴中温热,待样品全部融化后搅匀,将蜂蜜试样于室温(25℃)下避光保存。
1.4.2 提取
称取制备得到的蜂蜜样品5.0 g(精确至±0.05 g)于50 mL具塞塑料离心管中,加入10 mL水,涡旋振荡5 min,于4℃下8 000 r/min离心10 min,保留上清液。
1.4.3 净化
PH苯基固相萃取柱使用前依次用10 mL甲醇和10 mL水活化,将离心后得到的上清液转移至已活化的PH苯基柱中,调节流速以≤3 mL/min通过PH苯基柱,待上清液完全流出后,用10 mL 10%甲醇水淋洗,弃去流出液,负压抽干,用10 mL 20%二氯甲烷/乙腈洗脱,洗脱液收集于15 mL离心管中,于40℃下氮吹至近干,1 mL乙腈复溶,经0.22 μm PTFE有机滤膜过滤后进行HPLC-MS/MS测定。
1.5 色谱条件
色谱柱:Poroshell 120 EC-C18色谱柱(3.0 mm×100 mm,2.7 μm);流动相:A:0.1%甲酸水溶液;流动相B:乙腈。梯度洗脱:0~2.0 min,45%B;2.0 min~3.0 min,100%B;3.0 min~3.1 min,45%B;3.1 min~6.0 min,45%B。流速:0.3 mL/min;柱温:30 ℃;进样量:5 μL。
1.6 质谱条件
电喷雾离子源(electrospray ionization source,ESI+);正离子模式;扫描方式:多反应监测(multiple reaction monitoring,MRM);毛细管电压:3 500 V;喷嘴电压:0 V;干燥气温度:150 ℃;干燥气流速:13 L/min;雾化器压力:206.85 kPa;鞘气温度:325℃;鞘气流速:11 L/min;喷嘴电压:0 V;质谱选择离子参数设定见表1。

表1 质谱选择离子参数Table 1 MS parameters of mass spectrometry select ion
2 结果与讨论
2.1 质谱条件的确定
由于酞丁安具有多氨基结构,在正电喷雾电离模式下可以很容易地获得稳定的分子离子[M+H]+。本试验中将1.0 mg/L的酞丁安标准溶液注入电喷雾离子源,正离子(ESI+)全扫描模式下获得酞丁安分子离子[M+H]+。之后在碎片离子描模式下得到子离子信息。最后通过多反应监测(MRM)扫描模式对各子离子碰撞能进行优化,获得最佳质谱参数。
2.2 色谱条件的确定
流动相体系的优化是为了使待测物质在分析过程中获得最高的灵敏度,并与杂质尽可能的分离,减少基质的干扰。因此,对流动相进行优化是十分关键的。本研究比较了水-甲醇体系,和水-乙腈体系,发现在水-乙腈体系中酞丁安的质谱响应较高,此外,有机酸的添加有利于提高分析物在正离子模式下的离子化效率。在流动相中加入0.1%甲酸时,获得了更高的响应值和更尖锐的峰形,因此最终选用0.1%甲酸水-乙腈体系作为流动相。同时通过优化流动相洗脱程序、柱温等色谱条件,使酞丁安与基质中杂质峰分离,并提高酞丁安在质谱中的响应。在优化的质谱和液相色谱条件下酞丁安标准溶液(1 mg/L)MRM色谱图见图2。


图2 酞丁安标准溶液(1 mg/L)和空白蜂蜜基质在最优质谱、色谱条件下MRM色谱图Fig.2 MRM chromatogram offtibamzone standard solution at 1 mg/L and blank sample in optimal mass
2.3 样品前处理方法优化
2.3.1 提取剂优化
蜂蜜易溶于水,因此本研究分别测试了水、0.1%甲酸水、0.4%NaOH溶液3种不同提取剂对蜂蜜基质中目标待测物的提取效果。结果表明,0.4%NaOH溶液无法从蜂蜜基质中提取酞丁安。酞丁安虽然在碱性环境下易呈离子解离态且亲水性增加[13],但其在碱性环境中易被降解破坏[9],导致酞丁安无法被有效提取。水和0.1%甲酸水均可从蜂蜜基质中提取出酞丁安,当0.1%甲酸水作为提取溶剂时,提取回收率为54.68%;当水作为提取溶剂时,提取回收率为69.81%,酞丁安的质谱响应高且峰型尖锐对称。因此,最终选用水作为提取溶剂。
2.3.2 净化条件优化
为实现蜂蜜基质的净化和酞丁安的保留富集,本试验中比较了Plexa、PCX、PAX、MAX、SAX以及PH苯基固相萃取柱的净化效果。6种不同固相萃取柱净化处理效果如图3所示。

图3 Plexa、PCX、PAX、MAX、SAX、PH 6种固相萃取柱净化蜂蜜基质中酞丁安的MRM色谱图Fig.3 MRM chromatograms of purifying honey matrix using Plexa,PCX,PAX,MAX,SAX,and PH solid-phase extraction cartridges
酞丁安含有缩氨基硫脲结构可解离为离子态,因此测试了离子交换型固相萃取柱的保留净化效果。结果显示,混合型阳离子交换固相萃取小柱(PCX)、混合型阴离子固相萃取柱(PAX、MAX)对酞丁安几乎无保留;SAX强阴离子交换型[14]固相萃取柱对酞丁安有少量保留,但酞丁安质谱峰型较宽并存在基质干扰。酞丁安无法在离子交换型固相萃取柱中有效保留,可能与酞丁安结构不稳定易在前处理过程中出现降解有关[9]。酞丁安含有非极性的苯环结构,苯环可与固相萃取柱上的特异性填料结合,从而实现酞丁安在固相萃取柱上的保留富集。本研究选取可与苯环基团结合的Plexa非极性保留固相萃取柱[15]和PH苯基固相萃取柱进行了测试,结果表明酞丁安可在PH苯基柱上得以保留并被洗脱,在Plexa柱上有极少保留。PH苯基柱主要通过待测物与固相萃取柱之间的疏水作用力使待测物保留于固相萃取柱上,同时PH苯基柱填料上的修饰基团只与带有苯环结构的物质结合[16],而蜂蜜中含量最高的糖类物质不具有苯环结构,所以不能在PH苯基柱上保留,因此PH苯基柱可富集保留酞丁安,同时净化基质并降低杂质干扰。
为进一步去除基质中的杂质干扰,降低基质效应,提高目标分析物回收率,对固相萃取净化处理过程中淋洗和洗脱条件进行优化。本试验比较了不淋洗,水淋洗和10%甲醇水淋洗时固相萃取柱的净化效果。不淋洗时回收率仅为16.52%,水淋洗时回收率为54.68%,10%甲醇水淋洗时,酞丁安回收率最高为82.18%。最终,选用10%甲醇水(10 mL)进行淋洗。
进一步对洗脱溶剂进行选择及优化,以获得酞丁安药物的最佳回收。本试验中先后尝试了采用甲酸-乙腈,NaOH-乙腈,二甲基亚砜-乙腈,丙酮-乙腈以及二氯甲烷-乙腈进行洗脱处理。试验过程中发现,二甲基亚砜-乙腈未能洗脱出酞丁安;甲酸-乙腈、NaOH-乙腈以及丙酮-乙腈体系洗脱效果均不理想。其中,甲酸-乙腈体系进行洗脱时,随酸含量增加其洗脱效率降低;NaOH-乙腈体系进行洗脱时,随NaOH含量的增高,其洗脱能力增强,但NaOH含量过高,不利于氮吹浓缩,且易产生[M+Na]+峰以及离子抑制效应作用,不利于仪器检测[17];丙酮-乙腈体系进行洗脱时,随丙酮含量的升高,洗脱能力减弱;异丙醇-乙腈,氨化乙腈,二氯甲烷-乙腈体系,均可洗脱出酞丁安,但异丙醇-乙腈洗脱时回收率相较其他两种体系较低,且氮吹浓缩时间较长;氨化乙腈体系的洗脱回收率为53.8%~65.66%;二氯甲烷-乙腈体系的洗脱回收率为61.75%~69.81%。由于,二氯甲烷-乙腈体系洗脱能力强且回收率最高,可作为洗脱剂的较优选择。
为得到最佳洗脱效果,对二氯甲烷-乙腈体系洗脱剂比例进行优化。分别测试了10%、20%、30%、50%二氯甲烷-乙腈以及二氯甲烷对酞丁安的洗脱能力见图4。
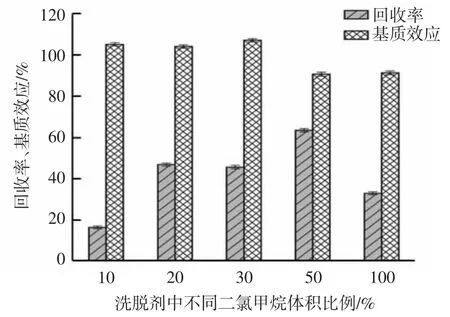
图4 不同比例二氯甲烷-乙腈洗脱时蜂蜜中酞丁安的回收率和基质效应Fig.4 Recoveries and MES of ftibamzone in honey eluted with different volume ratios of dichloromethane-acetonitrile mixtures
结果表明,50%二氯甲烷-乙腈洗脱能力最强,但其基质效应最大,表现为接近10%的基质抑制。同时通过试验发现,随二氯甲烷使用量的增加,洗脱液流经固相萃取柱的时间以及氮吹浓缩时间也随之延长;20%二氯甲烷-乙腈和30%二氯甲烷-乙腈体系效果相当,回收较好,且基质增强在10%以内,因此最终选用20%二氯甲烷-乙腈作为洗脱剂。
2.4 复溶液的选择
本试验中对上机复溶液进行了比较分析,测试了0.1%甲酸水以及乙腈的复溶效果。添加水平为1mg/kg的酞丁安提取物在不同复溶液中稳定性变化如图5所示。

图5 酞丁安提取物经不同复溶液0.1%甲酸水,乙腈复溶后的相对浓度Fig.5 The relative concentrations of ftibamzone extract in 0.1% formic acid and acetonitrile solvent
结果表明在0.1%甲酸水体系下,酞丁安在8h内,出现明显降解,而在乙腈体系中在8 h内,几乎不出现降解。本试验结果与余小平[18]关于酞丁安软膏在二甲基甲酞胺中可稳定存在6 h的研究相近。同时,乙腈作为复溶液时,色谱峰峰型对称,没有明显的基质影响,因此,最终选用乙腈为复溶液。
2.5 方法验证
2.5.1 方法线性关系
将1.3中乙腈溶剂配制浓度为5 μg/L~1 000 μg/L的系列标准工作液,对应的标准溶液浓度为横坐标(X),做线性回归。经绘制峰面积(Y)与分析物浓度(X)的比值,得到了溶剂标准校准曲线方程为Y=758.78X+2 893.9(R2=0.998 6)。结果表明,酞丁安在 5 μg/L~1 000μg/L范围内与其定量离子的响应峰面积呈良好线性关系,线性相关系数大于0.99,满足残留分析的要求。
2.5.2 基质效应
基质效应指不同的样品基质在质谱检测(特别是使用电离源)时由于离子化效应而产生的离子增强或抑制作用[19]。为获得准确的目标物定量分析,评估样品的基质效应是十分必要的。基质效应(%)计算公式为B/A×100,其中A表示溶剂标准校准曲线的斜率,B表示基质匹配标准曲线的斜率。基质效应低于100%时表明存在基质抑制,高于100%时表明存在基质增强。而且,基质效应在80%到120%之间被认为是可被接受的低基质效应,小于80%或大于120%则被判定为是对目标分析物定量产生影响的高基质效应[20]。
采用空白蜂蜜样品(不含目标化合物的蜂蜜基质)经1.3中制备得到空白基质液,配制浓度为5 μg/L~1 000 μg/L的系列基质标准工作液,并按2.5.1计算得酞丁安样品基质匹配标准曲线方程Y=733.36X+2 166.8(R2=0.999 0)。用基质匹配标准曲线与溶剂标准曲线的斜率之比对基质效应进行评价,结果表明,基质效应为96.65%,基质抑制效应低于10%,因此本试验中采用溶剂配制标准工作曲线溶液进行定量分析。
2.5.3 方法检出限
采用空白蜂蜜样品(不含目标化合物的蜂蜜基质)经1.3中制备得到空白基质液中添加系列浓度的酞丁安标准溶液并进行测定分析,根据6个空白样品中基线噪音的平均值,以3倍信噪比(S/N=3)计算得到该方法检测限;以10倍信噪比(S/N=10)计算得到该方法定量限。经测定本方法检测限和定量限分别为2μg/kg和 5 μg/kg。
2.5.4 方法加标回收率和精密度
在空白蜂蜜样品中分别添加3个不同浓度水平(5、50、200 μg/kg),每个水平设 6 个平行,设置 1 组空白对照。计算得到回收率及精密度,测定结果见表2。
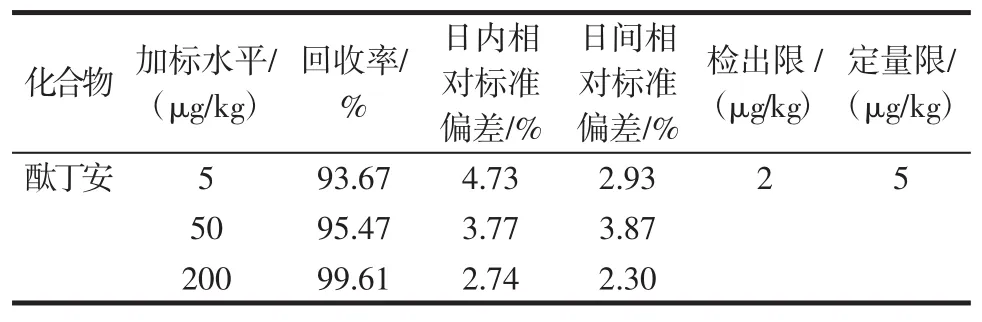
表2 方法回收率、精密度、检测限和定量限(n=6)Table 2 Recovery,precision,limit of detection and limit of quantification of the method(n=6)
蜂蜜样品中酞丁安在3个添加浓度的回收率在82.41%~103.08%之间。日内相对标准偏差在2.74%~7.73%;日间相对标准偏差在2.30%~3.87%。由回收率和精密度可见,该方法准确性、稳定性良好,可满足残留检测的要求。
3 结论
本研究建立了高效液相色谱-三重四极杆串联质谱结合固相萃取净化法测定蜂蜜中残留的酞丁安药物的定性筛查与定量分析方法。经优化的前处理方法便捷、高效,经水提取,经PH苯基固相萃取柱净化蜂蜜基质,可实现酞丁安药物的有效提取与富集净化,选择的乙腈复溶溶液可实现在有效检测时间内保持酞丁安药物的稳定性。该方法的准确度、精密度和灵敏度均经过方法学评价,满足残留检测的要求,本方法可用于准确检测蜂蜜中酞丁安残留水平。本方法的建立与推广应用将助力于监控蜂蜜品质,保证蜂产品质量安全,减少进出口过程中的贸易壁垒,以及保障消费者饮食健康安全。
