藜麦种皮中总皂苷提取工艺的优化及种皮不同部位皂苷含量的比较研究
2021-09-10张陆军赵娅敏李春丽杨玉银李令吴代琼王治菊刘梦实孙乐兵任敏郭晓农
张陆军 赵娅敏 李春丽 杨玉银 李令 吴代琼 王治菊 刘梦实 孙乐兵 任敏 郭晓农

摘要:本文对藜麦一层种皮中总皂苷的提取工艺进行研究。在单因素试验基础上,选取乙醇浓度、提取时间和料液比三因素三水平并利用Box-Behnken desingn(BBD)试验设计,确定皂苷提取工艺的优化组合条件为:乙醇浓度90%、提取时间24 min、料液比1:30 (g/mL)。在该条件下提取皂苷的含量预测值为21.78 g/100 g,验证值为21.84 g/100 g,相对误差为0.27%。与正交试验优化的工艺条件下提取的藜麦皂苷含量有所增加。采用响应面优化试验所得最佳提取工艺对藜麦一层种皮、二层种皮和瘪粒中的皂苷进行提取并测定其含量,得出藜麦一层种皮中皂苷含量最高。
关键词:藜麦;皂苷;响应面分析
【中图分类号】R-3 【文献标识码】A 【文章编号】2107-2306(2020)01-086-02
藜麦(Chenopodium quinoa willd)又称南美藜、藜谷等,为藜科藜属双子叶植物,穗部可呈红、紫、黄三种颜色。它原产于南美洲安第斯山脉的哥伦比亚、厄瓜多尔、秘鲁该植物因具有极好的营养价值被认为是一种“神圣的植物”。现代研究证实,藜麦是唯一一种含有高质量完整蛋白质和广泛必需氨基酸的植物食品,类似于牛奶酪蛋白[2];藜麦还含有高含量的不饱和脂肪酸,膳食纤维和矿物质,以及其它生理活性化合物,如黄酮、多酚、植物甾醇等;同时,藜麦还是一种低果糖低葡萄糖的食物。因此,藜麦被认为是唯一一种单作物即可满足人类所需的全部营养的粮食定为“粮食之母”,美国将其作为宇航员的日常口粮。2013年是联合国钦定的国际藜麦年。但是,到目前为止,藜麦的应用不够深入,主要采用多次碾磨的方式去掉麦麸被加工成藜麦米或藜麦粉,麸皮作为副产品含有较高的皂苷。皂苷是藜麦中主要的抗营养因子,但也具有较好的生物活性,如镇痛抗炎、抗菌、抗氧化、抗病毒、抗癌等。为了有效利用藜麦麸皮和瘪粒这一宝贵资源,挖掘藜麦的特殊功能价值,本研究拟首先对藜麦一层麸皮中总皂苷的提取工艺进行研究,在确定的藜麦麸皮中皂苷的最佳提取工艺基础上,测定藜麦一层麸皮、二层麸皮和藜麦瘪粒中皂苷含量,为藜麦麸皮和瘪粒的进一步开发利用提供数据基础。
1 材料与方法
1.1实验材料
藜麦一层麸皮、二层麸皮和瘪粒(甘肃省农业科学院)
齐墩果酸对照品(中国药品研究院)、高氯酸、香草醛、冰醋酸和无水乙醇均为分析纯。
KQ-100DE型数控超声波清洗仪(昆山市超声仪器有限公司);DGG-9023A型电热恒温鼓风干燥箱(上海森信实验仪器有限公司);UV2000紫外可见分光光度计(北京宏昌信科技有限公司);AB204-S型电子天平(深圳市新朗普电子科技有限公司);万能粉碎机(广州市旭朗机械设备有限公司)。
1.2实验方法
1.2.1齐墩果酸标准曲线的绘制
精密称取10 mg齐墩果酸,将齐墩果酸溶解在甲醇溶液中,稀释至10 mL刻度管中,均匀摇晃以得到浓度为1mg/mL的齐墩果酸标准溶液。精确移取齐墩果酸标准溶液 0、30、60、90、120、150 μL 且分别置于已编号的6组干燥的10 mL的具塞试管中,将恒温水浴锅的温度调节为60 ℃,待恒温水浴锅内的水温上升至60 ℃,将溶液放在60 ℃水浴锅中把溶剂挥发干净,每组平行2次。待具塞量筒中的溶剂挥发干后,按顺序用相应的移液管准确先移取 0.20 mL 5% 香草醛 - 冰醋酸溶液,再加入0.80 mL 高氯酸溶液至相应编号的具塞量筒中,加塞摇匀,并置于60 ℃水浴锅中显色约15分钟,取出后立即用冷水把溶液冷却到室温,加入5.00 mL 冰乙酸,振荡摇匀。用配置没有加齐墩果酸标准溶液的空白溶液做参比,在400 nm到700 nm波长下,用分光光度计测定测定最大吸收波长为545 nm,在最大吸收波长处测定吸光度(A)值,以A为纵坐标,浓度(C)为横坐标绘制标准曲线。
1.2.2 总皂苷含量的测定
采用香草醛-高氯酸法:用合适的移液管准确移取 0.20 mL提取液,置于洗净,干燥的10 mL带塞试管中,在含有提取溶液的具塞试管中,用相应移液管先加入 0.20 mL 5%香草醛-冰醋酸溶液,接着加入0.80 mL高氯酸溶液,加塞后振荡摇匀,在60 ℃恒温水浴锅中显色15分钟,取出后立即用冷水冷却至室温,加入5.00mL冰乙酸,摇晃均匀,并且在最大的吸收波长545nm处测定样品吸光度值,用所测得的吸光度值计算总皂苷含量[3,4]。
1.3单因素实验
1.3.1乙醇浓度对总皂苷得率的影响
准确称取藜麦种皮的供试品粉末0.65g 5份于锥形瓶中,分别加入13mL(即料液比1:20 g/mL)质量浓度分别为:50%、60%、70%、80%、90%的乙醇溶液,在45℃超声提20 min,待其冷却至室温后抽濾并将滤液移至25 mL的容量瓶中,并用相应的乙醇定容至刻度后摇匀备用。并用“1.2.2”中皂苷的检测方法进行检测。
1.3.2料液比对总皂苷得率的影响
准确称取供试品粉末0.65g 5份于锥形瓶中,分别按料液比为1:10、1:15、1:20、1:25、1:30 (g/mL),加入上述实验所得出的最佳浓度的乙醇,在45℃下超声提取20 min,待其冷却至室温后抽滤并将滤液移至25 mL的容量瓶中,并用相应的乙醇定容至刻度后摇匀备用。按照实验“1.2.2”中的方法进行含量的测定。
1.3.3 超声提取时间对总皂苷得率的影响
准确称取供试品粉末0.65 g,5份于锥形瓶中,在上述实验确定的乙醇溶液浓度、液料比的条件下,在45℃下,分别超声提取10、15、20、25、30 min,待其冷却至室温后抽滤并将滤液移至25 mL的容量瓶中,并用相应的乙醇定容至刻度后摇匀备用。按照实验“1.2.2”中的方法进行含量的测定。
1.4 响应面试验
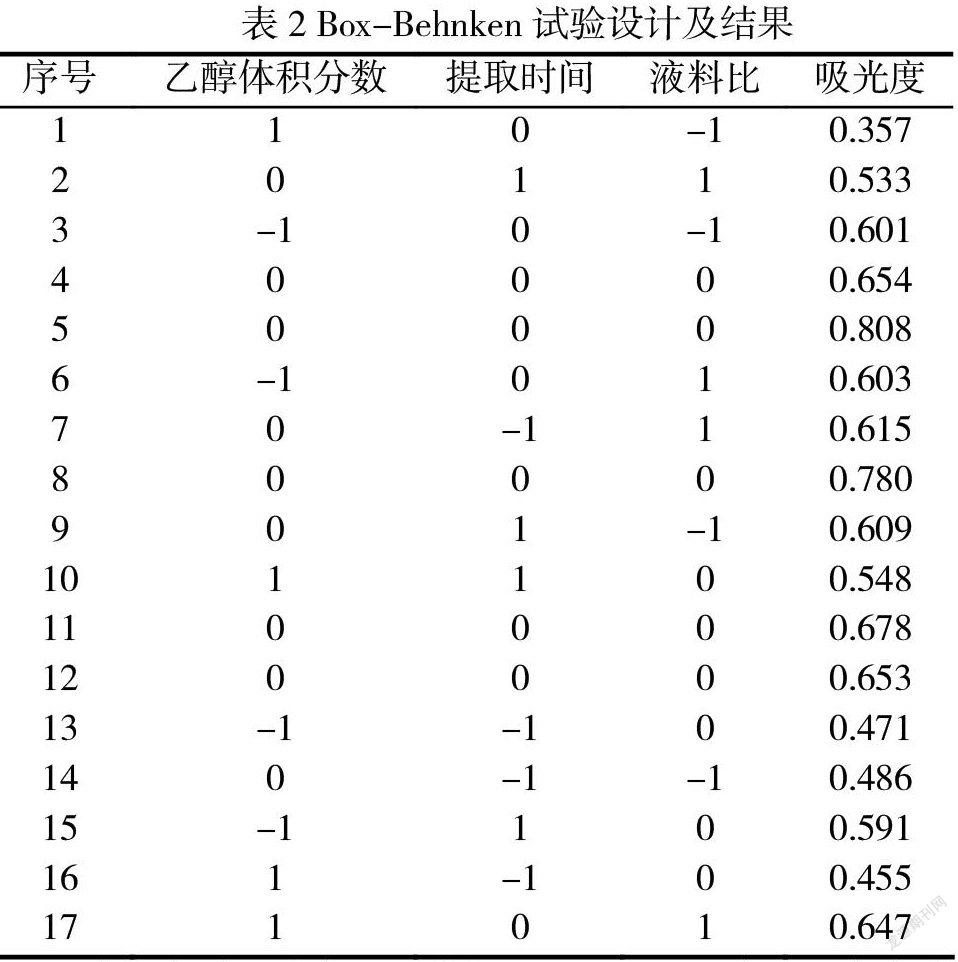
在单因素实验结果的基础上,采用统计软件Design Expert 8.05b 软件中的 Box-Behnken design(BBD)方法对乙醇浓度(A)%、提取时间(B)和料液比(C) 3个因素确定水平范围,进行三因素三水平共17个试验点的响应面分析实验,见表1。
1.5 藜麦不同层种皮和瘪粒中皂苷含量的测定
在响应面优化试验所得最佳提取工艺条件下,对藜麦一层种皮、二层种皮和瘪粒中的皂苷进行提取,并按照单因素试验中皂苷含量的测定方法进行含量测定。
2 结果与分析
2.1 标准曲线的绘制
标准曲线方程为:y=7.1943-0.0082,R2=0.9998 线性关系良好。
2.2 单因素实验对藜麦种皮中皂苷提取的影响
经过单因素实验后,各影响因素的最佳提取条件为乙醇浓度为80 %,提取时间25 min,料液比1:25(g/mL)。
2.3 藜麦种皮中皂苷提取的响应面优化结果
本次三因素三水平试验所得到的数据运用按照的中心组合设计方法进行处理[5],最终得到响应面中心组合设计试验表见表2。
本研究采用响应面试验的Box- Behnken中心组合实验法优化藜麦一次碾压麸皮中皂苷类成分的最佳提取条件。试验预测提取率与各影响因素的关系为:
A=0.71-0.032A+0.032B+0.043C-6.750E-003AB+0.072AC-0.051BC-0.10A2-0.095B2-0.059C2
所建模型的误差分析如下表:
从试验结果可以看出,Prob > F该值<0.05,说明拟合的方程显著性好,失拟项Prob > F该值为0.549>0.05,说明失拟不显著,交互项AB的 Prob > F该值>0.05,BC的 Prob > F该值>0.05,AC的 Prob > F该值>0.05,影响均为不显著,A2的 Prob > F该值<0.05,B2的 Prob > F该值<0.05,影响均显著,C2的 Prob > F该值>0.05,影响不显著。
根据模型预测:最佳提取条件为:乙醇浓度:89.22 %,提取时间:24.34 min,料液比:1:29.925,在该条件下提取后皂苷预测值为21.78 g/100 g。调整最佳提取条件为:乙醇浓度90 %,提取时间:24 min,料液比:1:30,进行实际提取验证,验证值为21.84 g/100 g,实验值与预测值的相对误差为0.27 %,证明在此条件下对藜麦种皮中皂苷的提取效果良好,
2.4 藜麦不同层种皮和瘪粒中皂苷含量的测定
经测定藜麦一层麸皮中皂苷含量为28.32 g/100 g、二层麸皮中皂苷含量为19.13 g/100 g、藜麥瘪粒中皂苷含量为10.91 g/100 g。
参考文献:
[1] Jacobsen S E. The worldwide potential for quinoa (chenopodium quinoa willd) [J]. Food Reviews Intenational, 2003, 19: 167-177.
[2] 任卓伟, 倪文杰, 刘森. 藜麦皂苷的测定研究[J]. 山西农业科学, 2015, 43(8): 932-935.
[3] 陆佳敏, 蒋玉蓉, 袁俊杰, 等. 藜麦叶片多酚最佳提取工艺及其抗氧化性研究[J]. 中国粮油学报, 2016, 31(1): 101-106.
[4] 杨小军, 丁永辉. 响应面法优化藏药绿萝花总黄酮的超声波辅助提取工艺[J]. 中国药房, 2015, 25: 3565-3568.
[5] 曲有乐, 高欣, 孟雪, 等. 响应面法优化中华补血草中总黄酮的提取工艺[J].健康必读(中旬刊), 2012, 12:1.
基金项目:西北民族大学中央高校基本科研业务费专项资金资助研究生项目(Yxm2019136)
(1. 西北民族大学化工学院,甘肃 兰州 730030; 2. 西北民族大学甘肃省高校环境友好复合材料及生物质利用省级重点实验室,甘肃 兰州 730030; 3. 西北民族大学生命科学与工程学院,甘肃 兰州 730030)
