同情用药的伦理辩护与制度建设*
2021-09-10娄贝贝刘婵娟
娄贝贝,刘婵娟
(温州医科大学健康与生命伦理学研究中心,浙江 温州 325035)
目前,世界上已有多个国家和地区建立了同情用药制度。我国国家食品药品监督管理总局(China Food and Drug Administration,CFDA)2017年12月颁布了《拓展性同情使用临床试验用药物管理办法(征求意见稿)》[1],其中提到在特定条件下,允许给患有严重或危及生命疾病的患者使用还未获批上市的药品,这也被称为中国的同情用药制度。新药研发上市时间较长,同情用药制度的建立很大程度上提高了患者的用药可及性,但由于同情用药使用的是还未经批准上市的药物,存有一定风险,其中涉及许多法律和伦理问题,且国内同情用药目前处于初期发展阶段,因此在实施同情用药的过程中要不断完善法律制度,严格遵守医学伦理原则,不断吸收国外成熟做法以对我国有序推进同情用药制度提供参考。
1 同情用药的内涵
同情用药(Compassionate use),又称拓展性使用(Expanded access)或批准前使用(Pre-approval access)[2],即给予危重症患者使用在临床试验之外,尚处于研究阶段的药品或医疗器械,同情用药的治疗领域常见于艾滋病、癌症、罕见病以及心血管疾病等。同情用药在不同国家或地区具有不同名称和形式,美国食品药物管理局(Food and Drug Administration, FDA)倾向于使用“扩大准入”一词,欧盟称未经授权药物的治疗性使用为“同情性使用”,而我国则以“拓展性临床试验”的形式实现同情用药[3]。近年来,欧盟、美国等国家和地区逐步建立起同情用药制度,同情用药制度的内涵在实践过程中不断丰富。
同情用药制度关注的对象虽然为少数无药可医的患者,但其是为有效保护此类群体切身利益而设计的体现人文关怀的特殊制度安排。作为药物临床试验的特殊拓展形式,同情用药的特殊性主要体现在以下方面:
(1)适用主体特殊,同情用药的适用对象是已穷尽现有医疗救治手段如果没有及时、有效的救治可能会面临死亡威胁的患者。但由于同情用药使用的是尚未获批上市的药物,风险具有一定未知性。对于危重患者来说及时通过同情用药进行救治获益大于风险,而普通患者不在同情用药的使用范围之内。
(2)使用阶段特殊,同情用药使用的药物仍处于临床试验阶段、尚未获批上市,但其安全性和有效性已有一定证据。此外,患者身体状况未达到药物临床试验的标准,无法入组时,允许在开展临床试验的机构内对患者进行同情用药。
(3)申请程序特殊,国外同情用药的申请一般由患者向医师提出,医生或临床试验申办者向FDA提交同情用药申请。我国法律法规仅对同情用药作了概括性规定,具体申请程序尚未明确。考虑到国内外医生执业模式的差异性,有研究建议我国患者可以向所在的医疗机构提出申请,医疗机构根据风险与获益的判断后向临床试验申办者提出请求,申办者同意后,由医疗机构、申办者向药品监管部门提出同情用药申请[4]。
2 同情用药的伦理正当性
作为特殊的用药形式,同情用药涉及许多法律问题和伦理挑战。实施同情用药不仅要符合法律要求和科学原则,同时还要符合医学伦理原则。医学伦理原则要求患者受益最大化,伤害最小化。从医学伦理学“尊重(自主)、有利、不伤害、公正”四原则出发,为同情用药正当性提供伦理辩护,以为我国同情用药制度的进一步推进提供一定的理论依据。
尊重(自主)原则,比彻姆( Tom Beauchamp) 和芳登(Ruth Faden) 关于自主的观点可以从两方面来理解,即自主的个人和自主的行动[5]。自主原则常体现在医患关系之中,一方面患者选择自己最期望的治疗方式,合乎人的基本权利和价值的行为;另一方面医生遵从自主原则的行为,合乎道德的善。我国《药品管理法》规定同情用药的实施的基本前提是伦理审查和患者知情同意,对于患者来讲,在充分了解同情用药过程及其实施风险的前提下,同意进行同情用药,并无他人的欺骗、强迫、利诱行为,这充分彰显了医学伦理的尊重(自主)原则。在同情用药的过程中,医方要尊重患者及其家属的人格尊严,尊重患者的选择权和知情权,如果确需同情用药,医方有义务告知患者及其家属同情用药的药品安全性、有效性和风险情况,保证患者知情同意的有效性和非强制性。
有利原则,是指医务人员的诊治行为以为保护病人的利益、促进病人健康、增进其幸福为目的。有利原则必须符合以下条件:医务人员的行动与解除病人的疾苦有关;医务人员的行动可能解除病人的疾苦;病人收益不会给他人带来损害[6]。有利原则是判断医疗行为是否具有道德价值的首要标准。同情用药制度以危重症患者为主要目标人群,对于此类患者而言,现有的治疗药物、治疗手段都收效甚微,采取同情用药是不得已情况之下的最优选择,意图防止患者病情恶化。由此可见,同情用药是合乎道德的,有利于社会和谐发展,其所蕴含的人文关怀容易得到社会的认同和支持。总之,同情用药是为挽救患者生命的有利行动,同情用药制度是为有效保护危重患者的生命健康而进行的灵活制度设计,体现了药品监管机构保护和促进公众健康的理念,也是为医治病人的一种人性化的选择。
不伤害原则,要求最大程度地降低对服务对象的伤害。伦理学上的“不伤害”是指医疗行为的后果使服务对象获益大于伤害[6]。医学之父希波克拉底把“切勿伤害”列为医学的重要原则,要求我们不要有意伤害他人,既无害人的动机,也无害人的行为。不伤害原则要求医生应站在患者的角度上,确定和选择最有利且伤害性最低的医疗诊断和治疗方法。同情用药开展之前,医务人员会对患者实际情况进行风险评估,只有潜在获益大于伤害时才会允许进行同情用药计划。同情用药意图在于为危重患者争取目前可及的、最有效的医疗救治手段,帮助患者获取最有利且伤害性最低的治疗机会。同情用药是出于人文关怀、有利于挽救他人生命、让生命延续的目的。总之,同情用药的有害效应不是直接的,目的是绝无恶意的。
公正原则,公正原则即在资源分配、利益分享和风险承担等方面遵循公平正义的理念。除了形式公正之外,更要考虑实质公正,罗尔斯在《正义论》中指出正义是作为公平之正义,人人都享有自由平等的权利。在生命伦理学之中提倡平等对待,不管在手续审批方面,还是在公正的选择病人方面,同情用药都应公开透明,参与同情用药的患者应公平地分配到药物。目前,我国的医疗资源分配仍存在不平等、不均衡现象。同情用药制度为危重症患者这一弱势群体开辟了一条特殊用药通道,保障了无药可医的患者同样享有生命健康的权利,响应此类弱势群体的健康诉求这与公正原则相符。
3 同情用药制度在我国的适用与挑战
3.1 同情用药制度在我国的发展
新冠肺炎疫情期间,美国在同情用药原则指导下对新型冠状病毒肺炎患者使用尚未获批准的试验性药物瑞德西韦(Remdesivir),引起了国内外广泛关注。2000年,我国国家食品药品监督管理总局于2017年12月向社会公布了《拓展性同情使用临床试验用药物管理办法( 征求意见稿)》,首次使用了“拓展性临床试验”定义,将向研究性新药提供给需早期干预且现有治疗手段收效甚微、且基于各种原则无法参加临床试验的重症患者,明确提到可预先为急需患者提供尚未批准的药物,这标志我国开始实施同情用药制度。2019年8月,新修订版《中华人民共和国药品管理法》第23条新增了同情用药的规定:“对危及患者生命且现有治疗手段收效甚微的疾病具有良好治疗效果的临床试验阶段药物,经过医学判断获益大于风险,经伦理审查、患者知情同意,可在特定的医疗机构内用于治疗具有其他相同病情的患者”,这是我国首次在立法层面确立了同情用药制度。
2020年2月,武汉、北京等地医院也在相关部门支持下,启动了瑞德西韦临床试验研究和观察,但目前我国对于同情用药制度的推行仍处于逐步探索阶段,我国同情用药的发展面临诸多现实挑战。
3.2 我国同情用药制度存在的问题
3.2.1 同情用药制度的可操作性不强。我国《药品管理法》仅对同情用药作了概括性规定,并未对同情用药制度的申请人、申请流程、同情用药使用的药物等内容进行明确规定,缺乏进一步规范同情用药制度的细化措施,可操作性不强;2019年新修订的《药品管理法》规定同情用药制度的适用对象为“在开展临床试验的机构内用于其他病情相同的患者”,具有一定限制性,也并未明确说明同情用药申请人需要提供的资料以及有关药物有效性、安全性的数据等[7]。此外,我国《拓展性同情使用临床试验用药物管理办法(征求意见稿)》对同情用药的相关程序作了一些规定,但目前尚未出台正式的、专门的法律性规定,具体申请程序和药物收费等操作层面的问题也不明确。
3.2.2 相关主体权责界定不明确。欧盟同情用药制度明确规定了医生、政府监管机构、伦理委员会、研发企业等主体的具体责任,包括药品不良反应监测与报告、患者知情同意等,形成了相对完善的患者权益保障体系。我国同情用药制度对患者情况、药品风险获益、用药过程、各环节责任主体等均未明确说明。除此之外,有关同情用药制度患者权益一些细节也有待进一步设置,比如:药物费用患者如何支付、患者的个人信息如何保密等。此外我国《药品管理法》规定同情用药仅需经过伦理审查,未规定具体的审批程序,容易造成各责任主体的缺位,不利于同情用药患者的权益保障。
3.2.3 知情同意过程有待完善。同情用药使用的药物是仍处于临床试验阶段,尚未获批上市的药物,其安全性、有效性都有待验证。同情用药作为特殊的用药方式,患者的知情同意比之于已上市药物的使用应该更为关键、完备。对于申请同情用药的患者,由于同情给药为他们提供了最后的治疗机会,患者很可能高估治疗的潜在益处,低估其风险。因此,必须向患者提供有关药物的所有可用数据(特别是不确定的益处和风险),并确保患者了解并能就最终的治疗做出合理的决定。我国《药品管理法》规定同情用药需要经过伦理审查和患者知情同意,但未规定特定的同情用药知情同意的具体内容,伦理审查中同情用药知情同意过程有待完备。
3.2.4 用药主体的公平性难以确保。目前,我国的医疗资源存在分配不平等、不均衡现象,同情用药的关键伦理挑战之一是如何确保公平的患者选择。我国关于同情用药的规定没有明确患者的纳入和排除标准,如何确保公平的病人选择是我们需要考虑的现实问题。当医生对病人进行同情用药时,给谁用药?“选择性治疗”面临伦理与公正的考量。而在没有预先规定的纳入和排除标准的情况下,病人的选择可能会有失公平准则。
4 国外同情用药制度的发展
国外同情用药的发展已有较为丰富的实践,因此,梳理国外同情用药的发展沿革,参考国外的相关做法,对完善我国同情用药制度具有重要借鉴意义。
4.1 美国同情用药的发展沿革
20 世纪 70 年代初,美国率先建立了同情用药制度,美国FDA逐步放开了部分药品的用药限制,在治疗如心血管疾病、肿瘤性疾病等对患者生命有严重威胁的疾病时允许使用研究性新药物(Investigational New Drug,IND)。1987 年,在受理艾滋病患者研究性新药治疗申请时,FDA以法规的形式明确规定了如何提交IND申请、审查IND申请,并明确了IND适用标准以及相应的保障措施[8]。1997年,美国FDA通过的《食品药品管理现代化法案》规定:“对于单个严重患者或紧急情况或满足一定条件的研究性新药允许开展同情用药”,但仅有紧急情况下同情用药的程序[9]。2009 年,美国FDA 新修订了同情用药法规,将同情用药类型明确分为三类(具体如表1所示),即单个患者拓展使用、中等数量患者拓展使用、广泛拓展使用,并明确了3种形式同情用药的使用条件、保障措施、监管要求等,美国同情用药的制度框架基本形成。2016 年,美国颁布《21 世纪治愈法案》(21st Century cure Act),对药物研发企业在同情用药中所具备的权利和所需承担的义务做了更加细化的规定,在法律层面进一步完善了同情用药制度。根据FDA官网数据可知,2015~2019年间,美国药品审评研究中心(Center for Drug Evaluation and Research,CDER)共计收到药物同情使用申请8041份(年均1608份),其中获批申请共计有7899份,各种类型申请批准率较高[10]。同情用药的广泛使用,为严重危及生命疾病的患者提供了救治途径。2015~2019年美国同情用药申请量与批准率详情如下表2所示。

表1 美国同情用药3种扩展使用方案

表2 2015~2019年美国同情用药申请量与批准率
4.2 欧洲联盟同情用药的发展沿革
2001年,欧盟药品管理局(European Medicines Agency,EMA)在指令 2001/83/EC第5条中首次提及在特殊情况下可以为个体患者提供未经上市许可的医疗产品[11]。2004年,欧洲议会和理事会法规(EC)No.726/2004 中第83 条第2款明确界定了同情用药的核心内容为:可出于同情,在已上市药品收效甚微的情况下,将规定类别的医药产品用于治疗严重衰弱性患者或有性命之忧的重症患者[12]。2007年7月,欧盟药品管理局科学委员会和人用药委员会(Committee for Medicinal Products for Human Use,CHMP)向社会公布了同情用药的官方指南[13]。2010 年1月,CHMP首次就欧盟2个同情用药项目奥司他韦(oseltamivir)和扎那米韦(zanamivir)发表了意见以及一份关于奥司他韦同情用药的评估报告,细化了同情用药应用中的具体操作步骤。在药品上市许可方面,欧盟一直致力于统一并简化药品审评和上市许可批准程序,以协调各成员国一致。此外,欧盟药品管理局考虑到各成员国之间国情不同,规定各成员国可根据本国法律和规定,在患者知情的基础上,独立进行同情用药计划。同情用药在欧盟的使用途径如图1所示。
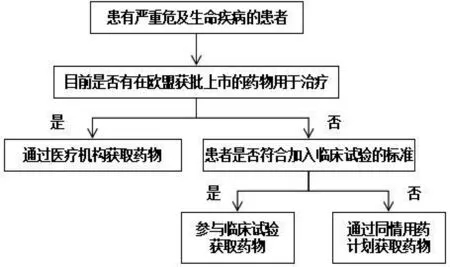
图1 同情用药在欧盟的使用途径
5 我国同情用药制度建设的思考
随着我国医疗保障水平的不断提升,以及医药产业不断创新发展,在我国建立同情用药制度越来越具有迫切的临床价值和社会价值。目前我国同情用药制度的发展仍处于起步阶段,如何借鉴国外成熟的做法,保障我国同情用药的有序推进是当前需要考虑的现实问题。基于对国内外同情用药制度的梳理,结合我国国情,提出以下思考。
5.1 完善相关配套措施,推进同情用药有序发展
我国对同情用药制度仅作了概括性规定,缺乏细化配套措施和正式的法律性规定,可实施性不强。对此,我国应尽快出台更为完善的同情用药法律指南,为依法用药、依法管理提供充分的法律依据;建议我国在充分借鉴美国、欧盟等国家既往经验的基础上,尽快出台相关配套文件,完善同情用药具体程序性规定和细化的配套措施,明确同情用药申请人、申请流程、责任主体等以加速推进我国同情用药稳步有序发展。
5.2 设立申请同情用药的多种通道,提高患者用药可及性
美国、澳大利亚等国家根据患者的紧急情况设立不同情形同情用药申请通道,并对紧急情况的病人进行加急审批。我国同情用药的申请程序应区分不同申请类别的审批程序,分类管理,灵活设置审批时限和申请条件,使同情用药惠及更多的患者。如对于此次新冠肺炎疫情,可以适当增加申请通道,应尽量简化审核程序,为患者提供一个快速、高效的申请流程。同时可以通过线上申请等形式提高申请效率,进一步提高药品的可及性,保障患者的用药权和生命健康权。
5.3 重视伦理审查,加强伦理委员会的建设
同情用药使用的药品在临床试验和上市批准之外,疗效具有一定不确定性,有鉴于此,必须在伦理上有更充分的考量,以保护患者的合法权益作为第一要务。我国《药品管理法》明确规定在开展同情用药之前必须通过伦理审查和知情同意,方可进行同情用药,而法律规定往往具有一定滞后性,因此从伦理层面对同情用药做出合理的规范是非常有必要的。目前我国已经初步形成以伦理委员会为中心的伦理审查机制,但基于同情用药的特殊性,建议国家监管部门对同情用药的伦理审查机构做出特别规定。此外,有关部门要重视和支持伦理委员会的发展建设,加强对伦理委员的教育培训,使之熟悉同情用药相关政策方案,使伦理委员会切实发挥作用,真正做到保护受患者权益[14]。
5.4 保障患者知情同意权,提高公众的理性认知
在死亡面前,患者基于求生本能,易形成认知偏见,导致其对同情使用的药品产生过高的期望,从而对可能存在的风险认识不足,不理想的试验结果往往会加剧医患关系的紧张。完备的知情同意在一定程度上能够避免医患纠纷和减少同情用药的滥用,所以有关部门应加大同情用药的科普力度,促进患者理性认知。此外,应确保患者充分的知情同意,患者及其家属有权了解同情用药潜在的风险,对于是否接受同情用药有权利作出自主选择,充分的知情同意,也能在一定程度上防止同情用药被滥用[15-16]。美国FDA在审批同情用药时,对患者、主治医师在知情同意方面均有明确的要求,我国可以充分借鉴。
综上所述,同情用药制度是在药物获批上市和药物临床试验之外,为已穷尽现有医疗救治手段的危重患者开辟了一条特殊的、尝试用研究性药物的路径,与“患者受益最大化”这一理念相符合。但我们要清楚地认识到,国内同情用药制度的发展目前处于起步阶段,同情用药存在药物安全问题和法律责任风险,并涉及医学伦理学问题,建议在新药法基础上建立完整的管理体系,同时还需要选择性地参考国外成熟的经验,以推进国内同情用药的有序发展,为更多患者带来福音。
