Ephrin-B3在癫痫大鼠海马中的动态表达变化
2021-09-10刘田田滕军放刘恒方
刘田田, 滕军放, 刘恒方, 张 敏, 肖 波
Ephrin-B3蛋白是一种轴突导向蛋白,由Efnb3基因编码,位于17号染色体p13.1。研究表明Ephrin-B3在整合多种突触后膜蛋白、细胞粘附分子、信号成分、其它支架蛋白和突触后致密物中肌动蛋白细胞骨架时发挥重要作用[1]。Ephrin-B3蛋白已被证实参与在肿瘤、心血管疾病中, 推测其与中枢神经系统疾病的发生、发展有着密切联系[2]。癫痫是一组由不同病因所引起,是脑部神经元高度异常同步化放电所导致的疾病,临床上以颞叶癫痫(temporal lobe epilepsy,TLE)最为常见,目前认为由遗传与环境因素共同导致,是难治性癫痫的常见类型[3]。癫痫的发生、发展主要分为急性期、静止期、慢性期3个时期。病理学研究发现,癫痫后海马齿状回颗粒细胞发出的苔藓纤维可异常出芽至齿状回的内分子层,与自体或异体神经元树突建立兴奋性突触联系,这种新的回返性兴奋性环路的形成及强化是脑部神经元同步化放电的机制之一[4]。Armstrong等人研究发现,Ephrin-B3蛋白可与突触后膜上的亲离子型的兴奋性谷氨酸受体NMDA的NR2A、NR2B调节亚单位结合形成复合体,调节突触长时程增强和长时程抑制的功能,参与到神经元突触的可塑性变化[5]。因此,本研究通过检测癫痫大鼠模型中Ephrin-B3蛋白的动态表达变化及变化规律,探讨其在癫痫发生发展过程中的作用。
1 材料与方法
1.1 实验动物和分组 由斯莱克实验动物有限责任公司提供的健康SPF级6~8周龄雄性SD(Sprague-Dawley,SD)大鼠(体重 250~300g),随机将大鼠分为实验组和对照组,在造模后的7 d、14 d、60 d分为3个亚组(每个亚组6只)。
1.2 匹罗卡品癫痫大鼠模型制备 成年雄性SD大鼠称重后,腹腔注射0.9%氯化钠注射液稀释配制127 mg/ml氯化锂(3 mEq/kg)。18~20 h后,腹腔注射0.9%氯化钠注射液稀释的匹罗卡品(25 mg/kg)诱导癫痫持续状态。根据改良的Racine标准对大鼠急性癫痫发作进行严重程度分级[6]。发作达到4~5级即认为大鼠进入癫痫持续状态,提示致痫成功可以入实验组。
1.3 实时荧光定量PCR 分别选取各时间点的实验组和对照组大鼠,将整个脑组织置于冰上操作,剥开表面皮质后可见灰白色海马组织,用镊子快速分离出完整海马组织,根据大鼠立体定位图谱及体视显微镜下找到海马齿状回(DG)区,并用12号钝针头连接负压针管,抽取海马DG区组织,左、右侧分别装于相应标记的1.5 ml冻存管中,迅速置于液氮中冷冻后随即转入-80℃的超低温冰箱中保存备用。称量20 mg海马组织(右侧)放入研钵中,按照相关步骤提取,并予以验证。按照试剂盒上说明书操作cDNA的合成,实时荧光定量PCR,根据Maxima SYBR Green/ROXqPCR MasterMix(2×)(#K0221)试剂盒内说明书进行操作,引物设计应用Beacon Designer 8.0软件(PREMIER Biosoft International,USA),内参选取β-actin。引物序列为:Ephrin-B3 5’-ACTCAGCCTG GAGCCTGTCTAC-3’,5’-CGATCTGAGGGTAAAGCACGTA-3’;β-actin 5’-AATAAGTGGTTACAGGAAG-3’, 5’-GTATTAAGGCGGAAGATT -3’。
1.4 Western blot分析 配制蛋白酶抑制剂 PMSF和RIPA蛋白裂解液的混合液,在使用前数分钟内加入和磷酸酶抑制剂 PhosSTOP(RIPA:PhosSTOP:PMSF体积比100∶10∶1)。取20 mg 海马组织(左侧)放在无菌无酶的1.5 ml EP管中,每20 mg组织加入 200 μl裂解液,液氮浴中匀浆5~10 min 直至组织充分裂解,4 ℃ 12000 rpm离心10 min,离心后取上清液,分装入相应标记的0.1 ml EP管中,-80 ℃冰箱保存;用BCA 法蛋白测定试剂盒,按说明书进行。
1.5 灌注取材与切片 随机选取致痫后7 d、14 d和60 d的大鼠进行灌注取材。完全暴露脑组织后,眼科镊离断连接脑组织的颅神经和脊髓,将脑组织完整取出,手术刀切除小脑脑干,并置于4 ℃ 4%多聚甲醛后固定12 h,随后将固定后的脑组织梯度脱水,即先转入4 ℃ 20%蔗糖溶液沉底,之后置于30%蔗糖溶液中直至沉底,整个过程大约需要72 h。将冰冻切片机温度调至为-20 ℃。将完全沉底后的脑组织取出,手术刀仔细修整脑组织切块,后部朝下放置切片机基座上,调整切片厚度为25 μm,进行连续冠状位切片,并采用多聚赖氨酸处理的防脱玻片进行贴片。
1.6 免疫组化染色 取相同部位解剖部位的大鼠海马组织(Bregma-3.6 mm至-4.0 mm)进行免疫组织化学染色,实验步骤参照实验室既往实验程序及试剂的说明书。免疫组化染色的脑片采用莱卡 DM5000 B 显微镜拍摄图片后采用双盲法使用Imaging-Pro Plus 6.0(IPP)软件对大鼠双侧海马DG区的Ephrin-B3平均光密度进行定量分析,将每个部位6张图片的阳性产物(浅褐色至深褐色)的光密度值合并取均值,作为评估该部位Eprhin-B3的定量分析指标。

2 结 果
2.1 癫痫大鼠行为学观察 实验过程中,我们对于对照组及实验组大鼠进行行为学观察,结果显示:对照组大鼠无痫性发作,活动自如。在SE诱导成功后的7~14 d(急性期、静止期),实验组大鼠均未见自发痫性发作。在60 d(慢性期),可观察到实验组大鼠陆续出现自发痫性发作,主要表现为节律性点头、咀嚼、单侧或双侧前肢阵挛,每次发作可持续数秒至1 min左右不等,发作频率从1 d数次或数天一次不等。无癫痫发作时大鼠活动自如,自由摄食摄水。
2.2 实验组大鼠海马Ephrin-B3 mRNA的表达变化 实时荧光定量PCR方法用于检测致痫后不同时间点大鼠海马中Ephrin-B3 mRNA的表达变化,结果(见图1)。与对照组相比,7 d后匹罗卡品致痫后大鼠海马中Ephrin-B3 mRNA表达有所下降;14 d下降最为明显;60 d有所回升,但仍低于对照组。对照组不同时间点间的Ephrin-B3 mRNA表达无显著性差异(P>0.05)。

图1 致痫后不同时间大鼠海马 Ephrin-B3 mRNA的表达变化。与对照组相比,癫痫后海马Ephrin-B3的mRNA表达下降,并在14 d时下降最为明显,差异有统计学意义。Con:对照组;Ep:癫痫实验组。***P<0.001
2.3 实验组大鼠海马Ephrin-B3蛋白的表达变化 Western blot方法用于半定量分析致痫后不同时间点大鼠海马Ephrin-B3蛋白表达量,结果(见图2)。与对照组相比,7 d后癫痫大鼠海马中Ephrin-B3蛋白表达有所下降(对照组3.19±0.35 vs 实验组1.34±0.31,P<0.0001);14 d下降最为明显(对照组3.06±0.33 vs 实验组1.13±0.06,P<0.0001);60 d有所回升(对照组3.27±0.05 vs 实验组1.59±0.14,P<0.0001),但仍低于对照组。对照组不同时间点间的Ephrin-B3蛋白表达无显著性差异(P>0.05)。

图2 Ephrin-B3蛋白在对照组和癫痫组大鼠海马的表达变化。A:Ephrin-B3蛋白表达的Western blot条带;B:Western blot结果统计分析图。与对照组相比,癫痫后海马的Ephrin-B3在海马中的表达下降,并在14 d时下降最为明显,结果有统计学差异。Con,对照组;Ep:癫痫实验组。***P<0.001
2.4 实验组大鼠海马Ephrin-B3 蛋白分布变化 应用免疫组化染色检测大鼠海马齿状回Ephrin-B3蛋白分布情况,代表性染色图像(见图3)。在对照组大鼠冠状切面中Ephrin-B3主要在齿状回颗粒细胞层和门区的细胞胞膜表达,同时也散在分布于始层、辐射层、透明层和分子层等部位。光密度值结果显示:与对照组比较,致痫后7 d(对照组0.21±0.002 vs 实验组0.13±0.04,P=0.0002);14 d(对照组0.26±0.04 vs 实验组0.097±0.003,P<0.0001);60 d(对照组0.26±0.05 vs 实验组0.217±0.004,P=0.0423)的Ephrin-B3蛋白在海马DG区光密度值均下降,差异有统计学意义。因此,在海马DG区,Ephrin-B3的光密度值与Ephrin-B mRNA的表达趋势一致。
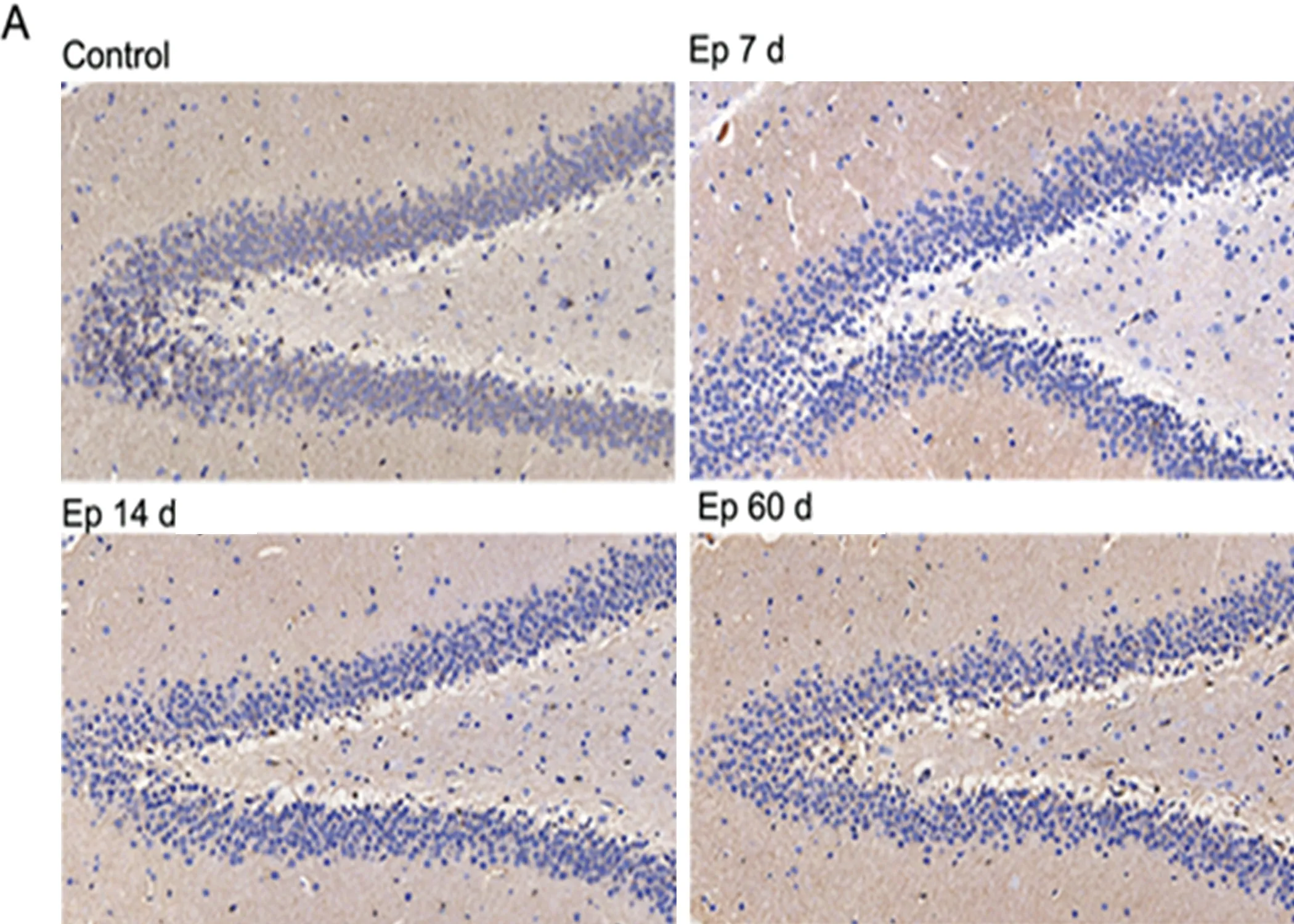
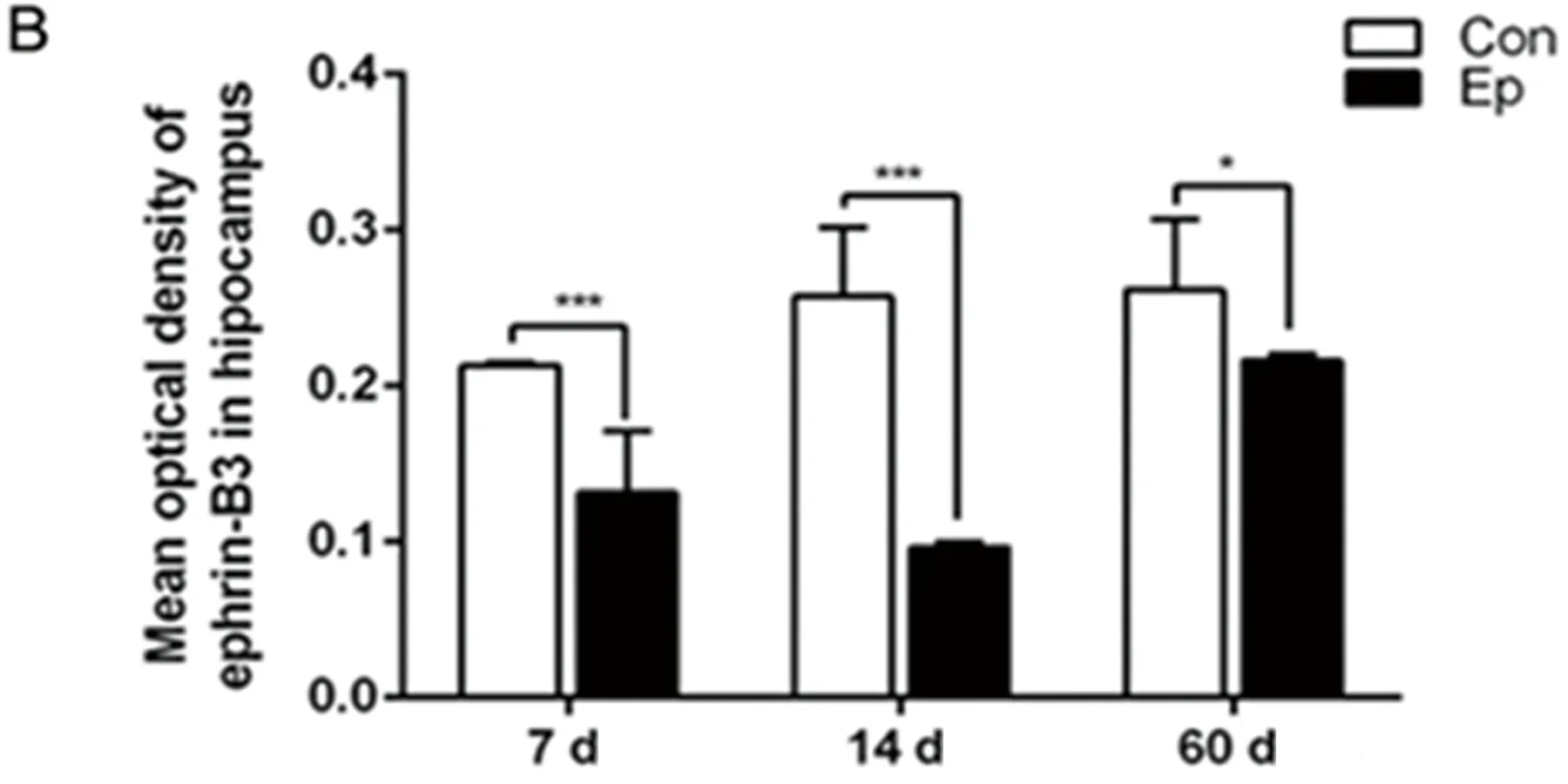
图3 大鼠海马Ephrin-B3蛋白在海马齿状回的表达变化及分布。A:Ephrin-B3蛋白表达分布的代表性免疫组化图;免疫组化结果显示Ephrin-B3主要表达在齿状回的颗粒细胞层的胞膜表达;B:免疫组化结果统计分析图。统计结果显示,与对照组相比,癫痫后海马齿状回Ephrin-B3的表达下降,并在14 d时下降较明显,差异有统计学意义。Con,对照组;Ep:癫痫实验组。Bar=100 μm。***P<0.001;*P<0.05
3 讨 论
海马硬化是人类颞叶癫痫特征性病理改变,主要为海马齿状回门区、CA1及CA3区神经元的丢失,颗粒细胞层弥散化。此外,海马齿状回颗粒细胞苔藓纤维出芽也被认为参与了海马局部环路的突触重塑,突触重塑可打破局部兴奋性和抑制性系统平衡,导致了痫性电活动的产生[7]。匹罗卡品癫痫动物模型中发现,大鼠海马脑片的异位新生神经元静息电位降低,兴奋性增高,具有自发性爆发放电能力,成为自发性癫痫发作的重要诱导因素[8]。但迄今为止,海马新生神经元兴奋性增高的具体分子机制尚不明确。
近年来Eph/ephrin家族蛋白由于其独特的受体-配体结构和特有的双向信号转导通路,在神经发育研究中备受关注。已有研究证实Eph/ephrin家族蛋白通过调控轴突导向、细胞迁移、突触形成等多个环节,参与学习和记忆[9]。研究表明Ephrin-B3配体蛋白可能参与调节中枢神经系统的多种病理生理活动,包括神经元增殖和迁移、轴突生长和导向、突触形成和成熟、血管新生等[10]。在胚胎发育过程中,视前区 EphB1/ephrin-B3的逆向信号转导可以产生两种作用,一方面可阻碍中间神经元向纹状体迁移;另一方面可终止纹状体细胞迁移至纹状体以外的区域[11]。Eph/ephrin蛋白家族在对于颞叶癫痫异常神经网络突触可塑性中的作用研究可作为新的作用靶点有望在人类癫痫治疗中取得新的进展;有望挖掘癫痫药物治疗新靶点。
在本研究中,为了更好的观察Ephrin-B3在癫痫发病中的作用,本研究采用经典的匹罗卡品癫痫大鼠模型,分别于癫痫持续状态诱发后的7 d、14 d、60 d取海马组织进行检测,发现在癫痫持续状态后急性期,Ephrin-B3表达下降,在静止期下降显著,并且在慢性期表达仍然下降,提示Ephrin-B3在海马组织的动态变化可能是颞叶癫痫慢性自发癫痫形成的机制之一,我们推测随着癫痫的发生发展,神经元损伤、神经元迁移异常与微环境的改变可能是导致Ephrin-B3蛋白水平下调的原因[12]。Piccinin等人研究发现Ephrin-B3蛋白通过抑制海马CA1区的谷氨酸受体mGlu(group-I metabotropic glutamate receptor,mGlu),诱导海马的长时程抑制[13]。在体外培养的海马神经元中,EphB2受体与Ephrin-B3结合,调节兴奋性突触前后膜的聚集和成熟,影响兴奋性神经元树突棘的形成[14]。
本实验的研究发现,癫痫大鼠海马中的Ephrin-B3在早期表达下降,并在静止期时下降明显,慢性期有所回升,这与一些文献报道不一致,有学者检测人类颞叶癫痫患者的颞叶皮质中Ephrin-B3配体及受体EphB3的表达,发现Ephrin-B3及EphB3的表达有所增加,接着在颞叶癫痫大鼠的颞叶皮质及海马CA1区检测也有所增加[15]。此外,我们之前对于Ephrin-B3在皮质发育不良中的研究发现Ephrin-B3在皮质发育不良癫痫大鼠脑组织中的表达增高。究其原因,可能由于研究的动物模型的差异,样本量的不同,时间点的不同,以及大脑部位取材的不一致,我们主要研究海马齿状回的颗粒细胞下层,而Huang等人是对颞叶皮质及海马的CA1区Ephrin-B3表达进行检测;因而我们推测Ephrin-B3是否在不同的细胞中与不同的Eph受体结合发挥相应的生理功能。鉴于此,我们拟计划收集人类颞叶癫痫的海马组织标本,在不同海马分区中检测Ephrin-B3的表达分布情况,为探讨Ephrin-B3在颞叶癫痫发生中的作用提供更多的实验依据。
