屠宰场待宰生猪及其屠宰过程中金黄色葡萄球菌的污染检测与分析
2021-09-10郝勇航刘俊峰刘璐函王鑫盛吴秋玲贺恒旭陈丽颖杨霞宋合强
郝勇航,刘俊峰,刘璐函,王鑫盛,吴秋玲,贺恒旭,陈丽颖,2,杨霞,2,宋合强
(1.河南农业大学动物医学院,河南 郑州 450002;2.河南省动物性食品安全重点实验室,河南 郑州 450002; 3.河北省涿州市农业农村局,河北 保定 072750)
金黄色葡萄球菌 (Staphylococcusaureus)在自然界中包括空气、动物粪便、皮肤、鼻腔等处广泛存在,可以污染大多数食品,尤其在肉类和肉制品中的污染最为严重,是引起人类和动物感染及导致人类食源性疾患(food-borne illness)的主要病原菌之一[1-2]。据美国疾病预防控制中心报告,由金黄色葡萄球菌感染引起的疾病仅次于大肠杆菌[3]。金黄色葡萄球菌极易感染动物和人,可引起呕吐、发热、腹泻,甚至能致脓毒症、败血症等全身疾病,其致病力与肠毒素(staphylococcal enterotoxin,SE)密切相关,而其在代谢过程中产生的肠毒素能引起人和动物严重的食物中毒,因此该菌一直是重点监管的食品病原菌[4-6]。
耐甲氧西林金黄色葡萄球菌(MRSA)自从20世纪60年代首次发现以来,在世界范围内迅速传播,尤其是在生猪及其肉制品中的散播已经成为普遍关注的公共卫生问题。由于MRSA的毒力较强,且能耐受多种抗菌药物,因此临床上由MRSA感染引起的疾病往往难以治疗[7]。在中国,由于养殖场的卫生条件不佳,作为条件致病微生物,金黄色葡萄球菌常常引起猪葡萄球菌病,影响养猪业发展。同时,随着抗生素的滥用和乱用,导致耐药菌株不断产生,治疗效果不佳,而给养猪业造成严重的经济损失[8-9]。
本研究在陕西省和河北省部分地区屠宰场采集待宰生猪及其屠宰环节猪体和屠宰场内部环境样本,进行了细菌分离与一系列鉴定,检测了金黄色葡萄球菌与MRSA菌株的流行分布及毒力基因携带情况,以调查其在生猪养殖到屠宰等各个环节中污染与传播规律,为其防控提供一定的数据依据。
1 材料与方法
1.1 样品的采集
以无菌操作,在不同时间点(2019-09-15和2019-12-15)从陕西省咸阳屠宰场采样2次,分别标记为屠宰场1a和屠宰场1b;在河北省保定某屠宰场(2020-01-10)采样1次,标记为屠宰场2。3次共采集生猪鼻腔拭子、体表拭子及环境样品745份,其中包括每次采集空气样5份,烫毛水样10份。第一次在咸阳屠宰场(1a)采集待宰鼻腔拭子、电麻鼻腔拭子、卸头鼻腔拭子样品各40份,劈半体表拭子、脱毛体表拭子、冷库体表拭子各30份,共采集样品225份;在屠宰场1a采样后,为进一步检测环境样品对试验的影响,在屠宰场1b和屠宰场2采集工人使用的刀具柄样品各5份,麻电环节地面、下白脏地面及胴体冷却间的地面各采集样品10份。第二次从咸阳屠宰场(1b)采集待宰鼻腔拭子、电麻鼻腔拭子、卸头鼻腔拭子各40份样品,劈半体表拭子、脱毛体表拭子、冷库体表拭子各30份样品,共采集样品260份;在保定屠宰场2采集待宰鼻腔拭子、电麻鼻腔拭子、卸头鼻腔拭子各40份样品,劈半体表拭子、脱毛体表拭子和冷库体表拭子各30份,共采集样品260份。
1.2 增菌与细菌分离培养
样品的预处理、增菌与常规细菌学分离培养按照国家食品微生物检验标准GB 4789.10—2016[10]金黄色葡萄球菌的检验程序和方法进行,并适当加以改进。
1.2.1 预增菌 将采集的拭子样品以及烫毛水池中的水样取1 mL分别置于含有无菌BPW(缓冲蛋白胨水)的离心管中,与空气样(将10 mL的无菌BPW置于50 mL的EP管中,分别暴露于屠宰场不同区域采集空气样品)36 ℃, 160 r·min-1振摇培养15 h;对采集的鼻腔拭子置于含有无菌7.5%氯化钠肉汤中,36 ℃ 160 r·min-1振摇培养20 h。
1.2.2 增菌 用上述置于含有无菌BPW(缓冲蛋白胨水)的离心管中的预增菌液1 mL,接种于5 mL的7.5%氯化钠肉汤中,36 ℃ 160 r·min-1振摇培养20 h。
1.2.3 细菌分离 在无菌环境中用接种环蘸取7.5%氯化钠肉汤的增菌液,画线接种于Baird-Parker琼脂平板预筛选,37 ℃培养24 h。挑选可疑菌落进行PCR鉴定。对PCR鉴定的疑似菌使用金黄色葡萄球菌显色培养基进一步筛选,37 ℃培养24 h。将金黄色葡萄球菌显色培养基筛选的菌体接种于BHI肉汤中活化后,画线接种于MRSA显色培养基,37 ℃培养24 h。BPW、7.5%氯化钠肉汤和Baird-Parker琼脂均购自青岛高科技工业园海博生物科技有限公司。金黄色葡萄球菌显色培养基和MRSA显色培养基均购自上海欣中生物工程有限公司。2×Rapid Taq Master Mix购自南京诺唯赞生物科技有限公司。细菌基因组DNA快速抽提试剂盒购自上海生物工程有限公司。
1.3 引物的选择与合成
以金黄色葡萄球菌细胞壁形成相关基因femB作为靶基因(依据GenBank上公布的序列)设计引物及利用文献报道的MRSA基因mecA引物[11]和16S rRNA基因通用引物[12]。引物均由上海生物工程有限公司合成。各引物序列及扩增长度见表1。
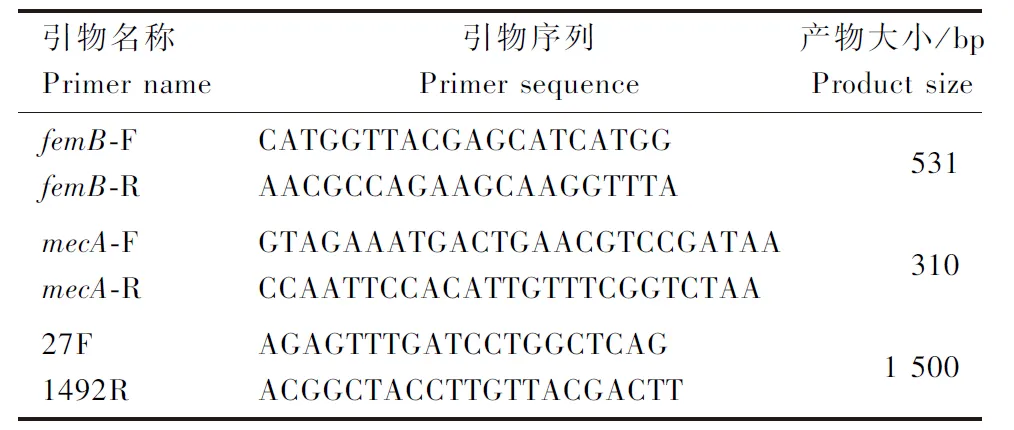
表1 检测金黄色葡萄球菌femB、mecA及16S rRNA基因的PCR引物Table 1 PCR primers for detection of S.aureus femB, mecA and 16S rRNA genes
1.4 基于金黄色葡萄球菌femB和MRSA的mecA基因的PCR扩增
模板DNA提取的具体操作步骤参考细菌基因组DNA快速抽提试剂盒的说明书。PCR反应采用20 μL的反应体系,组分如下:2×Rapid Taq Master Mix为10 μL,上下游引物各0.5μL,DNA模板2 μL,去离子水7 μL。按照以下反应程序进行扩增:94 ℃预变性5 min,94℃变性40 s,55 ℃退火40s,72 ℃延伸40 s,35个循环,72 ℃延伸5 min,同时设立阴性对照。反应结束后,将PCR扩增产物用1.0%琼脂糖凝胶进行电泳检测。
1.5 16S rRNA基因序列扩增及序列测序与分析
选择通用引物27F和1492R作为上、下游引物,建立了50 μL的反应体系:引物27F和1492R各1 μL;2×Rapid Taq Master Mix为25 μL;模板DNA为2 μL;去离子水21 μL。PCR扩增程序:94 ℃预变性5 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min 30 s,选择30个循环,72 ℃延伸7 min,最后4 ℃保存并设立阴性对照。可以选用27F和1492R作为测序引物,将16S rRNA基因扩增的序列送上海生物工程有限公司进行双向测序。
1.6 金黄色葡萄球菌分离株肠毒素基因检测
通过相关文献报道[13]的部分毒力基因对筛选出的金葡菌进行毒力基因筛选。毒力基因的引物及扩增长度见表2。PCR反应为20 μl的反应体系:2×Rapid Taq Master Mix为10 μL,上、下游引物各1 μL,DNA模板2 μL,去离子水6 μL。按照以下反应程序进行扩增:94 ℃预变性5 min,94 ℃变性40 s,退火40 s,72 ℃延伸40 s,35个循环,72 ℃延伸5 min,同时设立阴性对照。

表2 金黄色葡萄球菌10个毒力基因PCR扩增引物 Table 2 PCR primers for 10 staphylococcal virulence genes
利用SPSS软件对检测数据进行方差分析,并进行F值检验。
2 结果与分析
2.1 金黄色葡萄球菌的总体检出情况
使用国家标准GB 4789.10—2016的分离、金黄色葡萄球菌显色培养基筛选、PCR鉴定及16S rRNA基因检测等方法筛选金黄色葡萄球菌,金黄色葡萄球菌femB基因部分PCR鉴定结果如图1A所示。将测序所得的16S rRNA基因序列在NCBI网站导入Blast程序,通过16S rRNA基因测序再进行同源性比对确定分离菌种属关系,部分扩增结果如图1B所示。
从745份样品中共分离鉴定出98株金黄色葡萄球菌菌株,阳性率为13.2%(98/745)。其中屠宰场1a和屠宰场1b的样本中金黄色葡萄球菌分离率分别为15.6%(35/225)和10.4%(27/260),屠宰场2的样本中金葡菌分离率为13.8%(36/260),这显示在不同批次、不同屠宰场样本中的金黄色葡萄球菌的污染率比较接近(P>0.05)。
2.2 金黄色葡萄球菌在待宰生猪及不同屠宰环节样本中分布情况
对待宰生猪和屠宰场各个环节的金葡菌检出情况如表3所示。从表3可以看出,猪鼻腔拭子样本中金葡菌阳性率最高,在待宰、麻电和卸头环节中分别为23.3%、15.8%和22.5%,平均检出率为20.5%,明显高于体表拭子样本(劈半10.0%、脱毛2.2%,冷库4.4%;平均5.5%)(P<0.01),这说明,待宰生猪及宰后猪鼻腔为金黄色葡萄球菌主要污染部位。为了解屠宰场内部环境及器具的金葡菌污染情况,在采样中增加了环境样品的采集(空气、刀具柄、麻电环节地面、下白脏地面及胴体冷却间地面),结果在刀具柄样本中检测出3株金黄色葡萄球菌(3/15),在麻电、下白脏及冷却间地面样本中检测出5株金黄色葡萄球菌(5/60),而在空气样本中也有金葡菌检出(1/15)。这说明,屠宰加工用具和车间环境中存在着金黄色葡萄球菌污染,尤其是在卫生管理较差的屠宰场(屠宰场2)金黄色葡萄球菌的污染较为严重,其环境样本的金葡菌阳性率高达15.0%。这将对猪肉生产加工带来致病菌二次污染的风险。
图1 部分金黄色葡萄球菌分离株femB基因及16S rRNA基因PCR扩增电泳图 Fig.1 Electrophoresis of PCR products for femB and 16S rRNA genes of some staphylococcal isolates
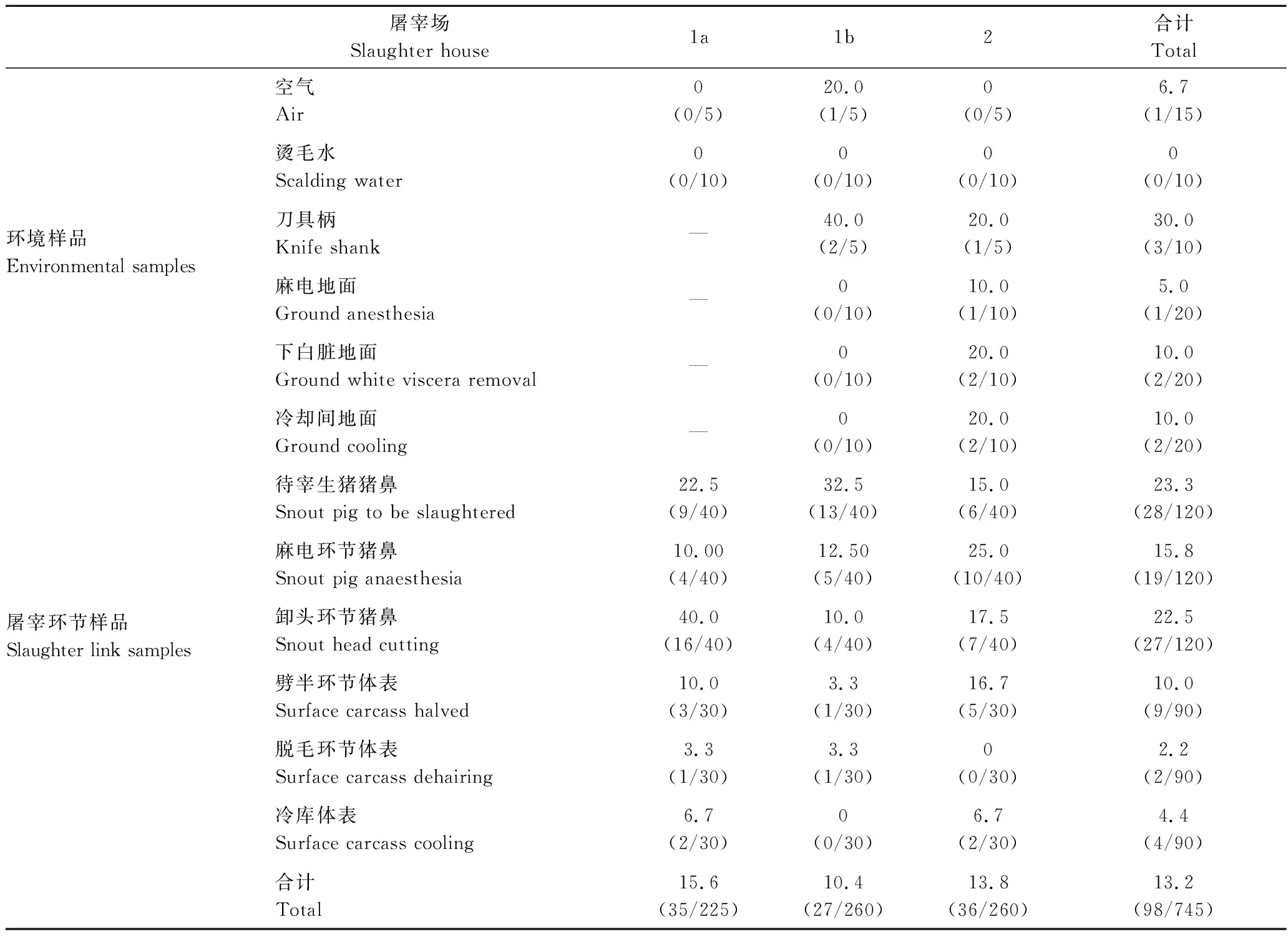
表3 不同地区各屠宰环节及环境样品中金葡菌的分离情况Table 3 Prevalence of S.aureus in various slaughtering stages and environmental samples%
基于mecA基因的耐甲氧西林金黄色葡萄球菌筛查采用PCR方法。结果(表4)显示,98个金黄色葡萄球菌分离株中有12个为MRSA菌株(12.2%),其中除了1株来自屠宰场1b麻电鼻腔环节外,其余11株均来自屠宰场2,具体为包括下白脏地面2株、冷却间地面1株、待宰生猪鼻腔2株、麻电鼻腔2株、卸头鼻腔1株、劈半体表1株及冷库体表1株。
针对10个肠毒素基因Seb、seg、sei、sek、sem、sen、seo、seq、ser、seu的结果(图2)显示,肠毒素基因的总体检出率为10.6%(104/980),其中以sem、sei、sen、seg、sek的检出频次较高,依次为19、15、15、14和14。在屠宰场1a(35株)、屠宰场1b(27株)和屠宰场2(36株)不同批次分离株中,携带肠毒素基因的菌株数分别为15、8和16,分别占所在批次的42.9%、29.6%和44.4%。从来源来看,待宰环节和屠宰不同环节的大部分金葡菌分离株携带肠毒素基因数均≤3个,但检出率没有明显规律。肠毒素基因在MRSA菌株与非MRSA菌株中的检出率分别为13.3%和10.2%,二者没有明显的相关性(P>0.05);其中MRSA菌株中有4株携带有肠毒素基因(33.3%,4/12)。但值得注意的是,来自屠宰场2的2个MRSA菌株均携带≥5个肠毒素基因,这提示了毒力基因与MRSA菌株高致病性的关联性。
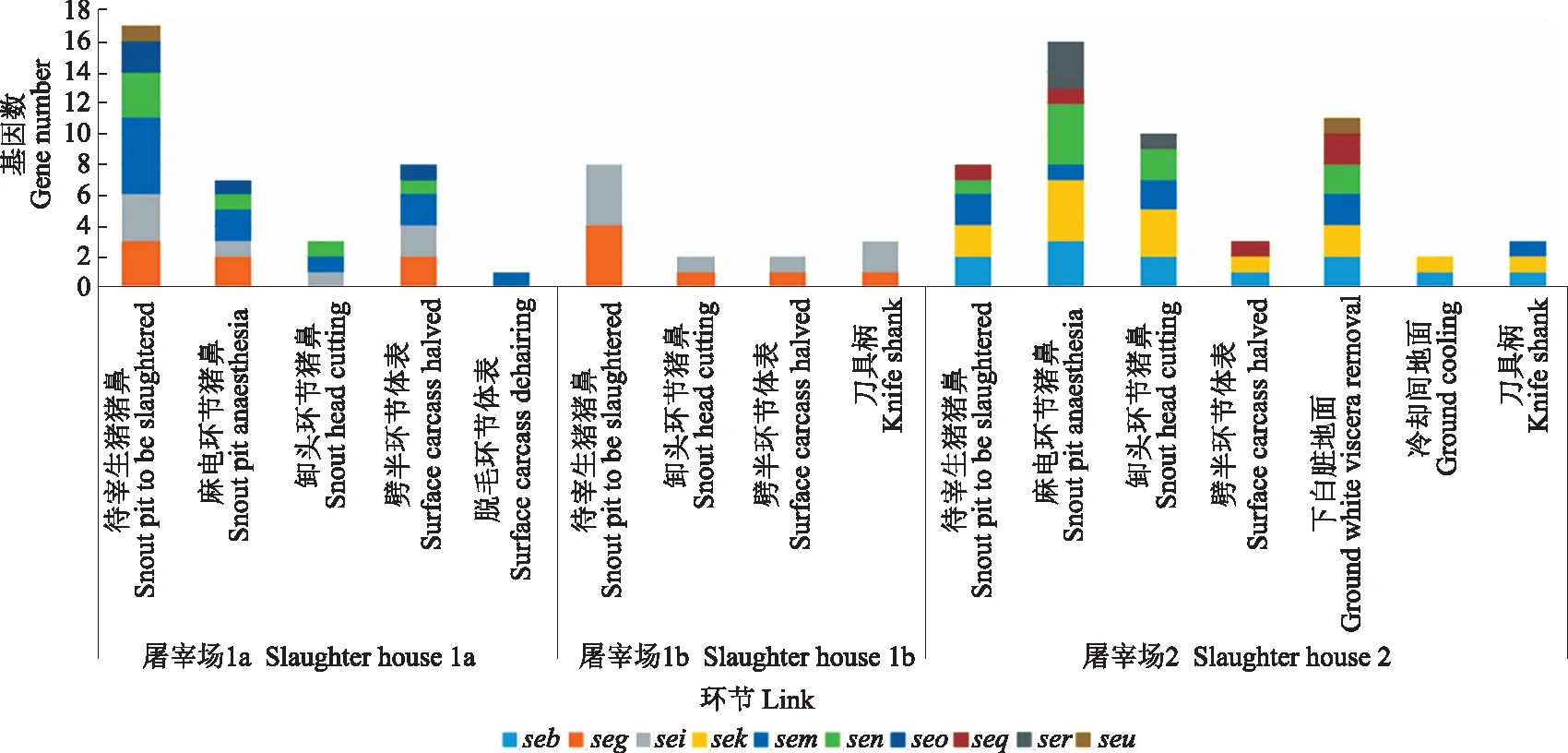
注:纵坐标代表肠毒素基因个数,横坐标代表不同屠宰场的各个环节;未标记的表示未检测出毒力基因。Note: The ordinate: number of enterotoxin genes; The abscissa: stages in 3 slaughter houses; Absent: no virulence gene detected.
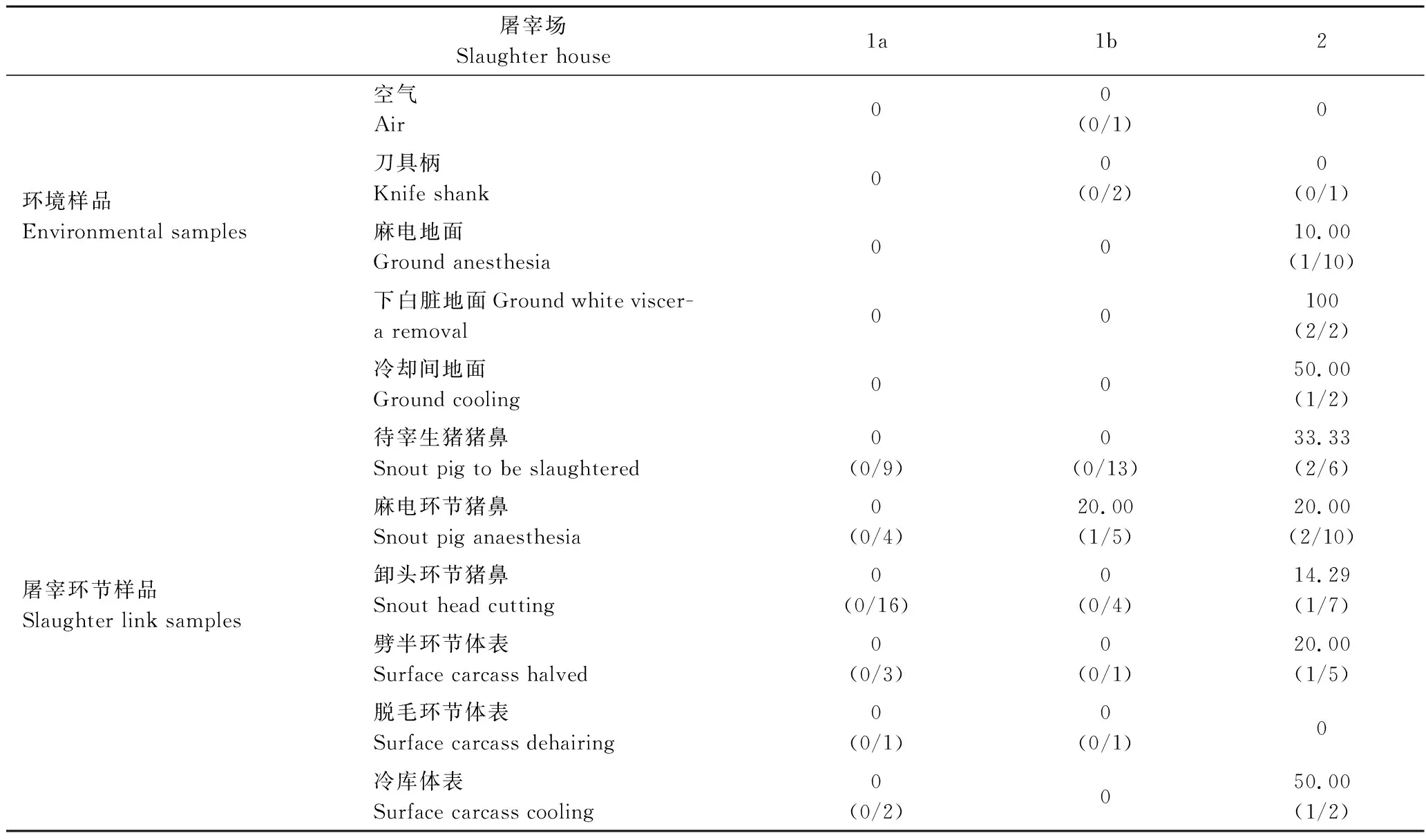
表4 不同地区各个屠宰环节及其环境分离株中MRSA的分离情况Table 4 MRSA isolates in various slaughtering stages and environment samples in different regions %
3 讨论
本研究表明,在屠宰场待宰生猪、屠宰胴体及环境等环节均存在金黄色葡萄球菌污染,而以待宰生猪的带菌率最高;在不同地区、不同季节的样本中金葡菌的阳性率比较接近;在屠宰链中,该菌在脱毛后体表样本中的检出率有显著下降,推测其原因可能是屠宰过程中的体表冲洗、脱毛和燎毛等环节清除或杀死了部分金葡菌,但卸头鼻拭子中金葡菌检出率与麻电环节相比并没有明显减少,说明烫池水温度并不足以杀灭鼻腔中的致病菌。从不同环节来看,待宰生猪鼻腔和宰后猪鼻腔拭子中金黄色葡萄球菌检出率明显高于其他环节,与张静等[14]的研究数据相近,但明显低于聂青等[15]的报道。本研究中的金葡菌总体检出率(13.2%)低于谷立惠等[16]和HE等[17]的报道。造成上述差异的原因可能与样本采集地域、季节、数量、生猪来源以及屠宰场卫生状况等有关。此外,本研究在屠宰场2的刀具柄和麻电、下白脏及冷却间地面等样本中均检出了金葡菌,而且其6个分离株中有3个是MRSA菌株,这提示了极高的金葡菌环境污染风险。
mecA基因是编码产生青霉素结合蛋白PBP2a的外来结构基因,只存在于MRSA菌株中,因此可通过基于mecA基因的PCR检测及MRSA显色培养基筛选来进行耐甲氧西林金黄色葡萄球菌菌株鉴定[18-19]。金黄色葡萄球菌肠毒素(SEs)是一类外源性超抗原,能激活产生大量促炎细胞因子和趋化因子,导致发热、低血压和休克[20-21]。本研究结果显示,虽然金黄色葡萄球菌在不同场(批次)中的检出率接近,但MRSA菌株的检出率差异巨大。其他研究也表明不同农场之间及不同地区MRSA阳性率有显著差异[22-23]。
MRSA菌株的肠毒素作为一类结构相关、毒力相似的外毒素,在临床中能够引起腹泻等症状,其在食品中不因加工而灭活,至今已发现几十种葡萄球菌肠毒素及定位其基因。汪永禄等[24]对55株医院临床标本分离的金黄色葡萄球菌中检出40株肠毒素基因阳性;曹虹等[25]对67株MRSA临床分离株肠毒素基因检测, 阳性率为100%。本研究中共检测39株金黄色葡萄球菌携带肠毒素基因(39.8%),高于张阳等[13]报道养猪场菌株比例(11.8%),也证实了肠毒素基因携带情况的差异与样本、地域及环境等因素有一定的关系。特别值得注意的是,本研究分离的2个MRSA菌株中携带有≥5个肠毒素基因,提示了MRSA对于肉食品具有严重的安全风险。
