核磁共振技术结合化学计量学分析不同来源单花蜜的差异
2021-09-09耿珠峰
沈 葹,耿珠峰,何 清,卓 勤*
(1 中国疾病预防控制中心营养与健康所 国家卫生健康委员会微量元素重点实验室 北京 100050 2 北京师范大学分析测试中心 北京 100875 3 天津大学化工学院 天津 300350)
蜂蜜为蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经充分酿造而成的天然甜物质[1-2]。常见的蜂蜜品种是根据蜜源植物划分,我国针对天然蜂蜜来源于1 种或2 种以上蜜源的植物花蜜划分为单花蜜和百花蜜。不同的蜜源植物具有结构多样的次生代谢产物,其通过蜜蜂的酿造作用转化成蜂蜜中的特征代谢产物,受植物源的生物合成途径、地理气候、储存方式等多种因素的影响,可作为判别蜜源、区别不同产地的依据[3-4]。
溯源检测技术在蜂蜜品种鉴定中起到重要的技术支持作用,相较传统上确定蜜源植物主要运用的感官鉴定和花粉分析法,目前新的分析技术正逐渐被应用于蜜源鉴别,涉及的检测技术主要有色谱分析[5]、近红外光谱[6]、核磁共振波谱法[7]、电感耦合等离子体质谱[8]和分子生物学[9]等。基于蜂蜜理化分析数据模式评价,通过多种溯源技术对蜂蜜化学成分进行差异化分析,判断植物源,正逐渐成为国内外蜂蜜品种鉴别的热门研究方法,我国在此领域的研究相对薄弱。
目前的研究强调特写模式,存在标准品的瓶颈以及检测器的局限性,对蜂蜜的全面化学信息获取有限,缺乏对于不同单花蜜差异代谢产物的系统分析。随着系统生物学的发展,植物代谢组学作为代谢组学的一个重要分支,以植物及其代谢产物为对象的系统生物学研究,被广泛应用于食品研究领域[10]。核磁共振可提供丰富的代谢物结构信息,且具有理想的信号重现性与前处理简便等特点,对丰度较高的代谢产物分析能力强,因此核磁共振分析已成为代谢组学的重要分析技术,运用到多种食品掺假及鉴别分析中[11-13],然而由于NMR 所得到的代谢组学信息复杂,因此选择合适的数据分析方法对于从海量数据中分析差异,挖掘并提炼出各代谢物之间潜在的相关关系非常重要。目前国内核磁共振波谱法结合化学计量学分析方法在蜂蜜蜜源差异分析和鉴别领域的应用仍然较少。本研究基于植物代谢组学差异化分析的策略,优化前处理方法并采用核磁共振波谱技术构建洋槐蜜、荆条蜜、葵花蜜和麦卢卡蜂蜜的全景代谢物分析谱图,结合化学计量学的方法,基于不同的判别分析模型对4 种单花蜜进行差异化分析及代谢物之间的关系研究,为不同蜜源的蜂蜜品种鉴别和品质分析提供科学方法。
1 材料与方法
1.1 样品采集与制备
联系知名品牌厂家直接采集70 个商品蜜样品,分别为26 个洋槐蜜(产地:北京、陕西和山东)、19 个荆条蜜(产地:北京和山东)、14 个葵花蜜(产地:内蒙古和甘肃)和11 个麦卢卡蜜(新西兰),均为市场主流商品蜂蜜且价格相差大。所有的蜂蜜样品均在4 ℃的冰箱中贮藏待用。
称取蜂蜜约20 g,加入35 mL 10%氯化钠水溶液加热超声提取,加入15 mL 1%甲酸乙腈旋涡振荡5 min,5 000 r/min 离心5 min,取上层乙腈层,采用减压旋转蒸发仪于40 ℃浓缩蒸干,用600 μL 氘代甲醇溶解,核磁上机分析。
1.2 仪器与试剂
AVANCE III 核磁共振波谱仪及Topspin 3.2软件,德国布鲁克公司;ME204 电子天平,瑞士梅特勒-托利多仪器有限公司;旋转蒸发仪,德国IKA 公司;高速离心机、涡旋混合器,德国Eppendorf 公司;KQ5200E 型超声波清洗仪,昆山市超声仪器有限公司;5 mm 核磁管,美国Norell 公司;含体积分数0.03% TMS(三甲基硅烷)的甲醇-d 4 (≥99.8 atom % D)、氯化钠、甲酸,Sigma Aldrich 公司;乙腈(色谱纯级),赛默飞世尔公司。
1.3 数据采集与处理
noesypr1d 脉冲序列采集样品,采用预饱和方法进行水峰抑制,核磁参数为:
延迟时间(d1)3 s,谱宽(SWH)8 012.82 Hz,中心频率 (O1)2 350.61 Hz,采样点数(TD)32 768,信号累加次数(NS)128 次,空扫次数(DS)4次,自动接收增益(rga),试验温度(298.0±0.1)K,压制脉冲功率51.04 dB。
采用Mestrenova 14.0 对核磁数据进行处理,对得到的一维1H NMR 谱图进行基线校正和相位校正,基线校正选择伯恩斯坦多项式,以溶剂内标3-三甲基硅烷基-1-丙基磺酸钠(TMS)化学位移为0.000 定标,将处理好的NMR 谱图在δ=0.5~10化学位移范围按照每段宽度为0.004 进行分段积分,构成2 350×70 矩阵,剔除δ=3.30~3.38(甲醇溶剂残留信号)和δ=4.80~4.97(水残留信号)区间的信号,对信号峰的峰面积进行归一化处理,将所得到的积分数据导入Excel 文件,以样本种类为X变量,分段积分峰面积为Y 变量导入SIMCA 14.0 软件(v14.0,Umetrics,瑞典)分别进行主成分分析(PCA)、偏最小二乘判别分析(PLS-DA)和正交偏最小二乘判别分析(OPLS-DA)。
2 结果与讨论
2.1 蜂蜜1H NMR 的前处理方法优化
蜂蜜中以糖类为主要成分,此外还含有游离氨基酸、黄酮类和酚酸类物质。蜂蜜的1H NMR 谱图可分为3 部分,分别是脂肪区(δ=0.5~3.0),糖类化合物区(δ=3.0~6.0)和芳香区(δ=6.0~10.0),不同区域信号的差异体现了不同蜜源蜂蜜的代谢物差异,为了更好地获得不同区域的信号,本研究参考文献[14-17]对比了4 种前处理方法:一是取10 g蜂蜜样本,用15 mL 去离子水溶解,置于50 mL 离心管中,加入15 mL 三氯甲烷振荡10 min,10 000 r/min,4 ℃离心15 min,收集氯仿层,旋蒸浓缩蒸干,600 μL 氘代氯仿溶解后上机分析信号区域集中在δ=3.0~5.0 之间,然而该法易乳化提取效率低,脂肪酸信号干扰强度大;二是取20 g 蜂蜜样本,用15 mL 去离子水超声溶解,用1 mol/L HCl调pH 值至1,过滤后吸取600 μL 待测溶液加入100 μL 丙酸三甲硅钠(Sodium trimethylsilylpropionate,TSP),采用预饱和压制水峰法测试,发现葡萄糖和果糖会掩蔽其它化合物的信号;三是取10 g 蜂蜜样本各2 份,用50 mL 水溶解,用1 mol/L HCl 调pH 值至2,分别用Amberlite XAD-2 (2 cm×20 cm)柱色谱和Oasis HLB (500 mg)固相萃取法,酸水洗脱后用甲醇收集样品,旋蒸浓缩蒸干,用600 μL 氘代甲醇溶解,核磁分析显示该前处理方法可较好地去除糖信号的干扰,将次生代谢产物的信号显示出来,然而由于这类化合物的含量较低,10 g 的取样量用核磁分析基线噪音大,增加了积分的不准确度;四是基于DLLME 原理优化出1.1 节的样品制备方法,分析显示在δ 0.5~10.0 范围的不同区域均获得了良好的信号,可以有效地将糖信号和次生代谢产物信号的差异一并体现(图1),从而建立单花蜜的整体代谢物指纹谱,且提取效率高,适用于核磁分析样本的代谢组学前处理方法。
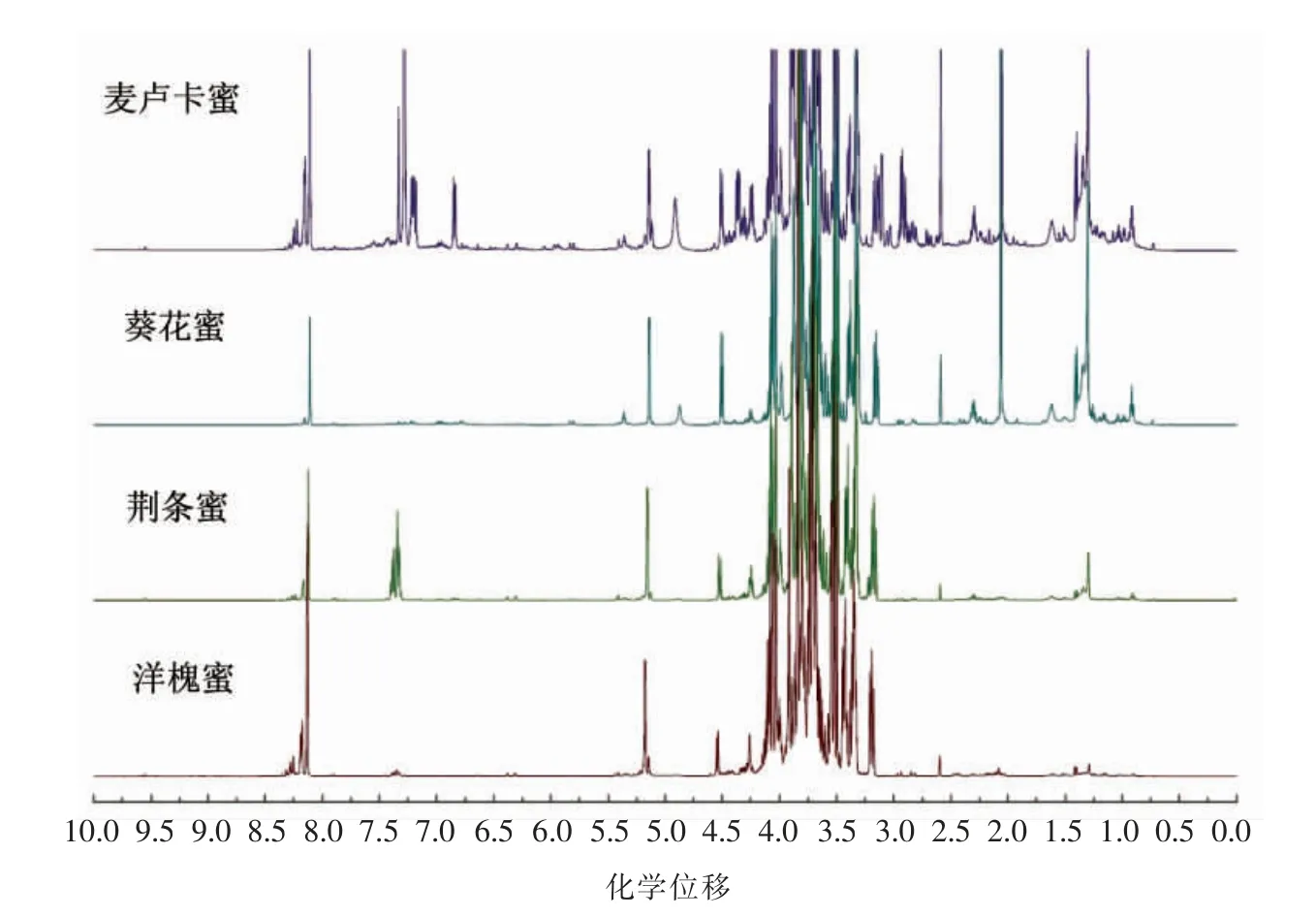
图1 葵花蜜、麦卢卡蜜、荆条蜜和洋槐蜜的1H NMR 谱(氘代甲醇,500 MHz)Fig.1 1H NMR spectra of sunflower honey,Manuka honey,vitex honey and acacia honey (MeOD,500 MHz)
2.2 多元统计分析
2.2.1 数据预处理 代谢组学数据一般都呈现一个偏态分布(右偏),因此首先对所有变量进行log转换使数据更为对称,其次根据Hotelling’s T2 Range 计算是否满足正态分布,选择T2 值满足99%置信区间的变量作为观察变量,本研究所有变量均满足正态分布可纳入观察。此外在蜂蜜中,不同类型化合物含量差别很大,如糖类化合物含量较高,游离氨基酸、酚酸和黄酮等成分含量低,为避免浓度差异对结果的影响,提高模型的预测能力,优化数据信息的提取,本研究对比了3 个不同标段换算方式对数据的影响,其中中心化换算(Mean Center Scaling,Ctr)得到的NMR 的线性负载图与原始谱最为接近,但对模型的解释能力较差,自适换算(Unit Variance Scaling,UV)有利于分析含量较低代谢物的变化趋势,但得到的NMR 线性负载图畸变较为严重,而帕莱托换算(Pareto Scaling,Par)集中了中心化换算和自适化换算的优缺点,本课题采用Par 换算可获得理想的模型评价质量参数 (R2X=0.770,R2Y=0.932,Q2=0.876),其中R2代表模型对数据矩阵的解释能力,Q2代表模型整体的预测能力。
2.2.2 主成分分析 采用非监督模式(PCA)对所有蜂蜜样品进行差异分析,其优势是能在不具备任何样品分组信息的情况下通过对高维数据降维,实现所有蜂蜜代谢物内在关系的可视化,PCA分析前3 个主成分特征值累积占总方差70.63%,其中第1 主成分占50.1%,如图2所示,根据PCA得分图可以看出,麦卢卡蜂蜜和其它3 种蜂蜜明显区分,集中在第2 象限,洋槐蜜集中在第1 象限,葵花蜜集中在第4 象限,而荆条蜜靠近中心位置,表明其特征性不明显。
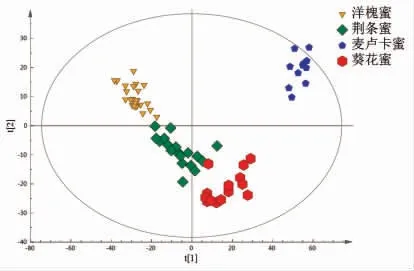
图2 蜂蜜PCA 得分图Fig.2 PCA score plots of honeys
2.2.3 模型识别与验证 通过多变量分析建立模型的可靠性验证是进行后期数据分析的重要前提,为了进一步运用OPLS-DA 模型建立代谢物表达量与样品类别之间的关系模型,实现对样品类别的预测,避免模型获得分类的偶然性,需先通过模型验证的PLS 模型再进行OPLS-DA 处理。本研究分别通过内部验证和外部验证2 种方法对模型进行识别和验证,内部验证以模型拟合的Q2值表示模型的预测能力,如图3a所示,所建模型对4种蜂蜜的判别解释能力达93.2%(R2Y=0.932),对未知样本的预测能力为87.6%(Q2=0.876)。考虑内部验证方法与建立模型的多种因素相关,常常会提高最终模型的预测能力使模型出现过拟合趋势,因此采用排列试验(Permutation test)对模型进行外部交叉验证(n=200)[10,18],如图3b所示,回归线斜率大,与纵轴的截距小,R2=0.234 不超过0.3~0.4,Q2=-0.31 表明模型未过拟合且稳健,提示模型数据可靠,具有很好的稳定性和预测性,可以进一步做OPLS-DA 分析寻找差异变量。
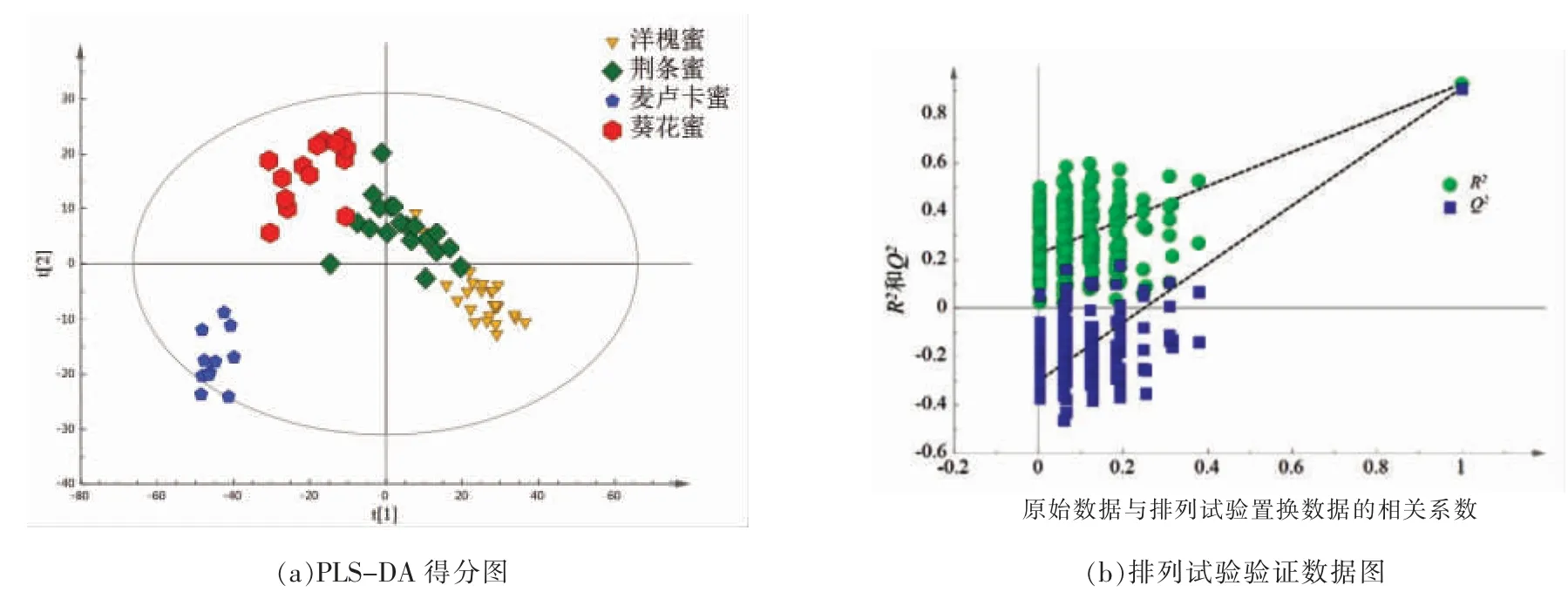
图3 模型验证Fig.3 Validate model plots
2.2.4 OPLS-DA 分析 为了有效识别不同蜂蜜组间的差异代谢物核磁信号,对不同来源的单花蜜进行了两两OPLS-DA 分析,得分图如图4a,4c,4e,4g 和4i所示,所建模型对区分洋槐蜜和荆条蜜、洋槐蜜和葵花蜜、洋槐蜜和麦卢卡蜜、葵花蜜和麦卢卡蜜,荆条蜜和麦卢卡蜜的判别解释能力分别为 0.978,0.985,0.984,0.993 和 0.982,预测能力分别为0.935,0.971,0.983,0.943 和0.967。经过OPLS-DA 分析的数据可进一步通过相关关系图(Coefficient Plot)表示,以NMR 谱的化学位移(变量)为横轴,纵轴代表与模型有关所有变量的相关系数值,相关系数较高的代谢物呈现热色系,相关系数较低的代谢物表现冷色系[10],如图4b,4d,4f,4h 和4j所示,选择相关系数大于0.8 的强变量对应的核磁分段位移,荆条蜜和洋槐蜜对比显著的差异代谢物信号为δ=7.32~7.34,7.37~7.38,6.85,7.23 等芳香氢质子或苯丙酸类化合物的烯氢信号(荆条蜜);洋槐蜜和葵花蜜对比显著的差异代谢物信号在δ=1.7~3.0 的脂肪氢信号区(洋槐蜜)及δ=4.54,5.21,8.27~8.31 的信号区(葵花蜜);麦卢卡蜜对比其它3 种蜂蜜的特征信号在δ=0.5~3.0,3.90~4.10,4.31~4.35,4.95,6.83~6.85,7.16~7.25,7.25~7.31,9.35~9.38 多个区域,这些变量可作为潜在的标记物,需进一步富集蜂蜜制备并结合二维核磁共振波谱分析开展结构鉴定研究。
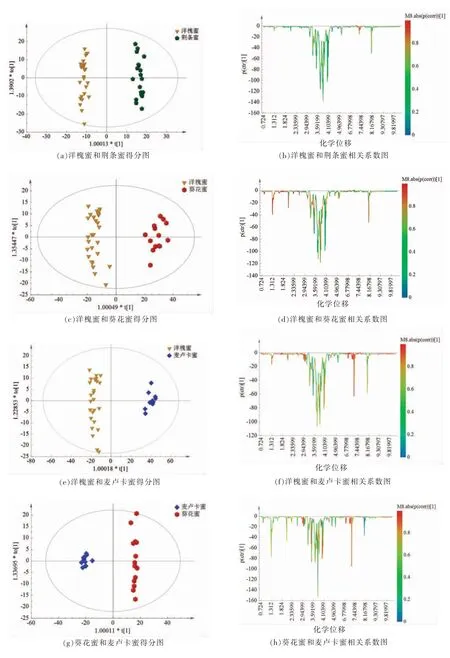

图4 两两组间OPLS-DA 分析得分图及相关系数图Fig.4 OPLS-DA score plots and correlation coefficient diagrams between each two groups
3 结论
本文基于植物代谢组学,采用核磁共振技术结合化学计量学方法对不同来源单花蜜开展差异分析研究。通过对比不同文献方法优化了蜂蜜核磁分析的前处理方法,避免蜂蜜中大量的糖掩盖其它低含量特征性强的化合物的信号,更好地涵盖到脂肪区(δ=0.5~3.0)、糖类化合物区(δ=3.0~6.0)和芳香区(δ=6.0~10.0)不同区域的信号;采用log 转换和帕莱托换算方式预处理核磁数据并深度挖掘,利用PCA 模型可以很好地区分洋槐蜜、荆条蜜、葵花蜜和麦卢卡蜜,并对模型进行了内外部验证;构建了两两组间OPLS-DA 模型的载荷图和相关系数分析用于洋槐蜜和荆条蜜、洋槐蜜和葵花蜜、洋槐蜜和麦卢卡蜜、葵花蜜和麦卢卡蜜、荆条蜜和麦卢卡蜜的组间代谢标志物的识别,并找到了相应的核磁分段位移作为特征性变量。该方法简单、快速,具有分析时间短、完整性强、专属性好、准确性高等优点,可以扩展到多种不同蜜源单花蜜的区分识别,为不同单花蜜的质量评价建立有效方法和预测模式,为单花蜜的品质分析与规范蜂产品市场提供技术支持。
