黏蛋白功能特性及在食品营养评价中的应用
2021-09-09雒明朔杨立娜王子义蔡文琪何余堂
雒明朔,杨立娜,王子义,蔡文琪,刘 贺,马 涛,何余堂
(渤海大学食品科学与工程学院 辽宁锦州 121013)
肠道是人体重要的消化器官,其表面覆盖一层黏液,通过黏液的持续分泌与更新,将上皮细胞与肠道内的细菌、病毒等有害物质有效隔离和清除,从而对肠道黏膜起到润滑和保护的作用[1-2]。肠黏膜是机体抵御外界病原侵袭和维持肠道稳态的重要屏障,主要有机械屏障、化学屏障、生物屏障和免疫屏障[3]。其中机械屏障由肠黏膜上皮细胞间紧密连接的蛋白构成;化学屏障由肠黏膜上皮细胞分泌的黏液,胃肠道分泌的消化液和肠道共生菌产生的抑菌物质共同构成;生物屏障由肠道共生菌群及宿主肠道微环境相互作用构成;免疫屏障由肠道淋巴系统及其分泌的免疫活性物质构成[4-5]。随着人们生活水平的提高,食品营养越来越得到重视。人体的生长发育需要消化、吸收营养物质。因个体的差异而对于营养物质的种类和需求量各不相同。营养物质摄入不足会导致多种机体疾病的发生,营养物质摄入过量会导致无效营养物质积累,对人体造成危害[6]。肠黏液和黏蛋白为肠道的重要成分,对研究营养物质的运输具有重要意义。
黏液是以黏蛋白为主体构成的水凝胶体系[7],存在于多种器官和组织的黏膜表面。黏蛋白为黏液的主要成分,是研究黏液的性质和作用中不可忽视的重要因素。本文主要介绍黏蛋白在肠道屏障中的作用以及在食品营养评价中的意义。
1 黏蛋白简介
1.1 来源
黏蛋白是一类分子质量在40 万u 以上的糖蛋白,广泛分布于机体多种器官和组织的黏膜表面,如消化道、呼吸道、生殖道、角结膜等[8]。唾液黏蛋白覆盖在口腔黏膜表面,由人的颌下腺、舌下腺和小唾液腺的黏液腺泡细胞分泌[9]。眼表的黏蛋白主要由结膜杯状细胞以及角膜和结膜上皮细胞分泌[10]。肠道中的黏液主要由肠道中的杯状细胞产生的黏蛋白网络组成,杯状细胞消耗谷氨酰胺和大量其它氨基酸形成并释放黏蛋白[11]。黏蛋白由黏蛋白基因转录翻译而来,在杯状细胞内质网和高尔基体进行聚合、修饰、糖基化和折叠,再分泌到细胞外,与水及肠腔内一些物质混合形成黏液凝胶。黏蛋白合成后被包裹成颗粒,运输到杯状细胞表面,释放入肠腔。释放包括基础分泌和调控分泌,基础分泌是通过细胞骨架运动实现的小剂量持续分泌;调控分泌是受到多种生物活性物质刺激的杯状细胞通过胞吐作用释放大量黏蛋白,包括神经肽、细菌、细菌产物和毒素、细胞因子等。肠道中某些炎症会影响杯状细胞长期大量分泌黏蛋白,导致杯状细胞功能耗竭,黏蛋白合成减少,黏液层变薄[12-15]。
1.2 结构
黏蛋白种类多样,不同区域的黏蛋白结构也各不相同,作为一种有串联重复结构存在的高分子质量糖蛋白,其中脯氨酸、苏氨酸和丝氨酸的比例很高。如图1所示,细胞表面黏蛋白通常由2 个不同亚基的二聚体组成,通过非共价的十二烷基硫酸钠(Sodium dodecyl sul-fate,SDS)不稳定键连接在一起,较大的亚基完全暴露于胞外,高度糖基化[15]。黏蛋白域是糖基化的序列,通常在编码黏蛋白的序列中被发现。这些序列也被称为PTS 区域,表示多肽中富含含有脯氨酸(Proline)、苏氨酸(Threonine)或者丝氨酸(Serine)的区域。在肠道中最主要的黏蛋白是MUC2,在所有已知的人类PTS区域中,只有MUC2 不含丝氨酸。MUC2 包含2 个不同的PTS 结构域,经糖基化作用后变得僵硬,伸出杆状体,形成黏蛋白结构域。MUC2 具有血管性血友病因子(Von-Willebrand-factor,VWF)区域,分为VWF-C 和VWF-D 2 个末端结构域。MUC2的N 端区和C 端区分别由半胱氨酸残基之间的二硫键稳定连接,这些半胱氨酸残基的数量超过氨基酸总量的10%。此外,在MUC2 序列中存在胶原蛋白和肝素结合位点,可能与其它细胞外大分子相互作用[16-18]。
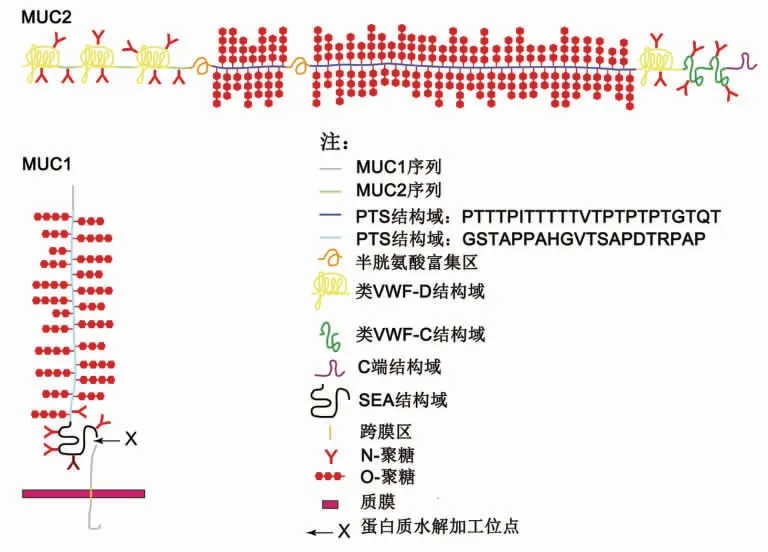
图1 MUC1 和MUC2 的分子结构[18]Fig.1 Molecular structure of MUC1 and MUC2[18]
1.3 分类
至今发现有22 种黏蛋白,分别以MUC 后不同数字命名。根据多糖链的类型,黏蛋白可分为中性型和酸性亚型,也可分为硫酸盐类和非硫酸盐类。按功能特性分,黏白分为2 类:跨膜型和凝胶形成型(表1)。跨膜黏蛋白依靠跨膜区域与细胞膜结合,在羧基端附近有一个跨膜结构域,可参与细胞内信号传递,主要包括:MUC1、MUC3A、MUC3B、MUC4、MUC12、MUC13、MUC14、MUC15、MUC16、MUC17、MUC20、MUC21 和MUC22;凝胶形成型黏蛋白由杯状细胞分泌,构成黏液层的骨架,凝胶形成型黏蛋白包含半胱氨酸富含区域,包括MUC2、MUC5AC、MUC5B、MUC6、MUC7、MUC8、MUC9 和MUC19[15,19-20]。
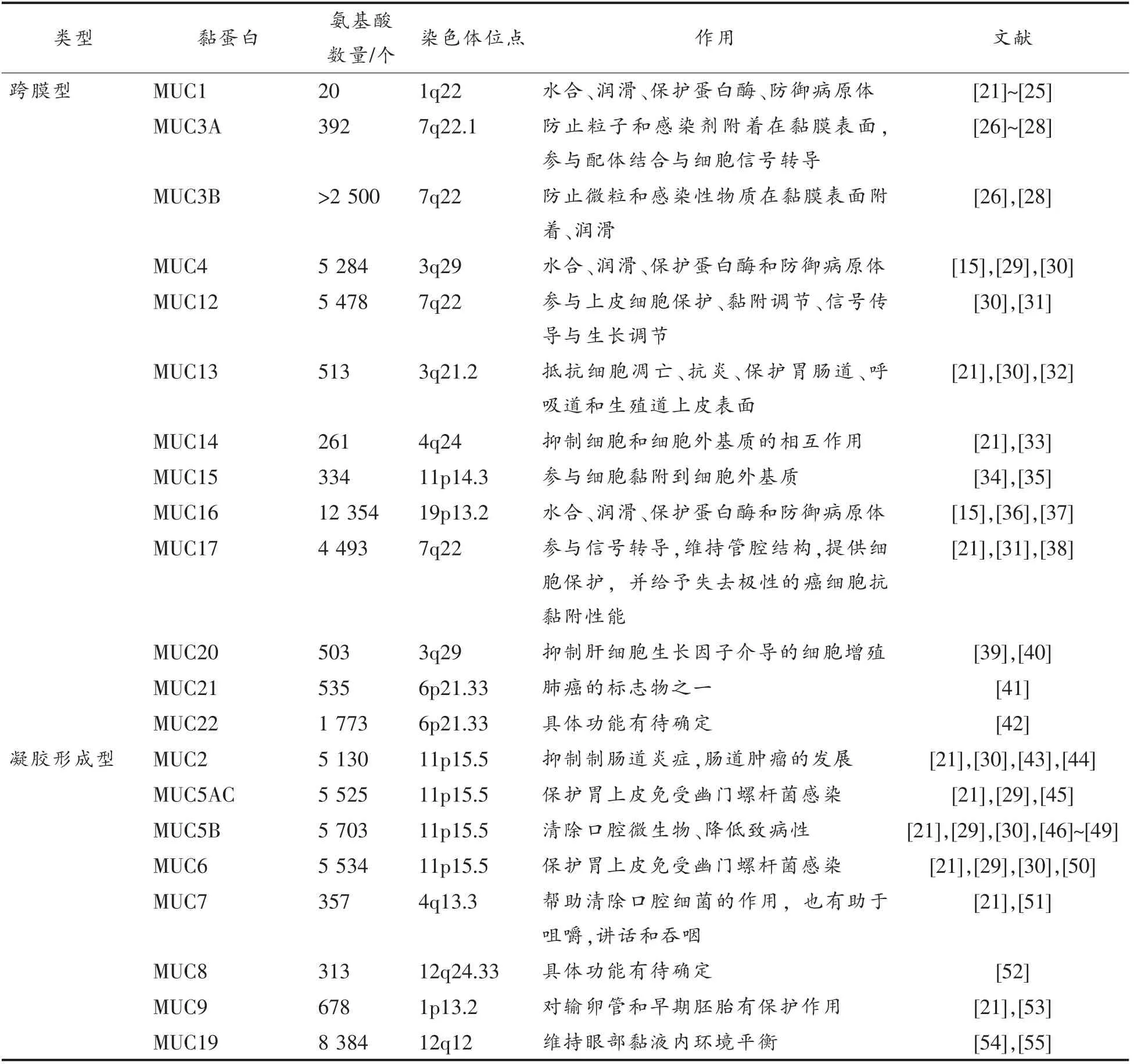
表1 黏蛋白分类与功能性Table 1 Classification and function of mucin
2 黏蛋白的生物学活性
2.1 黏蛋白与流变性
黏液蛋白纤维通过二硫键连接形成寡聚体,使得黏液具有特殊的黏弹性网络结构。在低剪切作用下,它表现为弹性固体;在高剪切作用下,它表现为黏性液体[56-57]。Parlato 等[58]研究pH 值对体外黏液流变特性的影响并与纯化的黏蛋白进行对比,研究表明胃黏液的黏弹性特性对pH 值的变化是相当稳定的,而纯化的黏蛋白溶液对pH 值比较敏感。同时,当对黏蛋白溶液碱化至溶解(pH>8.5),然后再酸化至初始pH 值时,猪胃黏液的流变特性是可逆的。Bhattacharjee 等[59]利用不同直径的二氧化硅纳米颗粒探究猪空肠黏液的渗透能力,发现由于黏液素和二氧化硅纳米颗粒之间存在电荷依赖性,两者相互作用改变了黏液的黏弹性。Wilcox 等[60]研究聚乳酸-羟基乙酸纳米颗粒渗透对小肠黏液体积流变特性的影响,结果表明添加聚乳酸-羟基乙酸纳米颗粒对小肠黏液的体积流变学影响很小。肠黏液中成分的改变都会引起肠黏液流变特性的变化,黏蛋白的含量是决定肠黏液流变性的主要因素,黏蛋白纤维间的非共价键和二硫键可以提升黏液的黏弹性。黏液流变特性的改变可能会极大地影响其作为润滑剂、选择性屏障和机体抵抗感染第一道防线的功能[56]。对于肠道黏膜表面疾病的治疗,通常是增加局部药物浓度,减少全身副作用,从而提高疗效,然而这个过程会被肠黏液屏障阻碍。探究肠黏液的流变性对于药物跨过黏液屏障直达病患处,提高疗效具有重要意义。
2.2 黏蛋白与黏附性
细菌与上皮细胞或者黏液通过生物化学作用产生特异性的黏连称为黏附,根据细菌作用的底物差异,可将黏附分为细胞黏附和黏液黏附[61]。肠道中的细菌黏附会导致肠道疾病,肠黏液细菌所黏附的受体多为黏蛋白。Jin 等[62]证明了培养的大肠杆菌18C23 或其上清液可抑制大肠杆菌K88ac或K88MB 对仔猪小肠黏液的黏附。马玉龙等[63]发现肉鸡肠黏液糖蛋白有一定的黏附作用,黏附能力存在差异。邹芳[64]发现致病性大肠杆菌与肉鸡各肠段黏液蛋白有不同黏附率,乳酸菌与结肠的黏附率高于其它肠段,且乳酸菌的黏附性显著优于大肠杆菌。黄剑飞等[65]利用纳豆芽孢杆菌对牙鲆进行肠黏液的黏附试验,纳豆芽孢杆菌的表面蛋白具有肠内黏附的能力。陈营等[61]利用黏液黏附模型证明乳杆菌对肠黏液的黏附不但具有菌种的特异性,而且也有宿主的特异性。
2.3 肠黏蛋白与肠道屏障完整性
上皮细胞和黏液层形成的一个物理屏障将大部分细菌隔离在上皮细胞之外,在这个屏障中黏蛋白发挥着重要作用。Birchenough 等[16]研究发现细菌能引起羧甲酸肽水解酶β 的释放从而裂解黏蛋白,导致黏液脱落,破坏肠道屏障。Linden 等[66]认为黏液蛋白不应被视为静态屏障,而应被视为黏膜屏障的动态响应元件,与先天免疫和适应性免疫的其它要素相互作用并作出反应。Heazlewood 等[67]发现黏蛋白的错误折叠和内质网应激会在小鼠中引发结肠炎,同时黏液屏障的减少和内质网应激都会引发局部黏膜炎症。Van Der Sluis等[68]利用小鼠实验证明黏蛋白可以发挥屏障作用保护肠上皮细胞,黏蛋白的缺失会引发肠道炎症。黏蛋白对于保护肠道屏障的完整,减少细菌的入侵有重要作用,是维持肠道屏障的重要组成部分。
3 肠黏蛋白在食品营养中的应用
3.1 营养物质运输与吸收
黏蛋白构成肠道的润滑剂促进食糜沿着胃肠道运输。Li 等[69]利用微流控系统测试了同一肽内正电荷和负电荷结合的效果,结果表明肽的运输因黏蛋白的存在增强,而阳离子和阴离子的运输都被黏蛋白减慢。尽管黏蛋白阻碍了均匀带电底物的运输,但它可能促进了带不同电荷底物的运输。Atuma 等[70]认为肠上皮细胞参与营养吸收,而杯状细胞则参与黏液的持续形成和释放。在肠道中,杯状细胞释放黏蛋白后,通过邻近肠上皮细胞的微绒毛移动黏蛋白,从而保证未搅拌的水层的连续性。未搅拌水层的深度在很大程度上取决于从微绒毛顶端延伸出来的膜相关黏蛋白的长度。在肠道中黏蛋白高度糖基化,保证其不被消化系统降解,但可以被肠道中的微生物降解。MUC2 聚糖作为肠道共生细菌的主要营养源,同时可为更新肠道黏液提供能量[71]。
在胃肠道中,阴离子肽比阳离子肽更容易在胃黏膜中扩散,然而净电荷为零的肽并不受黏膜的限制更容易扩散,这表明在与黏蛋白的相互作用中,蛋白或颗粒表面的电荷分布起着重要的作用[69]。黏蛋白纤维倾向于与疏水、阳离子或氢键的基团形成低至中等亲和度的相互作用[72]。黏液中黏蛋白带负电荷,与进入黏液层的带正电的物质发生相互作用。已有研究表明,带正电的纳米颗粒比带负电的纳米颗粒具有更高的黏附性,导致运输过程中在黏液层中滞留时间延长。此外,黏液层中有活性巯基,可与其它巯基自发反应形成二硫键,同样会延长粒子在黏液层中的时间。经过PEG修饰的纳米粒子由于亲水、近中性的表面特性,能够有效穿透黏液到达黏膜组织[73]。说明在物质的传递运输过程中静电相互作用和二硫键起到了主要作用,进入肠道中的物质也可能会因为疏水性而难以进入黏液层。在研究过程中仅考虑黏蛋白的作用显然是不够全面的,还要考虑其它成分与组织和黏蛋白间是否存在协同作用,对于研究物质在肠道中的输送具有重要意义。
3.2 益生菌黏附与增殖
益生菌可以改善人体肠道菌群、提升身体健康状况。肠道是益生菌定植的主要场所,益生菌在肠黏膜上定植,与宿主发生相互作用,抵抗病原体调节免疫功能。一些乳杆菌可以促进黏液层表面的黏附[74]。益生菌可通过调节黏液蛋白的表达来修饰黏液层。这种调节已被证明通过细菌直接接触黏膜表面或通过细菌产物发生[75]。Kebouchi 等[76]发现益生菌能增加黏液产生,其成分也可以保持黏液层的完整性。益生菌在寄主组织中具有特异性的黏膜细胞黏附受体,包括黏液结合蛋白、磷脂壁酸或胞外多糖,还受到静电和疏水相互作用等非特异性黏附机制的影响[77-78]。Plaza-Diaz 等[79]研究也证明黏蛋白基因的表达可以被益生菌调节。益生菌除了黏附作用外,在治疗腹泻等其它肠道疾病方面也有很好的效果。
益生菌在肠道中的黏附性离不开静电、疏水和氢键的相互作用。益生菌在肠道中可以抑制病原微生物的生长繁殖。根据作用介质的不同,细菌黏附可分为特异性黏附和非特异性黏附。各类细菌的黏附过程基本相似,先是通过趋化作用使细菌和易感宿主细胞表面接近及定位,继之细菌黏附素与易感宿主细胞表面处于静电荷及疏水性结合进行非特异性黏附,然后黏附素进一步与相应的特异性受体结合进行特异性黏附[80]。益生菌与细胞黏附后,会释放细胞因子和趋化因子作为相关蛋白,刺激宿主的系统免疫等[81]。在肠道中乳酸菌的黏附过程包括多种作用力,如:被动力、静电相互作用、疏水性、空间力等[82]。益生菌维持肠道的免疫平衡,对人体肠道健康有重要作用。检测人不同益生菌的黏附能力,针对于不同个体,选择合适的益生菌极为重要。非活菌益生菌在肠道中也有良好的治疗作用,在肠道中的作用机制也是研究中不可忽视的问题。
4 展望
黏蛋白种类多样,在人体中分布广泛,在维持肠道屏障的完整和肠道环境的稳态中起到重要作用。由于黏蛋白分子质量大,结构复杂,在人体中还会发生结构上的改变,给深入探究黏蛋白带来困难,许多黏蛋白的功能还是未知的。在肿瘤或者癌细胞中均发现黏蛋白的表达,然而对于黏蛋白的表达过程缺少深入的探究,明确黏蛋白在疾病发生过程中的作用,可以把黏蛋白作为药物输送的靶点为治疗提供新的解决方法。黏蛋白在人体发生疾病时,结构和活性改变的机制并不明确。此外,纳米颗粒在黏液层中与黏液发生黏附,可以延长药物的作用时间,然而很难穿透黏液层进入上皮组织,这是后期的研究中需要克服的重要问题。黏蛋白成为生理、病理研究中不可忽视的因素,在肠道给药和纳米粒子的运输中也是值得研究的课题。在营养物质进行运输吸收的过程中,黏蛋白与物质吸附方式、界面活性等互作机制也是未来食品营养学的一个热点研究方向。针对黏蛋白肠道中屏障作用的机制,可以研发在肠道中滞留时间较长的食物,在肠道中缓慢释放能量以提升饱腹感,有利于降脂减肥的新型食品。对于肠道易患病人群,可以尝试研发富含益生菌的食物,促进黏蛋白对益生菌的黏附和增殖,提高肠道中的益生菌丰度,提升肠道免疫力,预防肠道疾病的发生。从长远角度看,研究黏蛋白在肠道中的作用机制是极为重要的,研究者们可以根据相应的作用机制有针对性的开发运载体、新型食品,提高治疗和保健的功效,取得新的进展。
