液相微萃取技术在食品分析中的应用
2021-09-09李贺贺段佳文孙宝国
李贺贺,何 菲,段佳文,孙宝国,*
(1 中国农业大学食品科学与营养工程学院 北京食品营养与人类健康北京高精尖创新中心 北京 100083 2 北京工商大学 中国轻工业酿酒分子工程重点实验室 北京 100048)
液相微萃取是一种用于制备样品的新型方法,它以少量液体作为萃取剂来分离目标化合物,克服了传统方法的弊端,诸如液液萃取法需要消耗大量有机溶剂,固相微萃取的萃取头昂贵、寿命短、可选用的固定相类型少且存在交叉污染等问题。它操作简便快速、有机溶剂消耗少、成本低且具有较高的富集因子,与色谱技术联用可以方便、快速地分析目标化合物。作为一种新型、绿色环保的样品前处理技术,液相微萃取经历了分析化学的第3 次革命,从一个简单的工具逐渐发展成为一个强大而独立的样品前处理技术,日益受到人们的关注,并广泛地应用于化学领域,特别是食品分析及环境分析等领域。近几年来,随着科学技术的进步,液相微萃取的形式也越来越多样化[1-2]。液相微萃取的分类情况如图1所示,根据萃取时所涉及的相数,液相微萃取可分为两相微萃取和三相微萃取;根据萃取的模式不同,液相微萃取可分为单液滴微萃取、中空纤维膜液相微萃取和分散液液微萃取。本文就液相微萃取的原理及其3 种模式在食品分析中的应用和其优缺点进行介绍总结。

图1 液相微萃取分类图Fig.1 Classification of LPME
1 液相微萃取的原理
1.1 平衡萃取理论
液相微萃取是基于相平衡原理的一项技术,在萃取过程中目标物的浓度变化会引起目标物在给出相和接受相间迁移,最终达到萃取平衡[3]。
1.1.1 两相微萃取体系 目标物在两相之间的分配过程可用下式表示:

待测物A 在两相间的分配系数K 定义为萃取达到平衡时目标物在接受相中的浓度ca,eq(mol/L)和在给出相中的浓度cd,eq(mol/L)的比值,计算公式如下:

当达到萃取平衡时,目标物在接受相中的浓度计算公式如下[4]:

式中,cd,初始——目标物在给出相中的起始浓度(mol/L);Va——接受相体积(m3);Vd——给出相的体积(m3)。
从式(3)可以看出,分配系数K 越大,越有利于萃取的进行。
1.1.2 三相液相微萃取体系 在三相液相微萃取体系中,目标分析物A 先从待测样品溶液(给出相)中萃取(或挥发)至中间相,然后被萃取溶剂(接受相)萃取,其传质过程表示如下:

目标物在中间相和给出相之间的分配系数Kid及目标物在接受相和中间相之间的分配系数Kai的计算公式如下:

式中,cd,eq——目标物在给出相中的平衡浓度(mol/L);ci,eq——目标物在中间相中的平衡浓度(mol/L);ca,eq——目标物在接受相中的平衡浓度(mol/L)。
目标物在给出相和接受相之间的总分配系数可表示为:

在三相液相微萃取体系中,萃取效率由Kid和Kai共同决定,二者共同影响着萃取过程。
当达到萃取平衡时,目标分析物的平衡萃取量ca,eq的计算公式如下:

式中,Vi——中间相的体积(m3)。
由上述公式可得出,当达到萃取平衡时,接受相中的目标分析物的量与给出相中分析物的起始浓度cd,初始呈线性关系。由于接受相的体积远小于给出相的体积,所以在达到萃取平衡时,能够将样品有效富集[5]。
1.2 动力学理论
萃取是指目标分析物在不同相间的溶解度不同而产生分离的现象。当达到萃取平衡时,萃取终止,目标分析物从给出相转移到接受相中的过程,也就实现了热力学动态平衡。在萃取结束后,目标分析物在两相中的量之和与在萃取前给出相中的量相等,可用下式表示[3-4,6-7]:
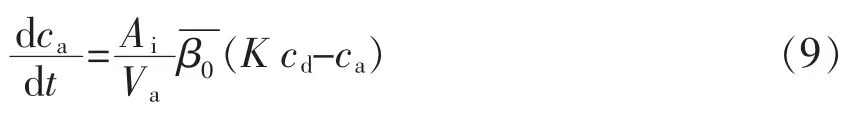
式中,ca——萃取时间为t 时接受相中分析物的浓度(mol/L);cd——萃取时间为t 时给出相中分析物的浓度(mol/L);Ai——萃取时间为t 时接受相和给出相的接触面积(cm2);——萃取时间为t 时目标分析物的总传质系数;K——萃取时间为t 时两相间的分配系数。
由于给出相的体积很大,在萃取过程中,物质的浓度变化不大,即目标物在接触面时的瞬时浓度与在给出相本体中的浓度近似相等,假如给出相的体积Vd和接受相体积Va不变,由质量守恒定律可得:

将上式(10)带入式(9),并对其积分,得到ca与t 的关系式:

式中,k(s-1)表示表观传质速率常数,计算公式如下:

从以上式子可以得出,影响萃取过程中传质速率常数的因素有两相间的接触面积、两相间的总传质系数、给出相和接受相的体积及目标分析物在两相间的分配系数。要获得较小的t 值,可采用动态萃取不断更新萃取剂,降低给出相和接受相接触面的扩散层厚度,进而增加两相间的接触面积,提高萃取效率。两相间的传质系数可以通过加热和使用较少量的样品溶液体积及萃取剂体积来增大[8]。
2 液相微萃取模式及其在食品分析中的应用
2.1 单液滴微萃取
1996年,Jeannot 等[4]提出了单液滴微萃取技术。该技术通常是利用微量进样针吸取一定体积萃取剂,插入待测试样溶液中(两相系统)或置于顶空(三相系统)中后缓慢推出萃取剂,使其悬挂于进样针针尖的顶端,萃取一定时间后,将液滴吸回至进样针,插入色谱等仪器进行分析。根据萃取剂和样品的移动情况分为静态微萃取和动态微萃取,静态微萃取即萃取剂不发生运动,将萃取剂固定于微量进样器针头上,萃取一定时间后,抽回进样器中,对收集到的样品进样分析,操作简单;动态微萃取即通过反复抽推注射器活塞,将溶剂微滴变成溶剂薄膜,附着于注射器内壁,然后利用进样器对待测样品进行回拉和推进,使样品和有机溶剂发生相对运动,从而将目标物萃取至有机溶剂薄膜中,反复数次,收集有机相进行色谱分析。动态微萃取的目的不是从样品中提取出所有分析物的量,而是在达到平衡时,它能够使用相对少的萃取剂得到较高浓度的分析物。
2012年,Moradi 等[9]开发了一种新型的使用固化的浮动囊泡凝聚液滴微萃取的方法结合高效液相色谱-紫外检测器 (High performance liquid chromatography with ultraviolet detection,HPLCUV)测定了对羟基苯甲酸酯。该方法采用癸酸囊泡组成的超分子溶剂作为浮滴微萃取固化的溶剂,利用疏水和阳离子相互作用以及氢键的形成,提取对羟基苯甲酸甲酯、对羟基苯甲酸乙酯和对羟基苯甲酸丙酯,得到了良好的结果。
2014年,Ke 等[10]利用全自动静态顶空单液滴微萃取技术结合气相色谱-质谱联用 (Gas chromatography-mass spectrometry,GC-MS)快速分析了食用油中6 号溶剂【在我国,食用油提取溶剂被称为6 号溶剂油,它是一种轻链烷烃(C6)的混合物,从抽余油中分离出来,己烷是6 号溶剂的主要成分】的残留,得到了较好的结果。2016年,Zaruba等[11]开发了一种用光学探针作为微滴保持器的新型顶空单液滴微萃取法,在提取过程中通过在线监测分析信号(吸光度)来测定食品中的亚硫酸盐,得到了良好的结果,且该方法已成功应用于葡萄酒、果酱和果汁等真实食物样品的亚硫酸盐分析中。2017年,Trujillo-Rodríguez 等[12]首次以磁性离子液体(Magnetic ionic liquid,MIL)作为萃取溶剂,利用真空顶空单滴微萃取方法测定短链游离脂肪酸(Free fatty acid,FFA),萃取过程中用棒状磁体帮助维持磁性离子液体微滴。提取后,将含有FFA 的MIL 微滴转移到顶空小瓶中,进行静态顶空解吸,随后进行GC-MS 分析。结果显示,在最佳试验条件下,重现性好,相对回收率高。2019年,Abreu 等[13]用顶空单液滴微萃取法对鱼片中麻醉剂2-苯氧基乙醇的残留进行了测定,在优化的试验方法下,呈现出良好的精确度。
2019年,Mohammad 等[14]利用单液滴微萃取结合气相色谱-电子捕获检测法测定了面包、薯片和饼干3 种食品样品中的丙烯酰胺,用水萃取丙烯酰胺,并在过二硫酸铵存在下用氢溴酸进行衍生化,之后用悬挂在微量注射器针尖上的1.0 μL正辛醇液滴提取3.0 mL 的衍生化分析物,萃取完成后注入气相色谱仪中进行检测,获得了满意的结果。2018年,Li 等[15]首次使用柱清洗和连续流动单滴微萃取 (Continuous flow single drop microextraction,CF-SDME)开发了一种测定环境水样中16 种多环芳烃的新方法,该方法一步完成了纯化、提取和富集,降低了大多数有机干扰物对目标分析物测定的影响,大大简化了操作过程,缩短了整个预处理时间,并且克服了传统单液滴微萃取悬浮提取时间长、不稳定等缺点,获得了良好的结果。
单液滴微萃取方法操作简单、成本低,只需要微量的有机试剂和普通的实验室注射器即可,绿色环保、节省时间,可以轻松实现自动化,而且单液滴微萃取还可以与多种仪器设备联用,使分析更加快速便捷。单液滴微萃取不仅适用于液体、固体等不同形态样品的分析,并且还适用于大量样品的分析。然而,该方法也存在着一些缺陷,比如液滴容易掉落,有机试剂在水中部分溶解,有限的提取液滴体积使得所提取的物质有限等。单液滴微萃取目前多用于样品中的某一类物质的提取,在物质的全分析方面应用还不够。因此,单液滴微萃取未来的发展应集中于研究新型的萃取材料及设备,改善液滴的稳定性,进一步提高自动化水平。探究与多种萃取及分析方法相结合,逐渐开发并应用于物质的全分析方面。
2.2 中空纤维膜液相微萃取
中空纤维膜-液相微萃取 (Hollow-fiber-liquid-phase microextractio,HF-LPME)是由Pedersen-Bjergaard 等[16]于1999年提出的一种新型的样品前处理技术。该技术利用中空纤维膜作为有机试剂的固定介质对样品进行萃取。中空纤维膜(Hollow fiber,HF)是一种外形像纤维、有一定大小孔径的半透性膜形成的空心细管,它能够截留分子质量较大的杂质,具有一定分子筛作用和选择透过性,可以使液体或气体混合物中的某些组分从外向内腔或从内腔向外透过HF 膜壁[17]。目前使用较多的中空纤维膜一般是聚丙烯、聚四氟乙烯和聚偏二氟乙烯[18]。
2009年,刘志梅等[19]利用中空纤维液相微萃取结合HPLC 对牛奶中替米考星、麦迪霉素和交沙霉素3 种大环内酯类抗生素的残留进行了测定,获得了良好的结果,此方法适于高效快速地检测牛奶中的抗生素。2015年,Yamini 等[20]研究了一种两相中空纤维液相微萃取结合气相色谱-火焰离子化检测器用于快速、简便、灵敏地测定蜂蜜和水样中的双甲脒的方法。结果显示,在最佳萃取条件下,对水基质和对于蜂蜜基质的检测均取得了较好的结果。2017年,Banforuzi 等[21]首次开发了一种新型的基于反胶束的两相中空纤维液相微萃取方法,用于测定人血浆和蔬菜样品中的槲皮素。试验利用阳离子乙基三甲基溴化铵表面活性剂CTAB 的反胶束作为受体相,利用表面活性剂头基与分析物分子之间的静电相互作用进行萃取,得到了良好的结果。
2015年,曹博等[22]建立了一种三相中空纤维液相微萃取结合HPLC 测定果汁和含乳饮料中的山梨酸钾的方法,该试验以磷酸三丁酯为萃取剂,在最优条件下,山梨酸的线性方程为Y=1.5592+1254.6X,R2为0.9999。2017年,木尼热·阿布都艾尼等[23]利用三相中空纤维液相微萃取结合薄层色谱分离同步荧光法测定了酱油中的色胺含量。
2016年,Wang 等[24]开发了一种新型的离子液体中空纤维液相微萃取结合HPLC 技术检测了茶饮料中的邻苯二甲酸酯,试验将离子液体1-丁基-3-甲基-六氟磷酸六氟磷酸盐置于多孔壁聚丙烯中空纤维中作为受体相,并使用壬醇作为完成萃取的负载液膜相,得到了满意的结果。同年,Simão 等[25]利用中空纤维支撑液膜和分散液液微萃取相结合的新型萃取方法,并通过高效液相色谱-荧光检测器对大豆汁中的黄曲霉毒素进行了测定,取得了较好的效果,通过优化步骤,选择了较理想的提取条件,并成功地确定了最佳分析参数。该方法的线性范围为0.03~21 μg/L,R2为0.9940~0.9995,检出限(Limit of detection,LOD)和定量限(Limit of quantification,LOQ)分别为0.01~0.03 μg/L 和0.03~0.1 μg/L。
2017年,Goh 等[26]开发了一种成束中空纤维阵列-液相微萃取结合声波辅助和HPLC 测定了水基质中的雌酮,17-雌二醇,雌三醇和17-乙炔雌二醇等雌激素。试验将成束中空纤维浸入正辛醇中,使其壁孔充满正辛醇,随后将其置于样品溶液中进行萃取,无需在管内注入液体。结果显示,在最佳萃取条件下,目标化合物的富集因子为77~137 倍,LOD 和LOQ 分别为0.251~0.440 ng/L和0.995~1.82 ng/L,RSD<9%。在该研究中还引入了拉曼光谱以确定聚丙烯本身对萃取结果无影响,只有溶剂才用于萃取。2018年,Goh 等[27]又利用自动束中空纤维阵列-液相微萃取结合超高效液相色谱-串联质谱(Ultra high performance liquid chromatography tandem mass spectrometry,UHPLC-MS-MS)法对水介质中的全氟化合物进行了检测,获得了良好的结果。
利用中空纤维膜材料的特性结合液液微萃取(Liquid-liquid microextraction,LLME)有机试剂消耗少、操作简便、快速、富集倍数高等优点,中空纤维膜-液液微萃取 (Hollow-fiber-liquid-liquid microextractio,HF-LLME)广泛应用于生物、环境和食品等领域。HF-LLME 不仅克服了单液滴微萃取液滴不稳定存在的问题,而且还能用于污浊、复杂的样品基质中,由于该纤维为单次使用,还克服了溶剂残留问题,集净化、萃取、浓缩于一体。此外,HF-LLME 受体相溶液的种类和形式也在不断丰富,如离子液体中空纤维液相微萃取、反胶束中空纤维液相微萃取等。但是,由于中空纤维膜存在一定的选择透过性,因此HF-LLME 多用于样品中的某些物质的提取,不适用于样品中物质的全分析,并且HF-LLME 多用于液体基质的样品。因此,开发新型材料的膜载体如电膜萃取等,成为HF-LLME 发展的一个方向。此外,由于被动扩散的提取机制,该方法的提取速度较慢。因此,在常规的HF-LPME 之上,引入了新技术以克服其缺点。
2.3 分散液液微萃取
分散液液微萃取(Dispersive liqud-liqud microextraction,DLLME)是由Rezaee 等[28]于2006年提出的一种新型的微萃取技术,是利用注射器将萃取溶剂和分散剂的混合溶液快速注入样品溶液中,形成有机萃取剂-分散剂-水三者的浑浊溶液,使溶剂颗粒完全分散在水相中,离心后提取溶剂颗粒的一种方法。其中分散剂的添加,可以提高水相中有机萃取剂的分散性,从而增加水相与萃取剂之间的接触面积,进而实现目标化合物在样品溶液和萃取剂之间快速转移[29]。
2016年,付博等[30]建立了基于脂肪酸的漂浮液滴固化分散液液微萃取法,并结合HPLC 对酒类样品中的4-乙基苯酚和4-乙基愈创木酚进行了检测,获得了良好的结果,此方法萃取时间短仅需4 min,萃取结果好。2018年,张嘉莹等[31]利用泡腾辅助-悬浮固化-分散液液微萃取技术结合液相色谱检测了食醋中的农药残留量,试验利用食醋的酸性特点与NaHCO3反应,生成CO2气体,从而使萃取剂和样品溶液充分接触,无需额外添加分散剂或借助其它分散设备,操作简单,效果良好。
2017年,孙啸涛等[32]利用涡旋辅助液液微萃取结合GC-MS 对67 种白酒中四甲基吡嗪、4-甲基愈创木酚和4-乙基愈创木酚进行了检测,得到了较好的结果。2019年,Faraji 等[33]开发了一种基于涡旋辅助的低共熔溶剂分散液液微萃取方法,用于快速、高效地检测食品中5 种常见的合成红色染料(苋菜红、胭脂红4R、红黄红、吖嗪红和赤藓红),该方法以百里酚作为氢键供体,苄基三乙基氯化铵作为氢键受体,用于制备新型疏水性低共熔溶剂。应用此方法分析饮料、果冻、巧克力糖衣样品中的食用色素,均获得了令人满意的结果。
2018年,倪伟等[34]利用分散液液微萃取结合GC-MS 对葡萄酒中的主要高级醇进行了测定,在最优的萃取条件下,该方法的线性良好,检测限低,重复性好。2019年,Wu 等[35]利用分散液液微萃取法结合HPLC-UV 快速、廉价地测定了醋中的川芎嗪。同年,Galucha 等[36]利用分散液液微萃取结合UHPLC-MS-MS 测定了酿造咖啡中的丙烯酰胺,通过标准加入法进行定量,获得了满意的结果。Hamid 等[37]建立了一种新型阳离子表面活性剂辅助可转换溶剂型分散液液微萃取方法,结合紫外-可见分光光度计提取并检测了食品样品中Orange II 染料。试验通过添加NaOH 将极性质子化的三乙基碳酸铵可逆地转化为三乙胺,获得了良好的线性效果。Fernández 等[38]利用涡旋辅助反相分散液液微萃取结合丝网印刷碳电极对橄榄油中亲水性酚类化合物进行了检测,试验研究了橄榄苦苷、羟基酪醇、咖啡酸、阿魏酸和酪醇的氧化,选择咖啡酸和酪醇进行定量。结果显示,在优化的萃取条件下,咖啡酸在0.075~2.5 mg/L 之间有良好的线性关系,R2=0.998,酪酸在0.075~3 mg/L 之间具有良好的线性关系,R2=0.999,2 种物质的LOD 为0.022 mg/L,不同质量橄榄油样品的相对回收率为83%~108%。同年,郭亚芸等[39]利用超声辅助-分散液液微萃取结合GC-MS 检测了葡萄酒中三唑类农药残留量,该方法对戊菌唑、氟硅唑、烯唑醇和苯醚甲环唑具有很好的检测效果。2018年,廖且根等[40]建立了超声辅助悬浮固化分散液液微萃取结合HPLC-MS-MS 方法,对环境水样中的氯硝柳胺进行了检测,经验证,该方法同样适用于池塘水和湖水中氯硝柳胺的测定。
2019年,Cao 等[41]开发了一种基于原位衍生化结合磁性离子液体-分散液液微萃取方法(Magnetic ionic liquid dispersive liquid-liquid microextraction,MIL-DLLME)用于快速检测食品中的生物胺。将该方法应用于葡萄酒和鱼类的检测,回收率分别为93.2%~103.1%和94.5%~102.3%,重现性良好。2019年,Fiorentini 等[42]采用磁性离子液体分散液液微萃取-电热原子吸收光谱法测定了蜂蜜样品中痕量的砷,在酸性条件下,通过与二乙基二硫代磷酸铵的螯合预浓缩三价砷,然后用三己基(十四烷基)鏻四氯铁酸盐(III)磁性离子液体和乙腈作为分散剂,用磁铁进行分离,并注入ETAAS 石墨炉中进行测定。结果显示,在最佳试验条件下,提取效率为99%。
2019年,韩艺烨等[43]利用酸辅助分散液液微萃取结合HPLC-MS-MS 对果汁中8 种真菌毒素进行了测定,该方法灵敏度高,重现性好,适用于多种水果中真菌毒素的测定。此外,2017年,胡光源等[44]建立了多级液液微萃取结合GC-MS 测定了白酒中的角鲨烯,该方法能够准确灵敏地测定白酒中痕量的角鲨烯。
DLLME 是一种快速、高效的提取方法,它不仅保持了单液滴微萃取溶剂用量少的优点,还克服了其液滴容易掉落、萃取时间长等缺点,不仅加快了萃取速度,还提高了萃取效率和富集倍数,并且方法操作简单、成本低、绿色环保,已被广泛应用于环境、食品、生物等各个领域。然而,分散液液微萃取常用的萃取剂一般都是有毒且易挥发的卤代烃,近年来逐渐探索利用低密度萃取剂、离子液体、反相萃取溶剂等代替卤代烃,并探索将表面活性剂用作分散剂应用于分散液液微萃取中。此外,分散液液微萃取还可以借助其它辅助工具来减少有机试剂的使用,如超声辅助分散液液微萃取、涡旋辅助液液微萃取、超临界流体分散液液微萃取、酸辅助液液微萃取等[38-39]。目前DLLME 的局限性在于从样品溶液到萃取阶段的两步萃取机制对样品的洁净度有一定的要求,不利于复杂样品的直接分析。因此,开发与其它萃取方法相结合的新方法以克服其缺点。
3 结论与展望
液相微萃取作为一种小型化的样品前处理技术,集萃取、浓缩于一体,适用于食品等样品中分析物的预浓缩。近几年来,液相微萃取在萃取溶剂方面取得了较大进步,开发了利用离子液体、磁性离子液体、低共熔溶剂和超分子溶剂代替传统有机试剂,遵循了绿色环保理念。然而,该技术仍存在一定缺陷,比如,所提取的物质较少,目前大部分的研究主要是针对样品中几个或一小类化合物,而在样品的全分析上应用不够,并且缺乏自动化。因此,液相微萃取未来的发展方向应集中于与其它前处理方法结合,取长补短,提高萃取效率、扩大提取范围,不断开发并应用于多种领域;提高常规分析中的自动化程度,开发与各种仪器联用的自动化装置以及能够快速有效提取的微芯片装置;结合辅助方法如超声辅助、涡旋辅助及电位辅助等用于不同的萃取工艺,以提高效率、改善过程控制或节省时间。此外,还应考虑食品学科与其它领域的相互作用,如生物化学、医学等,通过化学计量学方法,结合智能大数据,建立科学数据库,实现企事业单位快速检测分级工作。
