KCNK1调节CREB3表达抑制肺癌细胞的增殖和转移
2021-09-09闫红江高伟年高少林朱海勇石彦涛张合林
闫红江 高伟年 高少林 朱海勇 石彦涛 张合林
全球范围内,肺癌是所有癌症中发病率和死亡率排名第一位的癌种[1],肺癌也是我国最常见的肿瘤[2]。近年来,通过大规模的基因组研究,对肺癌尤其是肺腺癌的分子机制的认识有了显著的进展[3];并且已经找到一些重要的治疗靶点,如,EGFR和ALK,开发出的靶向药物的临床应用显著改善了肺癌患者的生存率和预后[4,5]。但是,靶向药的应用也面临着挑战:临床使用含靶向药的治疗方案后,患者经常出现不良反应、耐药性或是其他的并发症[6-8]。在肺癌的不同阶段,基因会发生上调或下调的不同改变,了解肺癌发生和进展的分子机制对于肺癌的诊治具有重要的意义,有助于寻找开发新的诊断和治疗的靶点,提高治疗效果,改善患者的预后。K2P K+通道是一类结构独特的离子通道家族,参与多种生理功能的调节,如细胞体积、细胞凋亡、血管舒张、神经元兴奋和疼痛感知;该类家族成员是多种心血管和神经疾病的治疗靶点及挥发性麻醉药的主要作用靶点[9-11]。钾双孔域通道亚家族K成员1(KCNK1)(K2P1/TWIK-1)是该家族第一个被鉴定的成员,在心脏和大脑的重要生理过程中发挥作用[12-15]。目前KCNK1在肿瘤中的功能和机制还不清楚。本研究探讨KCNK1在肺癌中的功能及其作用机制。
1 材料与方法
1.1 实验材料 H1975和H1299细胞购自中科院上海细胞库;细胞培养基Roswell Park Memorial Institute-1640(RPMI-1640)和2.5%胰酶购自hyclone;胎牛血清购自Gibco;细胞培养用1%青霉素-链霉素抗体购自Gibco;Trizol购自英韦创津;细胞凋亡试剂盒购自Sigma-aldrich,RNA反转录试剂盒和实时荧光定量逆转录聚合酶链反应(quantitative reverse transcription-polymerase chain reaction,qRT-PCR)试剂盒购自Takara;蛋白质裂解液购自北京碧云天生物科技有限公司。细胞增殖与毒性检测试剂盒(Cell Counting Kit,CCK-8)购自翌圣生物科技(上海)有限公司;Transwell小室试剂盒购自康宁公司;重组Anti-CREB3抗体(ab180119)和Anti-GAPDH抗体(ab8245)均购自艾博抗生物科技有限公司。辣根过氧化物过氧化酶(horseradish peroxidase,HRP)标记的二抗购自中杉金桥生物科技有限公司。
1.2 实验方法
1.2.1 细胞培养:H1975和H1129细胞培养于添加10% 胎牛血清和1%青霉素/链霉素的RPMI-1640培养基中,于含5%二氧化碳,37℃细胞培养箱中进行培养。细胞每隔3 d进行换液。
1.2.2 KCNK1基因细胞敲减:设计合成特异性KCNK1基因的siRNA靶序列并进行验证,siKCNK1干扰序列和对照siRNA分别转染A549和NCI-H1299细胞,取20 nmol/L siRNA加入200 μl 转染用培养液中,于室温下静置15 min。之后取4 μl RNAiMAX溶液逐滴加入之前配好的转染用培养液中,室温下静置15 min。最后将两者轻轻混匀,于室温下静置15 min。将上述混合液轻轻加入带感染的细胞中,于含5%二氧化碳,37℃细胞培养箱中进行培养48 h。弃去样本,收集细胞,并提取细胞总mRNA,进一步进行逆转录成cDNA。通过qPCR实验检测KCNK1表达验证siRNA的敲减效率。KCNK1基因敲减靶基因序列如下:5’-CCTTGTCAGATGGAGGTAA-3’; 对照siRNA序列为:5’-CACACCGTTTCGTGGCTTT-3’。SiRNA干扰序列购自湖州河马生物科技有限公司。
1.2.3 RNA提取与qPCR实验:使用TRIZOL裂解细胞,使用酚氯仿法提取1×106细胞的总RNA,溶于30 μl无RNase的ddH2O中。然后用逆转录试剂盒将RNA反转录成cDNA后,使用qPCR试剂盒进行qPCR实验。KCNK1上游引物:5’-CCTGGGGAAGGCTACAATCAA-3’;KCNK1下游:5’-CCAGAACTACCAACATGGCAA-3’。AP-1上游:5’-TCCAAGTGCCGAAAAAGGAAG;AP-1下游:5’-CGAGTTCTGAGCTTTCAAGGT-3’。MMP-9上游:5’-AGACCTGGGCAGATTCCAAAC-3’;MMP-9下游:5’-CGGCAAGTCTTCCGAGTAGT-3’。Cyclin D3上游:5’-TACCCGCCATCCATGATCG-3’;下游:5’-AGGCAGTCCACTTCAGTGC-3’。GAPDH引物设计如下:上游:5’-GACAGTCAGCCGCATCTTCT-3’;下游:5’-TTAAAAGCAGCCCTGGTGAC-3’。
1.2.4 TCGA数据库:KCNK1基因在肺腺癌中的表达水平通过TCGA数据库进行查询并下载数据进行分析,TCGA数据库分析的网址为http://cancergenome.nih.gov。
1.2.5 细胞增殖实验:将KCNK1干扰组和对照组的处于对数生长期的细胞的H1299和H1975细胞,按照每孔1 000个细胞接种于96孔板,每孔100 μl培养液,于含5%二氧化碳,37℃细胞培养箱中进行培养。第2天开始,相应的培养孔中加入10 μl CCK8试剂,于37°C下孵育3 h,采用450 nm单波长进行吸光度测定,OD值代表细胞增殖活力。连续检测4 d,计算细胞活率。
1.2.6 细胞克隆形成实验:将处于对数生长期的细胞均匀接种于6孔板,每孔1 000个细胞。每隔3 d进行换液,连续培养15 d待细胞形成克隆之后弃去培养基,PBS洗涤两次之后使用结晶紫染色3 h,晾干后拍照,统计。
1.2.7 Western blot检测:6孔板培养的细胞弃去培养基,PBS洗涤2次。加入200 μl RIPA后使用细胞刮将细胞刮下裂解提取蛋白。取50 μg蛋白变性处理后进行12%的SDS-PAGE凝胶电泳,电泳条件为恒压120 V。待溴酚蓝电泳至凝胶末端,电泳完毕。将蛋白转移至PVDF膜,电转条件恒流300 mA,3 h。PVDF膜在5%脱脂奶粉封闭,封闭条件为室温2 h。之后分别进行一抗和二抗抗体孵育,一抗(稀释比例为1∶1 000)于4℃孵育过夜,二抗(稀释比例为1∶5 000)于室温孵育2 h,最后进行显色分析。
1.2.8 Transwell:收集处于对数期的细胞,使用无血清培养基重选细胞。将细胞接种于Transwell小室内室,每小时接种40000细胞,培养基体积为750 μl。外室中添加500 μl含20%胎牛血清的培养基。培养48 h 后,使用结晶紫对细胞进行染色。

2 结果
2.1 KCNK1在肺癌组织中高表达 通过对TCGA数据库中肺癌数据下载数据并进行分析,发现KCNK1在肺腺癌组织中呈高表达,在肺癌肿瘤组织中的表达水平显著高于其对照癌旁或正常组织中的表达水平(P<0.05)。而在486例肺鳞癌的样本中分析发现,KCNK1的表达也显著升高(P<0.05)。见图1。
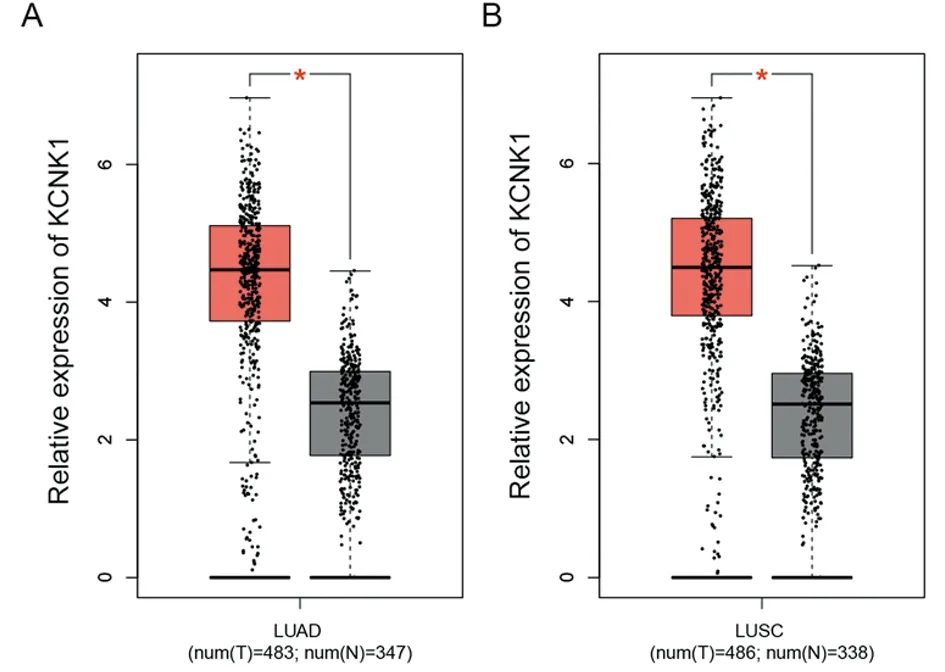
图1 TCGA数据库分析发现KCNK1在肺癌组织中高表达;A TCGA数据库分析KCNK1在肺腺癌及正常对照中的表达水平,*P<0.05;B TCGA数据库分析KCNK1在肺鳞癌及正常对照中的表达水平,*P<0.05
2.2 KCNK1促进肺腺癌的增殖能力 应用siRNA敲低KCNK1基因的表达,成功在肺腺癌细胞系H1975和H1299细胞系中将KCNK1基因沉默,和对照组相比,KCNK1在H1975和H1299细胞系中的敲减效率分别达到73.7%和77.0%。CCK8增殖实验检测发现,KCNK1基因沉默可以显著的抑制H1975和H1299细胞的增殖能力。克隆形成结果显示,干扰KCNK1可以显著的抑制肺癌细胞的克隆形成能力。说明KCNK1对肺癌细胞增殖能力是必不可少的。见表1~4,图2。
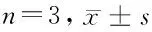
表1 H1975和H1299中KCNK1干扰效率比较
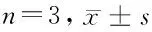
表2 CCK8检测敲减KCNK1对H1975增殖能力比较
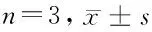
表3 CCK8检测敲减KCNK1对H1299增殖能力比较
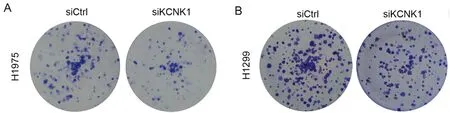
图2 细胞克隆形成实验显示KCNK1敲低后可抑制肺腺癌H1975和H1299细胞的克隆形成;A 克隆形成检测干扰KCNK1对H1975细胞克隆形成能力的影响;B 克隆形成检测干扰KCNK1对H1299细胞克隆形成能力的影响
表4 克隆形成检测敲减KCNK1对H1975和H1299克隆形成能力比较
2.3 干扰KCNK1抑制肺癌细胞的转移能力 Transwell结果显示干扰KCNK1可以显著的抑制H1975和H1299细胞的转移能力,提示KCNK1参与肺癌细胞的转移。见图3,表5。
表5 Trasnwell检测敲减KCNK1对H1975和H1299细胞的转移能力
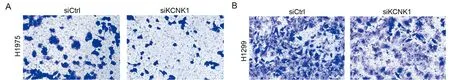
图3 干扰KCNK1抑制肺癌细胞H1975和H1299的转移;A Transwell结果显示干扰KCNK1对H1975细胞转移能力的影响(×40);B Transwell结果显示干扰KCNK1对H1299细胞转移能力的影响(×40)
2.4 KCNK1可以调控CREB3的水平 将KCNK1干扰后,通过Western blot实验检测KCNK1的下游通路基因表达水平,发现与对照组相比,KCNK1基因沉默组的CREB3蛋白水平显著降低(P<0.05);qPCR检测CREB3下游AP1、MMP9和cyclin D3表达,发现与对照组相比3个基因表达水平都明显下降(P<0.05);说明KCNK1基因表达沉默后可以抑制H1975细胞CREB3及其下游分子AP1、MMP9和cyclin D3的表达。见表6,图4。
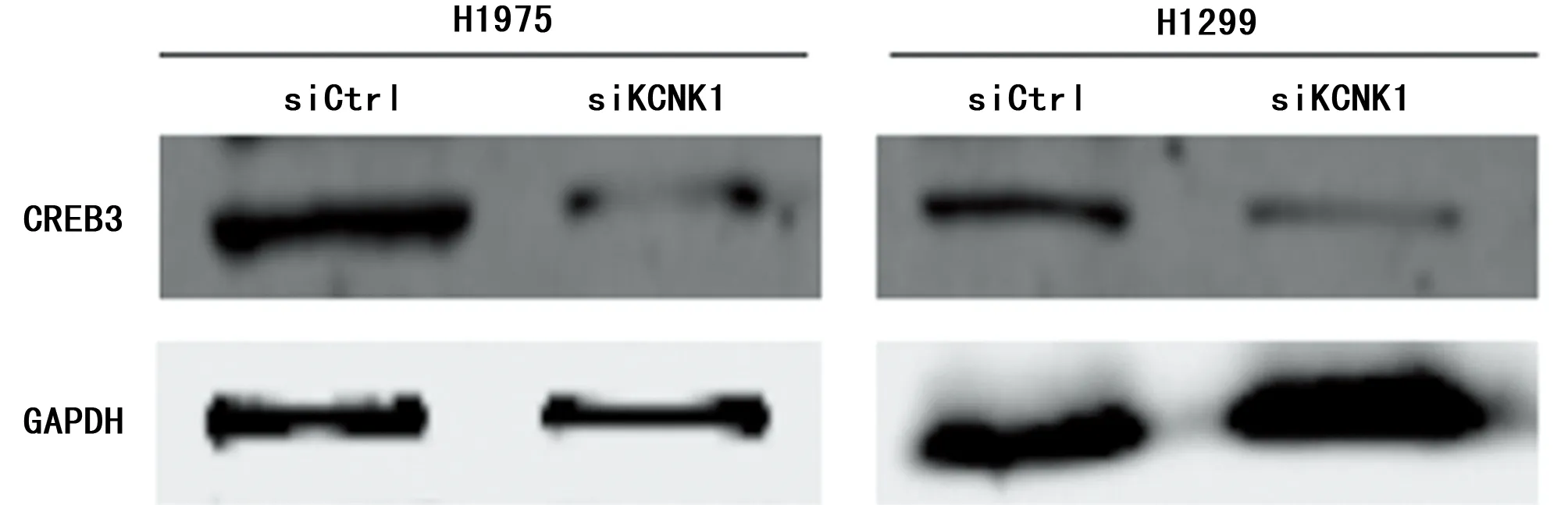
图4 干扰KCNK1抑制H1975和H1299细胞CREB3蛋白的表达
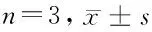
表6 qPCR检测干扰KCNK1对H1975细胞AP1、MMP-9和Cyclin D3的表达水平
3 讨论
离子通道在可兴奋细胞(如心肌细胞和神经元)的生理和病理状态下均发挥重要的功能[13,14]。随着研究的深入,发现离子通道在肿瘤的增殖,转移及耐药等过程中的作用也非常重要,离子通道在驱动恶性肿瘤细胞行为中的具有多种功能。钾离子通道是离子通道中最具多样性的一类,已有的研究发现多种钾离子通道相关基因参与肿瘤的形成和恶性进展:Kv1.1的高表达是多种亚型髓母细胞瘤致病因素[16];在乳腺癌、结肠癌和前列腺癌组织中检测到Kv1.3表达明显升高[17];Kv10.1(EAG1)被发现在多种肿瘤中高表达[18];K2P家族成员KCNK9在多种肿瘤表达升高,其单克隆抗体可以在细胞水平抑制增殖和侵袭转移[19]。因此,钾离子通道相关分子作为个体化癌症治疗的靶点具有巨大的潜力。
KCNK1是钾二孔域通道家族K成员,可以维持静息电位,调节动作电位平台的振幅和持续时间,改变膜电位和膜兴奋性。本研究首先在TCGA数据库中研究发现,KCNK1在肺腺癌和肺鳞癌的组织样本中高表达均显著上调,提示KCNK1可能作为肺癌的潜在的诊断分子标志物。在甲状腺癌样本中检测发现,KCNK1的mRNA水平在甲状腺癌的组织中表达上调,并且和肿瘤的分级呈正相关[20],提示KCNK1在甲状腺癌中可能发挥促进肿瘤恶性表型的作用。因此KCNK1可能作为广谱的肿瘤恶性分子标志物。此外,Jiang等[21]研究发现该家族的另外一个成员KCNK4在胰腺癌细胞中高表达,并且高表达KCNK4与胰腺癌的不良预后相关。
目前研究笔者尚未见KCNK1在肺癌中作用机制的报道。本研究进一步探讨干扰KCNK1对肺癌细胞的恶性表型的影响。结果显示,利用siRNA沉默KCNK1的表达后发现,肺癌NCI-H1975和NCI-H1299细胞的增殖能力和迁移能力受到显著抑制。细胞迁移能力在一定程度上反映了肿瘤的转移能力,因此KCNK1可能在对肺癌的转移能力起到关键作用。因此,以上结果说明KCNK1可以参与肺癌的发生和转移。但是Beitzinger等[22]研究发现TAp73可以直接结合并调控KCNK1的转录,对肿瘤的铆钉生长起到关键作用,并且在大样本组织中研究发现,KCNK1在胶质瘤,黑色素瘤等肿瘤中表达下调,提示KCNK1在不同肿瘤类型中的功能有一定的差异。因此在多种肿瘤中阐明KCNK1的作用机制对阐明KCNK1的生物学功能至关重要。
造成KCNK1在不同肿瘤中功能不意义的可能原因之一是其下游介导的信号通路或者下游分子在不同类型的肿瘤中不同。本研究进一步对其下游作用机制研究中发现:KCNK1干扰后CREB3蛋白水平显著降低。CREB3也称为LZIP 或 LUMAN,是CREB/ATF转录因子家族成员,已有报道CREB可以通过调控AP1在多种肿瘤中发挥作用[23,24]。我们通过qPCR检测发现KCNK1干扰后AP1、MMP9和cyclin D3的表达也明显降低。AP1又成c-Jun,是真核细胞内重要的转录因子,转录激活促进增殖相关的基因转录。而MMP9为基质金属蛋白酶家族成员,可以降解细胞外机制,从而促进细胞的运动和转移能力。同时,高表达的Ccylin D3可以推进细胞周期进展。由此可见,从分子层面证明KCNK1可能促进肺癌细胞的增殖能力,迁移能力,并促进细胞周期进程。因此,本研究的机制研究结果说明KCNK1可能通过CREB3在肺癌发生和恶性进展中发挥作用。
综上所述,KCNK1基因可能是肺癌的一个新的分子诊断指标及治疗靶点。KCNK1基因在肺癌的肿瘤形成与恶性进展中有着重要的功能,并且可能可能通过影响CREB3及其下游机制进行,进一步的研究有待进行。本研究只通过TCGA分析KCNK1的mRNA表达水平,但还需在肺癌组织中检测KCNK1蛋白表达与肺癌临床指标和患者预后的关联度。本研究发现KCNK1可以促进Cyclin D3的表达,但对细胞周期进程的促进换需要进一步通过流式细胞术等方法来进一步明确。重要的是,本研究只在细胞水平上进行了探讨,进一步换需要在动物体内水平探讨KCNK1对肺癌细胞的增殖和转移能力。并且分子层面上KCNK1基因如何调控CREB3等问题需要继续深入研究。
