程序性死亡蛋白1及其配体在结直肠癌中的临床研究现状
2021-09-09刘文综述乔文波审校
刘文 综述 乔文波 审校
结直肠癌是全球第三大常见恶性肿瘤,每年全球约有120万名患者间接死于结直肠癌,严重威胁着人们的身体健康[1]。由于现有的手术及放化疗治疗效果有限,因此免疫治疗应运而生,研究显示PD-1/PD-L1抑制剂与放化疗和手术联合治疗在结直肠癌中取得了可观的疗效。程序性死亡蛋白-1(Programmed cell death protein-1,PD-1)及其配体程序性死亡蛋白配体-1(Programmed cell death protein ligand-1,PD-L1)是肿瘤微环境中重要的免疫抑制分子,PD-L1表达于结直肠癌细胞表面,当它与PD-1结合后,通过降低T细胞对肿瘤细胞的细胞毒性从而使结直肠癌细胞逃避了人体的抗肿瘤免疫反应。随着对肿瘤免疫逃逸机理的深入研究,科研人员发现PD-L1作为肿瘤治疗的新靶点在结直肠癌治疗领域具有巨大潜力,同时PD-L1的表达还能为临床工作者评价结直肠癌患者的疾病预后提供重要证据。故本文着重概述PD-1/PD-L1在结直肠癌中的表达、治疗及其作为判断结直肠癌患者预后的分子标志物的研究现状。
1 PD-1/PD-L1概述
PD-1也称为分化簇279(CD279),是一种可以通过抑制T细胞活性来调节免疫系统的表面蛋白,普遍在活化的T细胞、B细胞、自然杀伤细胞、巨噬细胞和树突状细胞上表达[2]。PD-L1也称B7-H1或CD274,在抗原呈递细胞(Antigen presenting cell,APC)、淋巴样、内皮和上皮细胞上表达[3]。活化的T细胞分泌的干扰素-γ(Interferon-γ,IFN-γ)和肿瘤坏死因子还可诱导肿瘤细胞和APC表达PD-L1[4]。当PD-L1与PD-1相互作用时,会引起PD-1结构域中酪氨酸残基磷酸化,通过抑制PI3K/AKT或RAS/MEK/ERK信号通路的激活,进而抑制T细胞增殖[5]。程序性死亡蛋白配体-2(也称作PD-L2,B7-DC)是PD-1的另一个配体,在肿瘤细胞、APC、肿瘤相关的成纤维细胞和巨噬细胞上表达[6]。PD-1/PD-L1信号通路通过抑制T细胞功能使肿瘤细胞从宿主的抗肿瘤免疫监视中逃脱,这种免疫逃逸能够帮助肿瘤细胞存活,间接促进肿瘤的转移[7]。PD-L1在大多数恶性肿瘤细胞中表达水平升高,因此这种机制可能有利于减少T细胞对肿瘤细胞的细胞毒性并逃避抗肿瘤免疫反应[4]。近年来,随着对PD-1/PD-L1信号通路的深入研究,科研人员发现PD-L1在结直肠癌中的异常表达与结直肠癌的发生发展及预后关系密切,这也预示着阻断PD-1/PD-L1信号通路将成为肿瘤免疫治疗的新方向。
2 PD-1/PD-L1在结直肠癌中表达的相关因素
鉴于靶向阻断PD-L1通路在实体肿瘤治疗中的应用前景,近年来多个研究团队对PD-L1在结直肠癌中的临床应用进行了深入探究。Pyo等[8]在265例结直肠癌患者中检测PD-L1蛋白表达后发现免疫细胞中的PD-L1表达与较少淋巴结转移或远处转移以及较低的TNM分期密切相关,且肿瘤细胞中PD-L1表达与肿瘤位置密切相关。另外,国外有研究发现错配修复缺陷(Deficient mismatch repair,dMMR)型结直肠癌的PD-L1表达水平比错配修复正常型结直肠癌低,且PD-L1表达的患者预后明显较差[9]。Eriksen等[2]采用免疫组织化学方法检测572例结肠癌中PD-L1的表达水平,并对其与患者的各项临床病理学指标的关系进行分析,结果显示PD-L1与女性患者、肿瘤恶性程度级别高、右侧定位和微卫星不稳定性(Microsatellite instability,MSI)有关。
3 PD-L1与结直肠癌放化疗和预后的关系
3.1 放化疗对PD-L1表达水平的影响
目前的证据表明,放射治疗在免疫调节过程中发挥了重要作用,放射治疗可以促进肿瘤细胞表面PD-L1的表达增加,进而增强肿瘤细胞的放疗耐受性[3]。Chiang等[10]研究认为放射线和化学治疗药物可能会触发结直肠癌细胞产生IFN-γ,通过JAK2/STAT1信号通路诱导PD-L1的表达,这一研究成果间接证明了新辅助放化疗不仅可与免疫检查点抑制剂治疗联合应用,而且有助于恢复机体固有的抗肿瘤免疫能力。国内有研究对68例新辅助放疗的直肠癌患者肿瘤组织标本分析,发现放疗可促进PD-L1表达,且与短程放疗关系更加密切,表明放疗方案可能参与肿瘤细胞中PD-L1的表达[11]。Huang等[12]证明术前应用地西他滨方案化疗可以降低结直肠癌患者的DNA甲基化程度,直接促进肿瘤细胞中PD-L1的表达,而且还促进了体内免疫相关基因的表达和肿瘤中T细胞的浸润。Dosset等[13]报道称在小鼠结直肠癌模型中,5-氟尿嘧啶+奥沙利铂(Folfox)联合抗PD-L1治疗可以使小鼠达到临床完全缓解,同时研究人员还发现在动物模型中Folfox方案治疗结直肠癌能够显著促进CD8 T细胞和肿瘤细胞PD-L1的表达。因此,研究人员认为免疫检查点阻断疗法与Folfox等化疗方案的联合使用能够使结直肠癌患者获得更好的治疗效果。既往研究表明,放化疗后可引起直肠癌细胞中PD-L1表达水平升高,提示抗PD-L1治疗联合放化疗可改善晚期直肠癌的预后[14]。一项针对112例直肠癌患者的肿瘤组织免疫组化结果表明新辅助放化疗后直肠癌组织中PD-L1的表达水平显著升高,且肿瘤中PD-L1的表达与患者的无病生存期(Disease-free survival,DFS)和总生存期(Overall survival,OS)的改善相关[15]。术前放疗和化疗均可促进结直肠癌细胞PD-L1的表达,并且PD-L1表达水平可能与放疗方式和化疗方案有关,但此类研究在结直肠癌中相对较少。另外,Pembrolizumab联合铂类化疗已被批准用于既往未经治疗的转移性非小细胞肺癌(Non-small cell lung cancer,NSCLC)。在复发或转移性NSCLC研究中发现,PD-L1的肿瘤细胞阳性比例分数(Tumor proportion score,TPS)>1%的患者,应用Pembrolizumab联合化疗患者的中位OS均高于接受Pembrolizumab联合ipilmumab的患者,免疫治疗联合化疗可能有更大的临床获益[16]。Yuan等[17]报道称在晚期肺鳞癌中,与单用Nivolumab的患者相比,Nivolumab联合放疗的患者远处转移病灶明显缩小。肿瘤的免疫治疗与化疗、放疗相结合,可能提高免疫反应,改善患者预后,但其安全性及有效性有待进一步验证。
3.2 PD-L1与结直肠癌预后的关系
PD-L1蛋白的表达及其与疾病预后的相关性已在诸如肺癌、卵巢癌、食道癌和胃癌等多种恶性肿瘤性疾病中得到验证,其中肿瘤细胞PD-L1的高表达与预后不良相关[18-20],但PD-L1在结直肠癌预后中的作用存在争议(表1)。
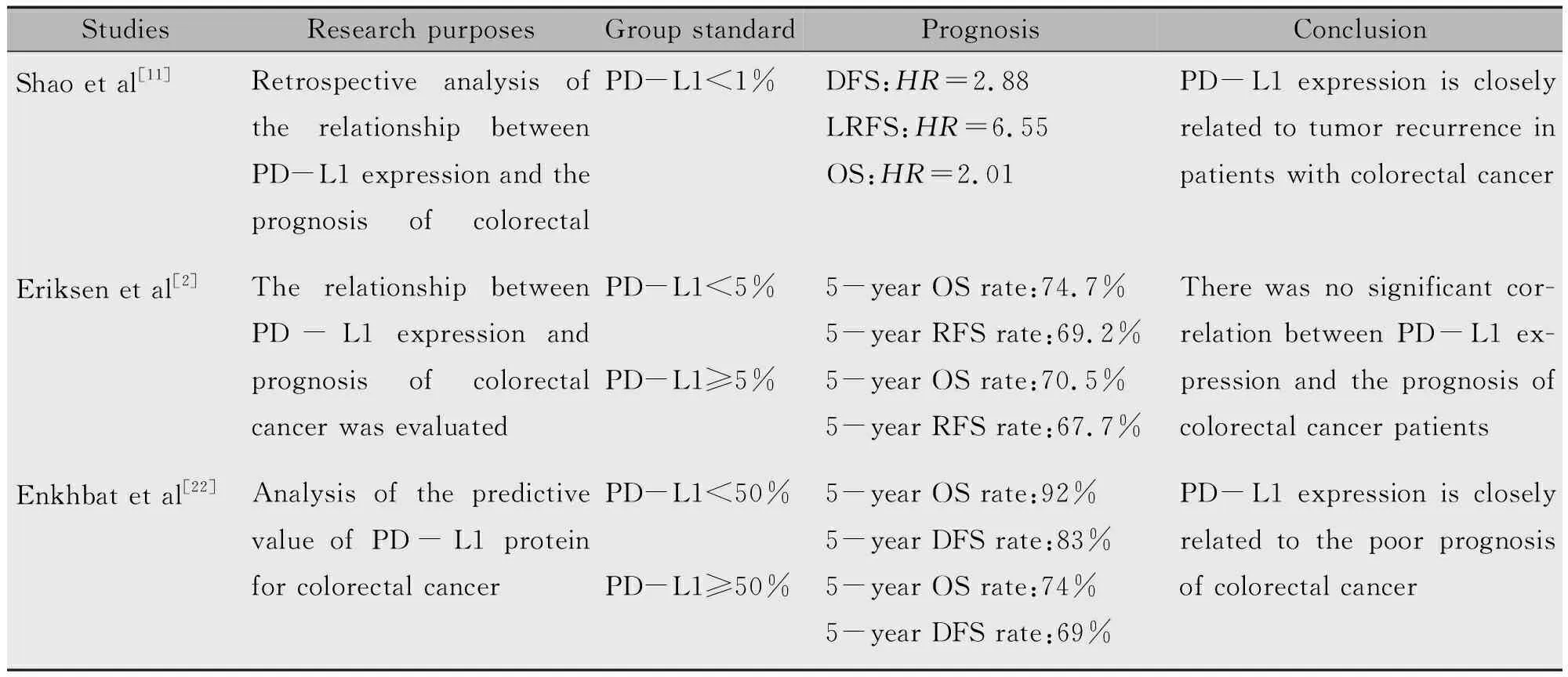
表1 PD-L1在结直肠癌中作为疗效标志物的临床研究
有研究显示PD-L1表达与结直肠癌的不良预后密切相关。国外有研究入组了183例结直肠癌患者,采用免疫组化染色分析了PD-L1蛋白对结直肠癌的预测价值,结果显示PD-L1 TPS>5%与结直肠癌患者预后不良相关,并证明JAK2/STAT1信号通路的异常激活是造成结直肠癌患者PD-L1表达的主要原因[21]。一组来自116例日本结直肠癌患者的研究数据同样支持PD-L1是影响患者OS的独立危险因素,但与患者DFS无明显相关性[22]。Shao等[11]的研究获得类似的结果,该研究对68例直肠癌患者的肿瘤组织进行免疫组化分析,并规定TPS>1%定义为PD-L1阳性,结果显示肿瘤细胞中PD-L1阳性患者更容易发生肿瘤复发,PD-L1表达可以预测新辅助放疗后直肠癌患者的局部无复发生存期(Local recurrence-free survival,LRFS)。另有研究表明PD-L1表达是影响右半结肠癌预后的独立因素,在应用PD-L1抑制剂时应考虑肿瘤的位置[23]。
然而,也有研究发现PD-L1对于结直肠癌的预后具有积极的影响。有学者评估了来自199例结直肠癌患者的肿瘤组织,发现新辅助放化疗与结直肠癌患者PD-L1表达增加有关,证明了PD-L1在肿瘤和免疫细胞上的低表达可以作为直肠癌患者预后不良的重要指标[24]。同样,Pyo等[8]分析了PD-L1在265例结直肠癌肿瘤组织中的表达,发现TPS<10%的患者生存率较差。
还有一些研究却发现PD-L1表达与结直肠癌患者的预后无相关性。国外一项包含572例结肠癌患者的研究结果发现PD-L1的表达对无复发生存期(Relapse-free survival,RFS)和OS的影响无统计学意义,不能作为判断结肠癌患者预后的生物标志物[2]。Masugi等[25]的研究数据也显示PD-L1的表达量对结直肠癌患者的预后无明显相关性。
PD-1/PD-L1对于判断结直肠癌患者的预后有着重要的作用,但其临床价值仍存在争议。推测在不同的结直肠癌患者间或者不同结直肠癌亚型的肿瘤内仍存在较大的异质性,导致存在假阴性结果的可能,PD-L1的表达目前还不足以作为常规临床使用的生物标志物,其对预后的预测还需进一步的研究和临床验证。
4 PD-1/PD-L1抑制剂的临床应用
众所周知,肿瘤细胞表达的PD-L1与T细胞表面的PD-1受体结合后,会抑制T细胞介导的抗肿瘤免疫反应,这一过程称为“免疫逃逸”[30],而人为阻断该途径则可以更好地改善一些恶性肿瘤的预后。最近几年,针对PD-1/PD-L1的免疫检查点阻断疗法已经应用于肿瘤治疗领域,并在各种恶性肿瘤的治疗中均取得了良好的效果,将肿瘤免疫疗法推向了新的高度,例如PD-1的单克隆抗体Nivolumab、Pembrolizumab和抗PD-L1单克隆抗体Avelumab、Atezolizumab被认为是潜在的抗肿瘤药物[31]。目前,使用抗PD-1/PD-L1药物如Nivolumab作为新的免疫治疗靶点在几种恶性肿瘤的临床前和临床研究正在进行中(表2)。
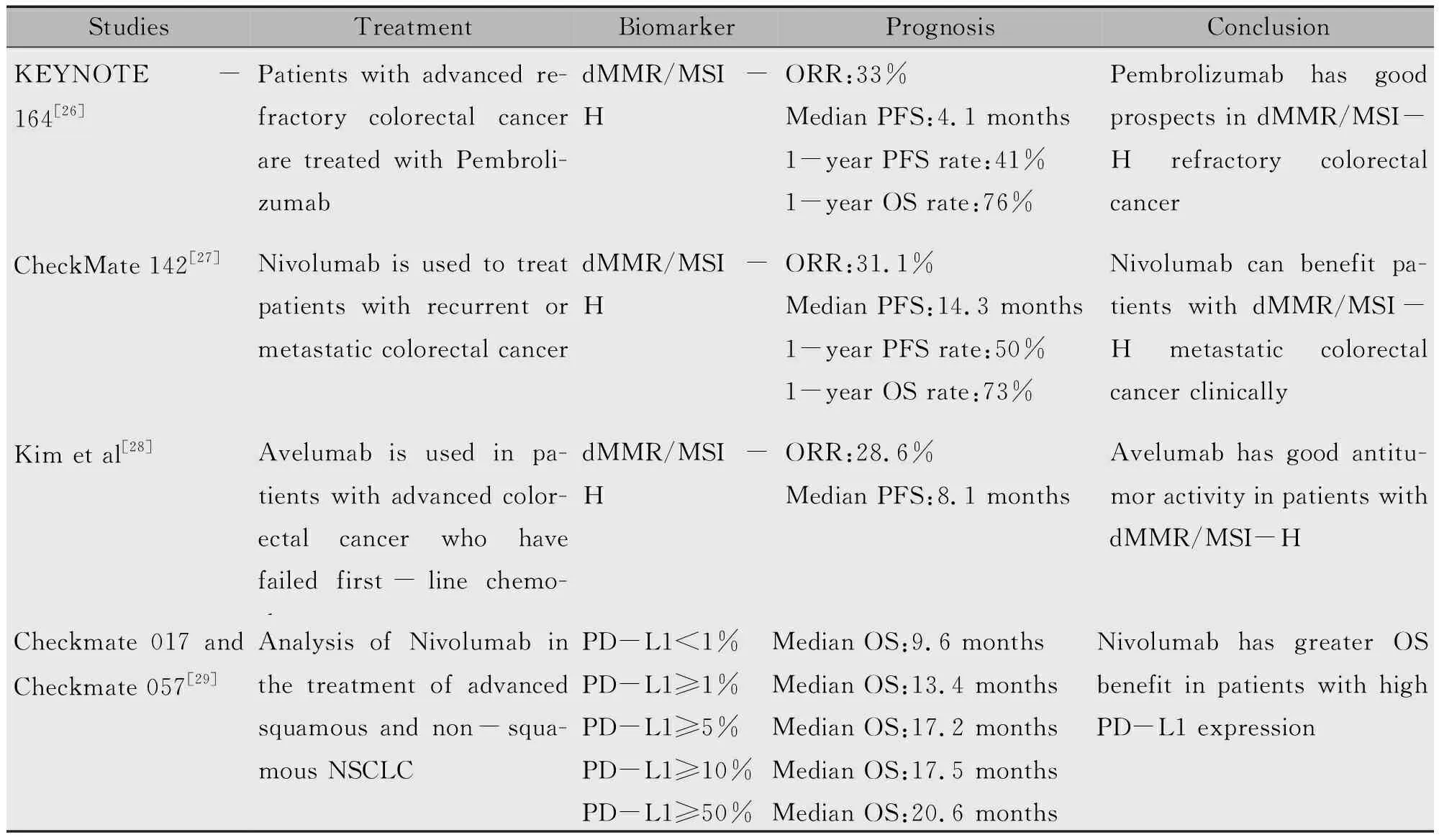
表2 免疫治疗生物标志物的临床研究
Yamamoto等[32]进行了一项应用Nivolumab治疗结直肠癌患者的Ⅰ期临床试验,以评估Nivolumab在实体肿瘤中单剂量或多剂量治疗的安全性及耐受性。试验指定每两周给药剂量为1、3、10或20 mg/kg的Nivolumab。即使最高剂量为20 mg/kg时,仍未观察到任何剂量限制毒性,最大耐受剂量无法确定。应用Nivolumab治疗的患者具有良好的耐受性,并且无明显的不良反应。因此,对于结直肠癌患者来说是一种非常有前景的治疗方法。一项多队列Ⅰb期临床试验共招募23例PD-L1阳性的晚期结直肠癌患者,分析Pembrolizumab治疗的安全性及有效性,结果显示在治疗过程中,未出现药物相关的严重不良反应,提示Pembrolizumab在癌症治疗中是安全的,并且在微卫星高度不稳定(Microsatellite instability-high,MSI-H)者中可观察到良好的抗肿瘤活性[4]。Kim等[28]纳入了33例发生转移的结直肠癌患者,每两周接受10 mg/kg的Avelumab治疗,发现dMMR/MSI-H患者的客观缓解率(Objective response rate,ORR)为28.6%,中位无进展生存期(Progression free survival,PFS)为8.1个月,Avelumab在dMMR/MSI-H型的结直肠癌患者中显示出良好抗肿瘤活性,无明显的不良反应。一项应用Avelumab治疗晚期结直肠癌患者的研究结果表明,PD-L1的表达与药物疗效相关,TPS>5%定义为PD-L1阳性,结果显示PD-L1阳性的结直肠癌患者的ORR为39%,而PD-L1阴性的患者的ORR为13%,PD-L1表达的结直肠癌患者对Avelumab的应答率较高[2]。另外,一项Ⅰ期临床试验对Nivolumab联合铂类化疗的安全性及有效性进行了评估,该研究共招募56例非小细胞肺癌患者,结果显示免疫治疗联合化疗具有良好的耐受性,PD-L1 TPS≥1%的患者的疗效及生存预后均优于PD-L1 TPS<1%的患者[33]。Enkhbat等[22]数据进一步表明PD-L1表达与肿瘤复发和不良预后密切相关,抑制PD-L1可能是成为减少肿瘤复发并改善疾病预后新的免疫治疗策略。最近的研究有足够的证据表明利用PD-1/PD-L1信号通路恢复宿主抗肿瘤免疫即将是未来结直肠癌的成功治疗策略之一。
5 小结与展望
本文围绕PD-1/PD-L1在结直肠癌中的表达、治疗及其对预后的作用进行了总结。PD-L1在结直肠癌预后中的作用存在争议,PD-1/PD-L1在结直肠癌中研究尚未成熟,需进一步深入的研究PD-1/PD-L1作为结直肠癌生物标志物的可行性,能否通过PD-1/PD-L1的表达水平预测结直肠癌患者的预后。另外,放疗和化疗均可上调肿瘤细胞中PD-L1的表达,并且PD-L1表达水平与放疗方式和化疗方案有关,提示我们还需进一步探索不同肿瘤的免疫治疗与化疗、放疗相结合的安全性和有效性。化疗联合免疫治疗具有重要临床价值,但未来还需要对化疗方案和剂量,以及序贯顺序进行探索。放疗联合免疫治疗需要进一步验证其有效性及安全性,联合治疗中放疗方式及分割方式也值得在今后的临床工作中进一步探究。
