胰腺神经内分泌肿瘤CEUS表现与病理学分级的相关性研究
2021-09-09杨道辉于凌云邱艺杰楼文晖王文平
杨道辉,韩 序,张 琪,于凌云,邱艺杰,董 怡,楼文晖,王文平
1.复旦大学附属中山医院超声科,上海 200032;
2.复旦大学附属中山医院胰腺外科,上海 200032
胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasm,pNEN)是一类起源于神经内分泌细胞的罕见的胰腺肿瘤,其发病率逐年上升[1]。超声凭借其无创、简便、实时及可反复多次检查的优势,成为临床胰腺肿瘤筛查及术前评估的常用影像学手段。超声造影(contrast-enhanced ultrasound,CEUS)能够灵敏地显示胰腺肿瘤内部的微循环血流灌注[2-3],通过实时、动态显示病灶内造影剂增强—消退的改变,为胰腺肿瘤的术前诊断及鉴别诊断提供信息[4-6]。
pNEN的病理学分级是疾病预后及远期生存的独立预测指标[7]。术前通过影像学手段无创性地诊断及预测pNEN的病理学分级,有助于为临床制订合理的诊疗计划提供影像学信息,目前CEUS在这方面报道较少。本研究通过回顾并分析经穿刺或手术后病理学检查证实的pNEN病灶术前CEUS的表现特点,探讨pNEN病灶的病理学分级与CEUS增强—消退特征的相关性。
1 资料和方法
1.1 研究对象
回顾并分析2011年6月—2019年5月经穿刺或手术后病理学检查证实的共49例pNEN病灶的常规超声及CEUS表现,其中男性21例,女性28例,平均年龄(51.90 ± 13.21)岁。所有患者均行术前常规超声及CEUS检查,其中48例为胰腺单发性病灶,1例为胰腺多发性病灶,多发病灶选取最大病灶行CEUS检查。
1.2 仪器与方法
所有的病灶都采用常规超声及低机械指数下实时灰阶CEUS观察。采用荷兰Philips公司的iU22、德国Siemens公司的Acuson Oxana 2、美国GE公司的Logic E9彩色多普勒超声诊断仪。使用低频腹部探头,探头频率为1~5 MHz。患者取平卧位,检查时先行常规灰阶超声检查。随后,采用低机械指数下实时谐波CEUS检查(机械指数:0.05~0.30)。造影剂使用意大利Bracco公司生产的声诺维(SonoVue),每次使用前用5 mL生理盐水充分振荡混匀后,经肘正中静脉团注2.4 mL混悬液,再用5 mL生理盐水冲管。在注入造影剂的同时,对胰腺病灶进行实时连续观察,存储并记录造影剂注入后3 min内胰腺病灶的CEUS动态增强—消退过程。
1.3 超声观察指标
常规超声观察胰腺病灶的数目、部位、大小、内部回声、主胰管有无扩张等。CEUS时观察胰腺病灶在CEUS各时相的增强程度及增强方式。根据欧洲超声医学和生物学联合会(European Federation of Societies for Ultrasound in Medicine and Biology,EFSUMB)CEUS指南[8],胰腺CEUS分为动脉期(10~30 s)、静脉期(31~120 s)及延迟期(>120 s)。以周围正常胰腺为参照,连续动态地观察胰腺病灶的增强方式及增强程度。
47例pNEN病灶经手术及术后病理学检查证实,2例pNEN病灶经超声内镜引导下胰腺肿块穿刺病理学检查证实,所有患者均行H-E染色及免疫组织化学染色分析。根据神经内分泌肿瘤2017年世界卫生组织(World Health Organization,WHO)病理学分级标准分为:神经内分泌瘤(neuroendocrine tumor,NET)G1,核分裂象<2个/10 HPF和Ki-67增殖指数≤2%;NET G2,核分裂象2~20个/10 HPF和Ki-67增殖指数为3%~20%;NET G3,核分裂象>20个/10 HPF和Ki-67增殖指数>20%,形态学分化好;神经内分泌癌(neuroendocrine carcinoma,NEC),核分裂象>20个/10 HPF和Ki-67增殖指数>20%,形态学分化差。目前WHO推荐Ki-67增殖指数>55%作为诊断NET G3和NEC的阈值。既往研究[9-10]结果显示,NET G1和NET G2病灶预后明显好于NET G3与NEC。因此本研究将NET G3与NEC分为一组进行比较研究。
1.4 统计学处理
所有常规超声及CEUS图像由2名有经验的医师判断(分别有5、10年腹部CEUS经验)。采用SPSS 22.0软件进行统计学分析,定量参数采用t检验,定性资料采用χ2检验比较。胰腺病灶CEUS静脉期及延迟期增强程度、增强方式与病理学分级间关系指数采用Spearman法比较,P<0.05为差异有统计学意义。
2 结 果
2.1 pNEN病灶病理学分级
根据神经内分泌肿瘤2017年WHO病理学分级标准,最终病理学检查结果显示,15例pNEN病灶的Ki-67增殖指数均≤2%,为NET G1;23例病灶为NET G2,Ki-67增殖指数平均值6.28%;1例病灶为NET G3,10例病灶为NEC,NET G3病灶和所有NEC病灶Ki-67增殖指数均≥40%。1例多发病灶的pNEN患者病理学检查结果显示所有病灶核分裂象<2个/10 HPF和Ki-67增殖指数≤2%,最终病理学诊断为NET G1。病理大体标本下,4例NET G1、6例NET G2与6例NET G3/NEC病灶内出现囊变。
2.2 常规超声检查表现
常规灰阶超声结果显示,23例病灶位于胰头部,15例病灶位于胰腺体部,11例病灶位于胰腺尾部。NET G1病灶的平均大小为(30.4±15.7)mm,NET G2病灶的平均大小为(36.6±18.0)mm,NET G3/NEC病灶的平均大小为(39.0±19.0)mm,其间差异无统计学意义(P>0.05)。
在常规灰阶图像上,所有的pNEN病灶呈低回声实质团块。10.2%(5/49)的pNEN病灶内出现钙化样强回声,32.7(16/49)的pNEN病灶内出现不规则无回声区,8.2%(4/49)的pNEN患者伴有主胰管扩张(主胰管管径>3 mm)。
统计结果表明,pNEN病灶的大小、主胰管扩张、病灶内出现钙化或囊变等征象在NET G1、NET G2及NET G3/NEC之间差异无统计学意义(P>0.05,表1)。
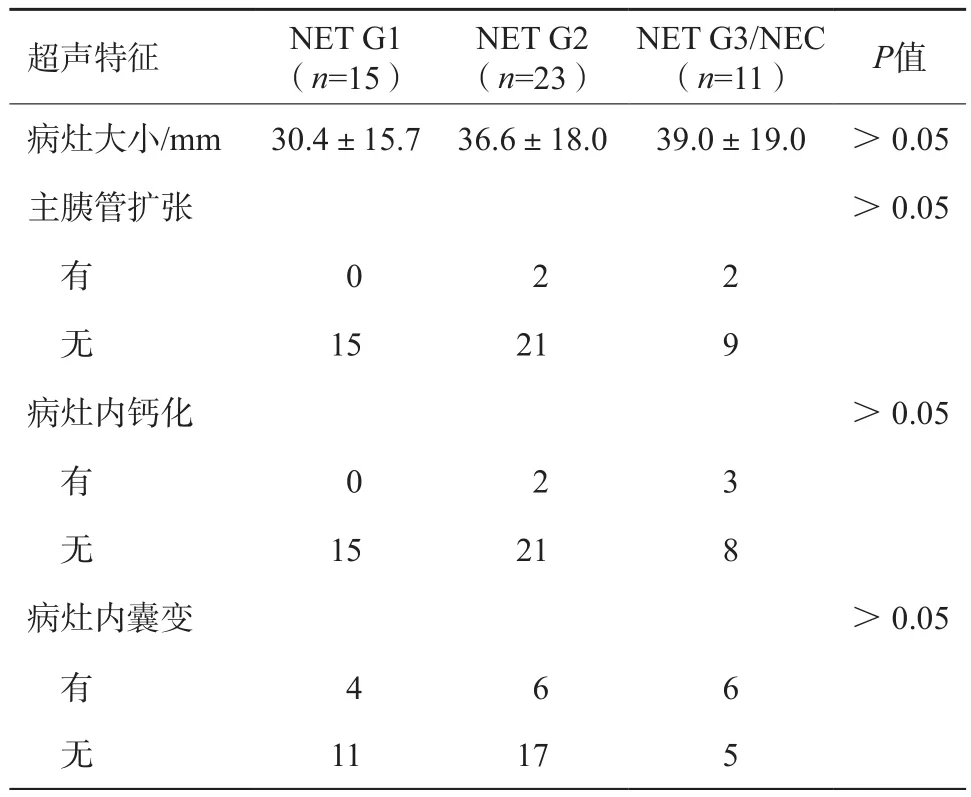
表1 NET G1、NET G2及NET G3/NEC患者常规二维超声图像特征与病理学分级
2.3 CEUS表现
CEUS动脉期,多数pNEN病灶呈高增强或等增强表现(NET G1 93.3%、NET G2 82.6%、NET G3/NEC 72.7%)。从动脉期增强方式来看,NET G1病灶以整体均匀增强为主(11/15,73.3%),NET G3/NEC病灶以整体不均匀增强为主(8/11,72.7%,P<0.05);而NET G1与NET G2、NET G2与NET G3/NEC病灶增强方式差异无统计学意义(P>0.05)。
CEUS静脉期,NET G1病灶仍以高增强或者等增强为主(14/15,93.3%),而43.5%的NET G2和45.5%的NET G3/NEC病灶快速消退,呈低增强改变(P<0.05)。CEUS延迟期,NET G1病灶以高增强或等增强为主(86.7%,图1),而多数NET G2(56.5%)和NET G3/NEC病灶(90.1%)呈低增强改变(P<0.05,图2、3,表2)。

表2 NET G1、NET G2及NET G3/NEC病灶CEUS增强程度及增强方式比较

图1 典型病例1(胰体部NET G1)的超声表现

图2 典型病例2(胰体部NET G2)的超声表现
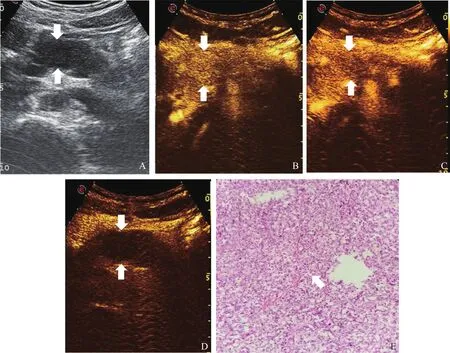
图3 典型病例3(胰体部NET G3)的超声表现
2.4 CEUS表现与病理学分级的相关性
NET G1、NET G2及NET G3/NEC病灶的动脉期增强方式与其病理学分级具有一定相关性,NET G3/NEC病灶动脉期多数呈不均匀增强,而NET G1和NET G2病灶以均匀增强为主(r=0.33,P<0.05)。静脉期及延迟期增强程度与病理学分级分别呈低度负相关(r=-0.33,P<0.05)及中度负度相关(r=-0.57,P<0.05,表3)。

表3 不同病理学分级pNEN与CEUS增强方式及增强程度的相关性
3 讨 论
现有的神经内分泌肿瘤2017年WHO病理学分级标准根据Ki-67增殖指数与核分裂数,将pNEN分为NET G1、NET G2、NET G3及NEC;pNEN的病理学分级越高,则肿瘤增殖活性越高,越容易发生淋巴结转移和远处转移,预后越差[11-12]。目前,临床上NET G1和NET G2首选外科手术治疗,而NET G3及NEC提倡综合治疗,包括外科手术治疗、全身化疗、靶向治疗、射频消融治疗及介入化疗栓塞等[13-14]。外科手术是治疗NET G1、NET G2的首选治疗方案,其术后预后良好,NET G1、NET G2患者的术后中位生存期分别大于16、8年。但NET G3及NEC患者术后预后差,中位生存期不足1年[15]。Martin-Perez等[16]研究结果显示,即使晚期的NET G1级pNEN的5年生存率(63%)也明显优于早期高级别(Ki-67增殖指数>20%)pNEN的5年生存率(17%)。因此术前用影像学方法无创、准确地预测肿瘤的pNEN病理学分级,有助于临床选择最优的治疗方案,改善患者预后。
pNEN病灶的大小与疾病的分期和预后密切相关,病灶最大径越大,提示其临床分期及病理学分级越高[13,17]。本研究结果显示,NET G1、NET G2及NET G3/NEC病灶最大径与病理学分级呈正相关。但也有研究[18]表明pNEN病灶大小对于预测疾病恶性程度的准确度仅为50%,另有研究[19]发现,约33%小于2 cm的无功能pNEN出现局部淋巴结转移。因此,单纯依据pNEN病灶大小预测疾病的预后准确度低,且假阴性率高。以往研究[20-23]结果显示,pNEN患者主胰管扩张较少。本研究结果显示,主胰管扩张这一超声表现对于鉴别NET G1、NET G2和NET G3/NEC病灶差异无统计学意义(P>0.05)。pNEN病灶的大小、钙化、囊变及主胰管扩张等声像图特征不能准确地预测疾病的病理学分级[21-22]。在本研究结果中,钙化和囊变等常规超声表现在不同病理学分级的pNEN病灶中差异无统计学意义(P>0.05)。
以声诺维为代表的第二代“纯血池”造影剂能进入胰腺组织及病灶的毛细血管网,实时、清晰、准确地显示病灶及周围胰腺实质的微循环血流灌注。CEUS在胰腺疾病的诊断、鉴别诊断中得到了广泛应用[24-26]。pNEN属于富血供肿瘤,病灶内微血管较周围胰腺实质丰富,坏死组织及纤维间质成分少,由此也决定了其特征性的CEUS增强-消退表现。以往研究[27]显示,CEUS动脉期高增强诊断pNEN的准确度、灵敏度及特异度分别为73.8%、83.3%及60.0%。本研究中83.7%(41/49)的pNEN动脉期亦呈典型高增强或等增强表现。
曾有研究[10,22,28-29]利用计算机体层成像(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)研究pNEN的增强方式与病理学分级的相关性,结果显示pNEN病灶的CT/MRI增强方式与病理学分级存在一定的相关性。但增强CT及增强MRI无法实时、动态观察病灶的增强—消退特征,且增强CT及增强MRI对比剂为非纯血池造影剂,延迟期造影剂外渗至细胞外间质在一定程度上影响pNEN病灶及周围胰腺实质的增强程度,在临床应用上存在一定的局限性[30]。D’Onofrio等[31]研究显示,术前CEUS判断胰腺病灶微循环特征的准确度优于增强CT。造影剂的微泡直径仅约3 μm,不会渗出至细胞外间质,能实时动态地观察病灶微循环的增强-消退改变。
Palazzo等[9]研究结果显示,CEUS动脉期呈不均匀增强的pNEN病灶肿瘤内微血管密度稀疏,纤维组织成分密集,容易发生转移,病灶Ki-67增殖指数明显高于均匀增强的pNEN病灶,具有更高的侵袭性。相关研究[25,32]也发现,CEUS动脉期表现为不均匀增强的pNEN病灶,具有更高的Ki-67增殖指数,也更容易发生肝转移。CEUS表现有助于术前评估和预测pNEN病灶的恶性程度,虽然这些研究结果显示Ki-67增殖指数与CEUS表现具有一定的相关性,但是各研究中心之间Ki-67增殖指数的取值不尽相同,无法简单、有效地广泛运用于临床。本研究通过比较CEUS增强表现,发现NET G1、NET G2、NET G3/NEC病灶在静脉期及延迟期的增强程度与病理学分级存在一定的相关性。静脉期及延迟期低增强表现提示为NET G2或NET G3/NEC。NET G1病灶CEUS动脉期以均匀增强表现为主,而NET G3/NEC病灶则以不均匀增强为主(P<0.05)。NET G1、NET G2及NET G3/NEC病灶在动脉期的增强方式与病理学分级呈低度相关(r=0.33,P<0.05)。因此,CEUS动脉期pNEN病灶呈均匀增强提示可能为低级别pNEN。CEUS通过实时、动态观察pNEN病灶动脉期增强方式、静脉期及延迟期增强程度,有助于术前无创预测pNEN肿瘤病理学分级。
综上所述,pNEN的CEUS表现具有一定的特征,CEUS动脉期均匀高增强提示为NET G1。动脉期不均匀高增强及静脉期、延迟期低增强提示为NET G2或NET G3/NEC的可能。CEUS有助于术前预测pNEN的病理学分级,为临床制订合理的诊疗决策提供影像学支持。
