隆突性皮肤纤维肉瘤的影像学特征分析
2021-09-09贾姝颖解添松周良平周正荣
贾姝颖,解添松,周良平,周正荣, ,陈 雷
1.复旦大学附属肿瘤医院闵行分院放射科,上海 200240;
2.复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
隆突性皮肤纤维肉瘤(dermatofibrosarcoma protuberans,DFSP)在世界卫生组织(World Health Organization,WHO)发布的2020版软组织肿瘤分类中被归于成纤维细胞/肌纤维细胞肿瘤这一大类[1]。作为一种中间型(交界性)的纤维组织来源的软组织肿瘤,DFSP虽然生长较为缓慢,病程较长,但仍具有一定的浸润性,常出现局部复发,甚至出现远处转移,因而在临床治疗中采取手术的扩大切除及综合治疗十分必要[2]。为了降低其复发率,减轻患者多次手术的身体及经济负担,通过影像学方法术前对DFSP进行准确诊断和范围评估具有十分重要的临床价值。本文回顾并分析经手术后病理学检查确诊的21例DFSP患者的临床及影像学资料,为DFSP患者的准确诊断提供一定的参考。
1 资料和方法
1.1 研究对象
回顾并分析2020年2月—2021年5月复旦大学附属肿瘤医院及复旦大学附属肿瘤医院闵行分院经手术后病理学检查确诊的21例DFSP患者,其中男性12例,女性9例;年龄25~57岁,平均年龄(41.62±10.20)岁,病程为1个月~17年。初诊13例患者均以皮肤出现质地较韧,活动性较好的无痛红色或红紫色结节的主诉就诊;5例近期肿块出现了较为明显的进展,其中2例结节境界不清,1例表面出现渗出、坏死并伴有结痂。复发患者8例,原位复发6例,远处转移2例。行计算机体层成像(computed tomography,CT)检查16例,其中平扫7例,平扫+增强扫描9例;行磁共振成像(magnetic resonance imaging,MRI)检查5例,均行增强检查。
1.2 仪器与方法
1.2.1 CT检查
采用荷兰Philips公司的Ingenuity CT扫描仪。扫描参数:管电压120 kV,管电流200~250 mA,层厚5 mm,增强扫描对比剂使用碘比醇,经外周静脉穿刺的中心静脉导管(peripherally inserted central venous catheter,PICC)高压注射,注射量为0.1 mmol/kg,注射流率3 mL/s。
1.2.2 MRI检查
采用德国Siemens公司的Magnetom Prisma 3.0 T MRI扫描仪或东软医疗系统股份有限公司NeuMR 1.5 T MRI扫描仪,线圈根据病灶部位采用头颈部、体部线圈、四肢关节专用线圈。平扫3.0 T MRI扫描仪扫描参数:T1加权成像(T1-weighted imaging,T1WI),重复时间(repetition time,TR)为490~695 ms,回波时间(echo time,TE)为9~11 ms;T2加权成像(T2-weighted imaging,T2WI),TR为4 780~5 224 ms,TE为70~74 ms。1.5 T MRI扫描仪扫描参数:T1WI,TR为9~700 ms,TE为2.5~18.0 ms;T2WI,TR为1 600~6 000 ms,TE为80~120 ms。矩阵为256×256,层厚5~8 mm,层间距为4~6 mm,激励次数为2;视野380~400 mm。增强扫描前经肘前静脉或PICC导管高压注射对比剂,对比剂使用钆特酸葡胺注射液(多它灵),注射量为0.1 mmol/kg,注射流率3 mL/s。
1.2.3 病理学检查
所有手术切除标本均行福尔马林固定石蜡包埋,H-E染色及免疫组织化学染色检查。
1.3 图像分析及数据处理
所有影像学图像均由2名具有5年以上骨软组织肿瘤诊断经验的影像诊断医师进行观察并对结果进行判定,当出现意见分歧时进行协商。记录病灶的所在部位、数量、形态、径线、密度或信号特征、与邻近组织关系及强化后特点。
2 结 果
2.1 病灶所在部位、形态、径线
19例位于皮下软组织的病灶中,发生于躯干部12例(腹部6例,背部3例,胸壁1例,会阴1例,臀部1例),头颈部2例(头部1例,颈部1例),四肢5例(右大腿2例,左臂2例,右臂1例)。2例转移患者,1例病灶位于纵隔及肺部,1例位于脊柱。肿块长径/直径为5~170 mm,平均(40.00±24.73)mm。原发肿块中的10例呈类圆形,8例呈梭形,1例呈不规则形并见周围卫星灶。发生远处转移者2例,其中1例表现为纵隔及肺内多发转移,1例表现为椎体转移。
2.2 CT表现
CT平扫原发及复发病灶14例均呈现较均质的软组织密度影,病灶内部可见不同比例的条索影,CT值为21~45 HU,平均值为(33.64±7.13)HU,增强CT中5例呈现均匀且较为明显的强化,2例肿块内可见无强化脂肪成分并出现“脂肪尾征”即向皮下软组织内脂肪成分浸润生长,1例内含较多囊性成分呈现边缘明显强化,中心实质部分强化(图1),强化后CT值增加幅度为22~57 HU,平均值为(39.62±11.90)HU。发生于皮肤与皮脂下的原发与复发病灶均与皮肤分界不清,其中6例可见病灶发生区皮肤明显增厚。1例纵隔及肺内转移者多枚病灶平扫仍呈现较为均质的软组织密度影,CT值为49 HU,内见条索影及分隔,增强CT扫描纵隔内转移灶可见边缘及分隔较为明显强化,与邻近组织分界不清,对邻近组织产生较为明显的压迫,并可见对邻近胸骨、肋骨的破坏征象,肺内转移灶强化不明显,纵隔及肺部病灶强化后CT值增加幅度平均值为19 HU(图2A、B)。1例脊柱转移CT平扫见与肌肉组织密度相仿的软组织密度肿块影,CT值为31 HU,椎体破坏较为明显(图3)。2例转移病灶的CT值与发生于皮下软组织病灶CT值及强化幅度差异无统计学意义(P均>0.05)。

图1 典型病例1(患者,男性,57岁,左侧颈部原发DFSP)MRI图像及病理学表现
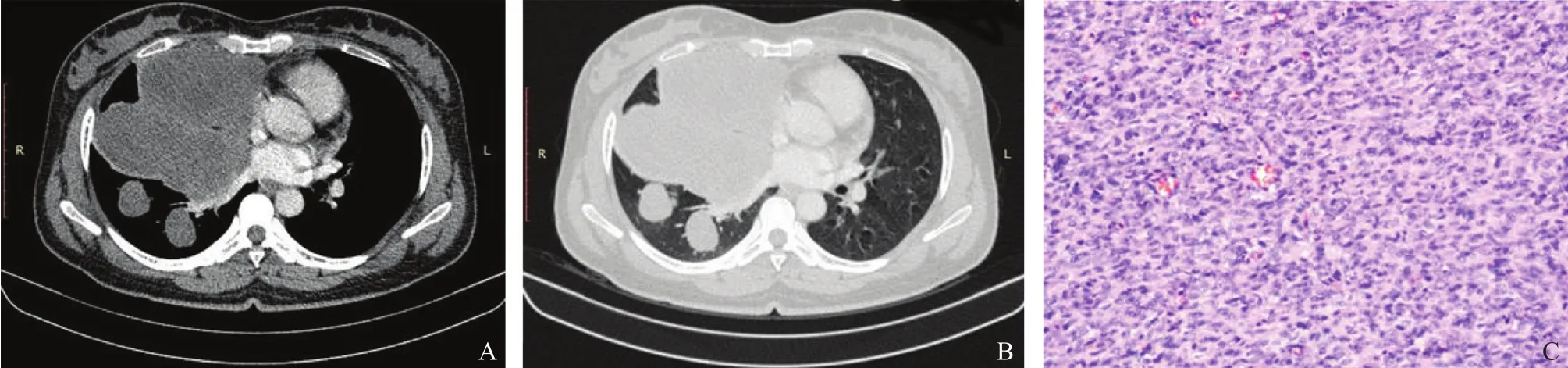
图2 典型病例2(患者,女性,44岁,DFSP远处转移)MRI图像及病理学表现

图3 典型病例3(患者,男性,50岁,DFSP远处转移)MRI图像及病理学表现
2.3 MRI表现
5例MRI平扫,T1WI呈现与肌肉组织相近的均匀等信号,T2WI高信号中可见小斑片低信号灶,即“双低信号征”,弥散加权成像(diffusion-weighted imaging,DWI)序列可见病灶弥散明显受限呈现高信号,表观弥散系数(apparent diffusion coefficient,ADC)序列相应呈现低信号。增强MRI,T1WI强化明显且较均匀(图4)。5例病灶均与皮肤分界不清,其中1例出现“筋膜尾征”即向皮下筋膜层浸润生长。

图4 典型病例4(患者,女性,33岁,左侧腹股沟区DFSP原位复发)MRI图像及病理学表现
2.4 病理学检查结果
21例患者病理学检查均诊断为DFSP,镜下瘤细胞形态多呈现为梭形或短梭形,排列方式多为车辐状或席纹状。其中5例患者病理学检查诊断为纤维肉瘤性DFSP,其瘤细胞异型性明显升高,核分裂象多见,排列方式为“鱼骨样”;1例诊断为黏液样DFSP,肿瘤实性成分明显减少并可见大量黏液成分聚集于细胞外间质。免疫组织化学染色分析21例患者CD34均为阳性表现。
3 讨 论
1890年Taglor等[3]首次对DFSP进行了报道。其后人们对此病的认识逐步深入,Pallure等[4]对DFSP的外科治疗系统回顾中提到1924年Darier等认为其是一种真皮纤维瘤,具有进行性和复发性的特点。直到1925年Ruhland等[5]将其名称确定为DFSP。
DFSP的临床发病率较低,约占全身恶性肿瘤的0.1%~1.5%[6]。该病可见于任何年龄段,以青壮年期为发病高峰期,临床工作中男性患者较为多见,在本研究中男性患者约占总患者数的57%,年龄为25~57岁,平均年龄(41.62±10.20)岁,与文献[7]报道相符。DFSP病灶好发于躯干及四肢,其次为头颈部,发生于其他部位者较为罕见[8],本组17例发生于躯干或四肢,2例发生于头颈部,2例发生远处转移。DFSP最主要的转移方式为血行转移,最常见的转移部位为肺、肝和骨骼,淋巴结转移非常罕见,本研究中1例转移至肺及纵隔,1例转移至脊柱且均未见淋巴结转移,与文献[9]报道相符。该病在临床上表现为缓慢持续生长的结节,疼痛较为少见,多为单发病灶,部分患者病灶多发,大多表现为隆起、瘢痕或斑块样结节,有报道称多结节可融合形成分叶状病灶;本组患者病程跨度1个月~17年,20例单发,1例转移患者为多发病灶,与文献[10]报道相符。由于DFSP的临床表现不典型,常因其低度恶性而误诊仅进行简单切除,有文献[11]报道DFSP误诊率在临床工作中高达90%,局部复发率占比高达20%~60%,当手术切缘距肿块边缘<20 mm,DFSP复发率为100%[11],而在Rööser等[12]的报道中提出采取广泛切除术(手术切缘>30 mm),复发率可降低90%~95%[12];本组患者中复发8例,其中3例初诊误诊为良性梭形细胞肿瘤且未行扩大切除术,因此,术前准确诊断并采取相应的临床治疗方案、术后及时复查对降低DFSP的复发率具有十分重要的意义。本组患者中2例转移病灶与其他位于皮下软组织病灶的影像学表现(包括平扫CT值、强化幅度)较为一致,这说明DFSP的影像学表现与发病部位的改变无明确相关性。
通过CT图像后处理技术(如容积成像、多平面重组)可对病灶进行精确定位,但对病灶内成分分析有限;MRI对病灶内成分分析及病灶与周围组织关系的判定具有独特的优势并可对病灶的血流特点进行定量分析;因而在术前诊断上CT与MRI可以相互补充。DFSP的影像学表现与病灶的病理学特征密切相关。DFSP中的实性成分由瘤细胞紧密排列形成,细胞外间质成分较少,坏死、囊变及出血、钙化较为少见,CT平扫呈现等或稍低密度,增强CT扫描强化程度较为明显,T1WI多呈现等或稍低信号,T2WI多呈现等或稍高信号,DWI上自由水弥散受限呈现高信号,与之相对应ADC呈低信号,增强MRI扫描呈明显强化,与DFSP为富血供肿瘤相对应。本组行MRI检查的5例患者病灶中见条片状T1WI及T2WI低信号区,呈“双低信号征”,增强MRI扫描未见明显强化,行增强CT的9例患者病灶中亦可见未强化的条索影,可能与纤维细胞或致密结缔组织聚集于肿瘤间质内有关,这可能是DFSP较为特异性的影像学表现。发生于皮肤与皮脂下的原发与复发病灶均与皮肤分界不清,其中6例可见病灶发生区皮肤明显增厚,这可以提示肿瘤来源于皮肤组织。
DFSP瘤灶可浸润到表皮下或留下一个未受累的表皮带,其上方的表皮一般没有增生,常萎缩变薄[13]。DFSP可出现向邻近组织内的尾状浸润,即为DFSP的影像学特征性表现“尾征”,根据其浸润部位被称为“皮肤尾征”(浸润邻近皮肤,多伴有皮肤增厚)、“脂肪尾征”(浸润至脂肪层)及“筋膜尾征”(浸润至筋膜层)[14]。本组患者中可见2例“脂肪尾征”,且均为复发患者。“尾征”的出现表明了肿瘤对邻近组织的侵袭水平,是其恶性程度升高的重要征象,对手术范围的划定具有重要的参考意义。
病理学检查病灶切面多呈灰白色,邻近筋膜、肌肉组织较少与之发生粘连,边界多较清且无明显包膜存在。镜下表现为梭形细胞来源的瘤细胞与细胞间隙的胶原纤维呈席纹状、轮辐状、编织状、旋涡状或束状交织排列,此病理学表现对诊断DFSP具有一定价值,但其特异性不高,不能作为单独诊断的依据[15]。因而免疫组织化学染色对于DFSP的确诊是必不可少的,波形蛋白(vimentin)与CD34呈现阳性反应,强且弥散,本组患者中CD34表现均呈阳性,与文献[16]报道阳性率72%~100%较为一致;溶菌酶(lysozyme)、平滑肌肌动蛋白(smooth muscle actin,SMA)同样具有较高的阳性表达(50%~95%),但其不稳定、局灶性表达限制了在临床工作中的应用[17]。根据组织病理学检查结果可将DFSP分为经典样、黏液样、纤维瘤样等病理学亚型[18]。
总之,当出现以下临床及影像学特征应考虑可能为DFSP:肿瘤的发生部位为较为表浅的皮肤或真皮,瘤体呈现淡红或者淡紫色,质硬无痛,CT、MRI提示皮肤分界不清,供血较为旺盛、增强强化较为明显,MRI平扫出现局部信号双低征象,向周围浸润表现出“脂肪尾征”“皮肤尾征”“筋膜尾征”的征象则提示病灶恶性程度较高。本研究为回顾性分析,检查方法有限,患者数较少,具有一定的局限性。今后将通过灌注成像、动态增强及DWI等功能成像技术对其影像学表现进行更加深入的探讨,以期能够对DFSP有更加深刻的认识。
