桑胡护肝颗粒质量标准研究
2021-09-07雷钧涛姜英子延边大学药学院延吉吉林00吉林医药学院药学院吉林吉林吉林市中医院吉林吉林
付 强,雷钧涛,王 岩,姜英子*,孔 力* (.延边大学药学院,延吉 吉林 00;.吉林医药学院药学院,吉林 吉林 0;.吉林市中医院,吉林 吉林 0)
近年来,随着人们生活水平逐渐提高,传统的饮食习惯亦发生了变化。长期不良的生活习惯会导致肝脏等器官发生损伤,损害人们的健康。柴胡护肝颗粒可以对肝脏等器官进行预防性保护,降低发病风险[1]。柴胡护肝颗粒组成包括桑黄、柴胡、葛根、五味子、茵陈、绿豆粉,含有多种有效成分。为保证产品安全稳定有效,对柴胡护肝颗粒进行质量标准的研究,主要为含量测定、定性鉴别及药典项下检查[2]。对柴胡、葛根、五味子、茵陈进行薄层色谱鉴别,以总黄酮及总多糖含量为评测指标进行含量测定,初步建立本品的质量标准,为产品质量提供有力保障[3-6]。
1 仪器与试剂
电子天平(FA2004,上海舜宇恒平科学仪器有限公司);超声波清洗器(KQ5200E,昆山市超声仪器有限公司);电热恒温鼓风干燥箱(DH-101,天津市中环实验电炉有限公司);电热恒温水浴锅(DK-98-11A,天津市泰斯特仪器有限公司)。
桑胡护肝颗粒:吉林医药学院自制,批号:20081201、20081202、20081203,主要由桑黄、柴胡、葛根、五味子、茵陈、绿豆粉等成分组成,所用药材均经吉林医药学院雷均涛教授按药典要求鉴定为正品。所用药材除桑黄外均购买于河北安国饮片有限公司。柴胡皂苷a对照品(批号:110777-201912)、柴胡皂苷d对照品(批号:110778-200506)、五味子甲素对照品(批号:110764-200107)、葛根素对照品(批号:110752-201816)、绿原酸对照品(批号:110753-201716)均购买于中国药品生物制品检验所;硅胶G薄层层析板(青岛海洋化工有限公司)。其余试剂均为分析纯。
2 方法和结果
2.1 定性鉴别
2.1.1 柴 胡
制备供试品溶液:取三批样品(20081201、20081202、20081203)各2.0 g,研细,加CH3OH溶液40.0 mL,超声10 min,过滤后滤液浓缩至2.5 mL备用,即为供试品溶液。
制备对照品溶液:取2.5 mg柴胡皂苷a加入5.0 mL容量瓶中,使用溶剂定容至刻度线处,制备为0.5 g/L的溶液即为柴胡皂苷a溶液;取5.0 mg柴胡皂苷d加入10 mL容量瓶中,使用CH3OH定容至刻度线,制备为0.5 g/L的溶液即为柴胡皂苷d溶液。
阴性溶液制备:取2.0 g按处方制备的样品(去除柴胡),按2.1.1项下方法进行阴性溶液制备,备用。
制备对照药材溶液:取柴胡饮片1.0 g,同上述方法进行操作,即为对照药材溶液。
柴胡的薄层鉴别:严格按照《中国药典》2020年第四版制剂通则0502部分操作。使用移液枪吸取上述制备液各5.0 μL分别点于自制GF254薄层板,展开剂种类及比例为:C4H8O2∶C2H6O∶H2O=4∶1∶0.5,展开后取出阴凉处晾干,按PDAB显色方法进行显色(其中PDAB浓度为2.0%,硫酸的浓度为40%),加热至60 ℃直到颜色清晰且有明显斑点为止,可以在日下对其进行观察。柴胡薄层色谱图见图1。从图1可以看出,所制备的供试产品和对照药材位置相同,且斑点清晰。在相同条件下,阴性溶液中的该位置没有斑点出现。
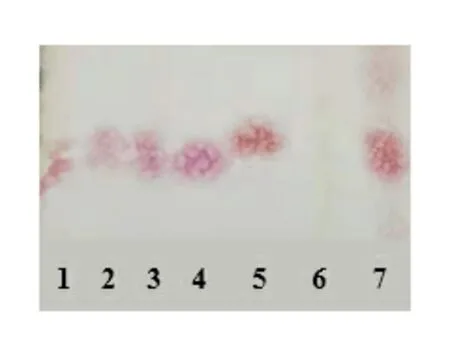
1~3.供试品,4.柴胡皂苷a,5.柴胡皂苷d,6.阴性溶液,7.对照药材
2.1.2 五味子
制备供试品溶液:取三批样品(20081201、20081202、20081203)各1.0 g,研细,使用CHCl3加热回流0.5 h,CHCl3使用量为20.0 mL,残渣使用1.0 mL CHCl3进行溶解后即为供试品溶液。
制备对照品溶液:取1.0 mg五味子甲素加入1.0 mL容量瓶中,使用溶剂定容至刻度线处,制备为1.0 g/L的溶液即为对照品溶液。
阴性溶液制备:取1.0 g按处方制备的样品(去除五味子),按上述方法制备阴性溶液后备用。
制备对照药材溶液:取五味子饮片1.0 g,同上述方法进行操作,即为对照药材溶液。
五味子的薄层鉴别:严格按照《中国药典》2020年第四版制剂通则0502部分操作,用移液枪吸取上述制备液各2.0 μL分别点于自制GF254薄层板,展开剂种类及比例为C7H7BrMg(30~60 ℃)∶C3H6O2∶CHO=15∶5∶1,展开后取出阴凉处晾干至显色清晰,有明显斑点即可,将供试品置于254 nm紫外线下。五味子薄层色谱图见图2。从图2可以看出,所制备的测试产品和对照药材在同一位置,有明显斑点,阴性溶液在相同条件下,此位置无斑点出现。
2.1.3 葛 根
制备供试品溶液:取三批样品(20081201、20081202、20081203)各1.6 g,研细,加CH3OH 20.0 mL后放置室温下120 min,溶液蒸干后的残渣使用CH3OH进行溶解,用量为1.0 mL,即为供试品溶液。
制备对照品溶液:取2.0 mg葛根素加入2.0 mL容量瓶中,使用溶剂定容至刻度线处,制备为1.0 g/L的溶液即为对照品溶液。
阴性溶液制备:除去葛根后,按处方制备的样品1.6 g,按上述方法制备阴性溶液,备用。
制备对照药材溶液:取葛根饮片1.6 g,同上述方法进行操作,即为对照药材溶液。
葛根的薄层鉴别:严格按照《中国药典》2020年第四版制剂通则0502部分操作,使用移液枪吸取上述制备液各10.0 μL分别点于自制GF254薄层板,展开剂种类及比例为CHCl3∶CH3OH∶H2O=14∶5.0∶0.5,展开后取出阴凉处晾干后使用氨气熏蒸至显色清晰,有明显斑点即可,将供试品置于254和365 nm紫外线下。葛根薄层色谱图见图3。从图3可以看出,所制备的样品和对照药材在同一位置,斑点清晰,阴性溶液在相同条件下,此位置无斑点出现。
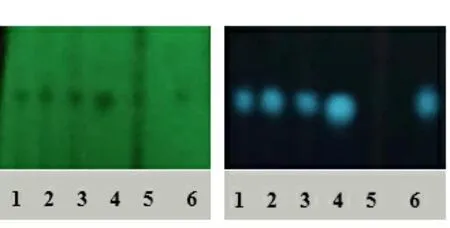
紫外灯254 nm 紫外灯365 nm
2.1.4 茵 陈
制备供试品溶液:取三批样品(20081201、20081202、20081203)各1.0 g,研细,加试液(CH3OH∶H2O=1∶1)20.0 mL后进行超声0.5 h,使用离心机离心,上清液即为供试品溶液。
制备对照品溶液:取1.0 mg绿原酸加入10.0 mL容量瓶中,使用溶剂定容至刻度线,浓度:0.1 g/L,即为对照品溶液。
阴性溶液制备:除去茵陈后,按处方制备的样品1.0 g,按上述方法制备阴性溶液,备用。
制备对照药材溶液:取茵陈饮片1.0 g,同上述方法进行操作,即为对照药材溶液。
茵陈的薄层鉴别:严格按照《中国药典》2020年第四版制剂通则0502部分操作,使用移液枪吸取上述制备液各2.0 μL分别点于自制GF254薄层板,展开剂种类及比例为CH3COO(CH2)3CH3∶CHO∶H2O=14∶5.0∶0.5,展开后取出阴凉处晾干至显色清晰,有明显斑点即可,将供试品置于254和365 nm紫外线下。茵陈薄层色谱图见图4。从图4可以看出,所制备的样品和对照药材在同一位置,斑点清晰,阴性溶液在相同条件下,此位置无斑点出现。
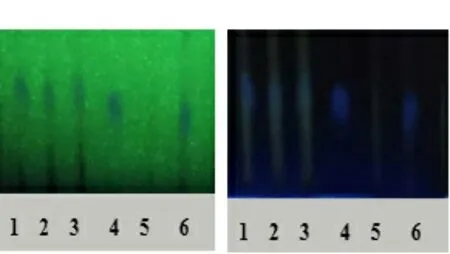
紫外灯254 nm 紫外灯365 nm
2.2 水分检查
根据2020年版中国药典的要求,采用烘干法进行测定。三批样品颗粒水分含量分别为:1.92%、2.03%、1.88%,平均为1.94%,远远小于规定值8.0%,符合规定。
2.3 溶化性检查
根据《中国药典》2020年版第四部要求,操作如下:取三批供试品各10.0 g,加70~80 ℃热水200 mL,立即观察现象。搅拌5 min后颗粒全部溶解,有个别辅料导致轻微浑浊,但均满足药典要求。
2.4 粒度检查
按药典粒度检查要求,取三批自制柴胡护肝颗粒样品(20081201、20081202、20081203)每份取10.0 g,称量1号筛筛上物及5号筛筛下物的重量,计算总占比。三批自制样品中未过1号筛及5号筛筛下物重量和的总占比平均值为13.60%,未超过药典要求的15%,符合《中国药典》2020年版的规定要求。
2.5 性状鉴别
通过观察自制样品柴胡护肝颗粒,按照气味、颜色、形状等进行性状鉴别。性状鉴别见图5。由图5可知,本品为棕褐色颗粒。品尝后口感微甜,无不良气味,满足药典要求。

图 5 桑胡护肝颗粒成品
2.6 装量差异
每批样品取10袋,称量每袋重量并与标记量进行比较。三批样品装量差异均小于2.0%,《中国药典》关于装量差异的限度为5.0%,完全满足颗粒剂的装量差异测定要求。
3 讨 论
薄层色谱法是中药定性鉴定的主要手段之一,常用于复方中药制剂的质量标准研究,在中药分析中占据重要位置[7]。本实验通过薄层色谱法对桑胡护肝颗粒中所含的在6种中药中鉴定出柴胡、五味子、银杏和葛根这4种中药。结果表明,4种中药斑点清晰,分离效果好。阴性样品无干扰,检测结果准确。实验过程中发现葛根样品按药典项下进行鉴定时在防紫外灯下无任何斑点出现,后将薄层板放置氨水中熏蒸后出现斑点,放置紫外灯下进行观察[8]。
本试验还计划对君药桑黄进行定性鉴别,对照品按文献规定采用亮氨酸,后发现阴性样品有明显干扰,查阅文献可知,绿豆粉中含有亮氨酸,无法对其鉴别,暂无最佳方案对其鉴定。今后对上述四味药材进行更深一步的研究,进一步完善质量标准,为日后研究桑胡护肝颗粒提供理论支撑,并为未来推广提供强有力的理论依据。
综上所述,建立的桑胡护肝颗粒质量标准方法简便易行,结果准确,重现性强,可用于该质量控制。
