杯芳烃双冠醚萃淋树脂对Cs+的吸附性能
2021-09-07薛静怡吕洪彬郑卫芳
薛静怡,吕洪彬,郑卫芳
中国原子能科学研究院 放射化学研究所,北京 102413
对核反应堆卸出的乏燃料进行后处理时,会产生大量的高放废液(HLLW)。高放废液的处理和处置是制约核能可持续发展的关键因素之一,其中137Cs是高放废液中较难处理的核素之一。如果能将放射比活度大、半衰期较长、释热量大的137Cs从高放废液中分离出来,不仅能达到减少玻璃固化体积、实现减容处置的目的,还能减少释热量,有助于简化地质处置的操作过程并节约成本[1]。
目前,分离高放废液中Cs的方法主要有四种:沉淀法[2]、离子交换法[3]、溶剂萃取法[4]和萃取色谱法。萃取色谱技术具有有机溶剂使用量少、废物产生少、操作简单、实验设备紧凑等优点,在Cs的分离中具有较好的应用前景。
目前,关于萃取色谱法分离Cs的研究都还仅处于实验室规模,距离工业化仍有很长的一段距离,要将萃取色谱法应用于工业规模的Cs分离中,需要探索研究新型有效的萃取剂。本工作拟采用杯[4]芳烃-双(二甲基苯并冠-6)(Calix[4]arene-bis-(di-methylbnzocrown-6),B4DC6,结构式示于图1)为萃取剂,负载到载体P120(基体是聚苯乙烯和二乙烯苯基共聚物或聚甲基丙烯酸酯)上来制备萃淋树脂,并研究其对Cs+的吸附性能。
1 实验部分
1.1 仪器和试剂
JA5003N电子天平,精度0.1 mg,德国赛多利斯集团;HY-4振荡器,江苏省常州国华电器有限公司;JI80-2B台式离心机,上海安亭科学仪器厂;X-Series Ⅱ型电感耦合等离子质谱仪(ICP-MS),美国Thermo Fisher Scientific公司;IRAffinity-1S红外谱仪(FTIR),日本岛津公司;KYKY-EM3200型扫描电镜(SEM),北京中科科仪公司。
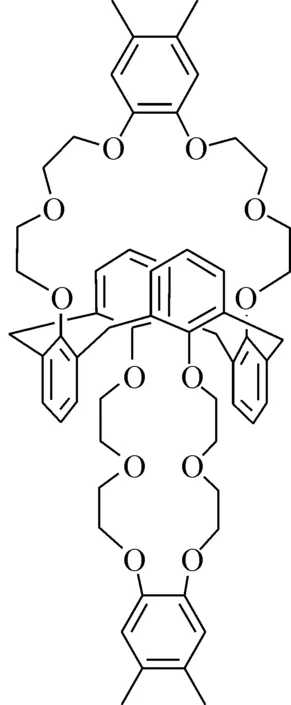
图1 B4DC6化学结构
CsNO3,分析纯,天津市永大化学试剂开发中心;B4DC6,分析纯,宁波康贝生化有限公司;P120,北京元宝山色谱科技有限公司;其它试剂均为市售分析纯,国药集团公司。
1.2 B4DC6/P120的制备
称取一定量的B4DC6于250 mL圆底烧瓶中,用100 mL二氯甲烷将其完全溶解,在不断搅拌的条件下加入一定比例(2倍质量比)的P120,将混合物在室温下于旋转蒸发仪上旋转搅拌120 min。将旋转蒸发仪的水浴锅调到45 ℃,打开真空泵,旋蒸除去二氯甲烷,直至混合物成松散的粉末。将溶剂蒸干的烧瓶置于真空干燥箱中,设置干燥温度为45 ℃,真空干燥过夜。
1.3 材料表征
采用场发射扫描电子显微镜观察材料的整体形貌特征。采用傅立叶变换红外光谱仪表征材料的表面基团价键,扫描范围为500~4 000 cm-1,扫描步长为4 cm-1。
1.4 静态吸附实验
由于137Cs与非放射性的常量Cs具有相同的化学性能,因此实验中均采用常量Cs用于吸附实验。
(2)提供更多的平台和更多的服务。在我们所熟知的各类共享平台上,共享平台企业是不会提供服务的,而往往提供服务的是各种领域的人才,比如丁香医生就是一个很大的平台,提供各种疾病的医生咨询服务。有需求的客户只需要将问题发在平台里,就会有专业的医生在下方留言,客户可以根据不同医生的回答来选择合适的进行深入的交流,通过这种咨询的方式,获得一定的佣金。还有阿姨帮、闲鱼、木鸟短租等,都是利用信息的需求来提供服务的方式盈利。
吸附动力学实验:准确称量0.10 g的吸附剂置于15 mL的离心管内,加入10.0 mL 2.0 mol/L HNO3介质下的Cs+溶液(ρ0=80 mg/L),在25 ℃恒温水浴中振荡,每隔一段时间,离心分相后取上层清液用电感耦合等离子质谱仪(ICP-MS)测定溶液中Cs+的浓度,计算出吸附剂吸附容量q(式(1))。
(1)
其中:c0为吸附前料液中金属离子的初始浓度,mmol/L;ce为吸附达平衡时料液中剩余金属离子浓度,mmol/L;V为所加料液体积,L;m为所加吸附剂质量,g。
HNO3浓度影响实验:分别配制HNO3浓度为0.1~5.0 mol/L的Cs+溶液(ρ0=80 mg/L)10.0 mL置于离心管中,加入0.05 g吸附剂。实验温度25 ℃,达到吸附平衡后取上层清液用ICP-MS测定Cs+的浓度,计算出吸附分配系数Kd(式(2))。
(2)
温度影响实验:配制HNO3浓度为3.0 mol/L Cs+溶液(ρ0=80 mg/L)10 mL置于离心管中,加入0.05 g吸附剂。实验温度分别设置为25 ℃和10 ℃,每隔一段时间,取上层清液用ICP-MS测定Cs+的浓度,计算出吸附剂吸附容量q(式(1))。
共存离子影响实验:配制HNO3浓度为3.0 mol/L的模拟高放废液(具体组成列入表1)10.0 mL置于离心管中,加入0.05 g吸附剂。实验温度25 ℃,达到吸附平衡后取上层清液用ICP-MS测定各金属离子的浓度,计算出吸附分配系数Kd(式(2))和Cs+与其它金属离子(M)的分离因子SFCs/M(式(3))。
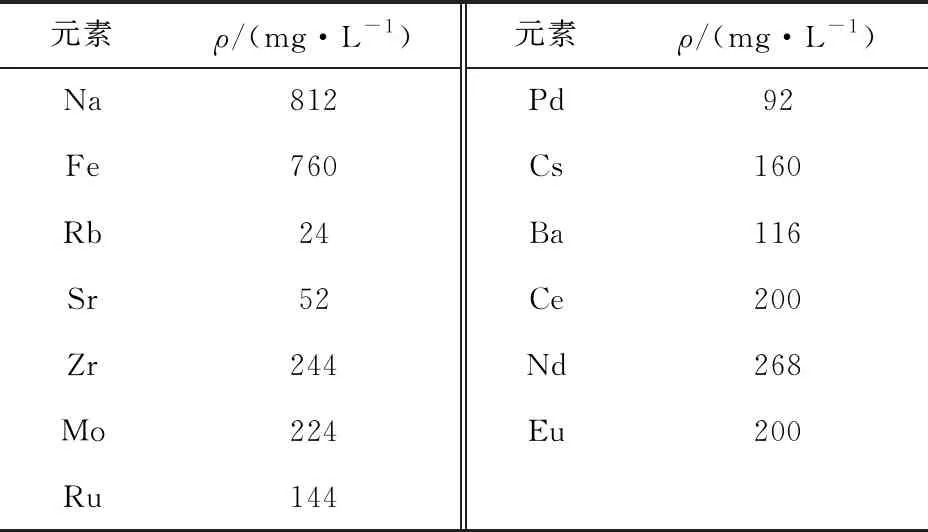
表1 模拟高放废液组成
(3)
其中:Kd(Cs)为Cs+的吸附分配系数,mL/g;Kd(M)为其它金属离子的吸附分配系数,mL/g。
1.5 动态吸附实验
采用HNO3浓度为3.0 mol/L的Cs+溶液(ρ0=30 mg/L),使用的柱尺寸为φ4 mm×40 mm,装载的吸附剂质量为0.14 g,设置的流速为0.1 mL/min,每隔一段时间取样,用ICP-MS测定Cs+的浓度,计算出吸附剂对Cs+的吸附容量q(式(4))和总去除率η(式(5))[15]。
(4)
(5)
其中:ρ0为进水中Cs+的初始质量浓度,mg/L;ρ为出水中Cs+的质量浓度,mg/L;v为流速,mL/min;m为所加吸附剂质量,g;t为流程时间,min;A为穿透曲线下方面积。
2 结果和讨论
2.1 吸附剂的表征
P120和B4DC6/P120的SEM表征结果示于图2(a,b)。图2(c)为B4DC6/P120吸附Cs+过程中表面Cs+的分布情况。由图2可知,B4DC6成功负载在P120上,担载B4DC6后P120颗粒大小与担载前没有明显的变化,B4DC6粉末附着在P120基体上,B4DC6/P120微球表面粗糙,存在大量的缝隙,这样的结构有利于吸附过程的快速进行。
B4DC6/P120和P120的FTIR谱图示于图3。比较图3的FTIR谱可知,B4DC6/P120和P120的吸收峰峰形及峰位大致相同,B4DC6/P120在合成过程中没有改变P120原有的化学结构。另外,B4DC6/P120的FTIR谱中无新的特征峰产生,表明B4DC6与P120之间的复合过程为物理过程。
2.2 静态吸附实验
2.2.1Cs+的吸附动力学 按照1.4节所述方法研究B4DC6/P120对Cs+的吸附动力学,吸附容量随时间的变化示于图4。由图4可知,B4DC6/P120对Cs+的吸附容量为3.93×10-2mmol/g(5.22 mg/g),吸附反应在24 h内基本达到平衡,吸附反应速率较慢。以下实验时间均采用24 h。

(a)——P120(×500),(b)——B4DC6/P120(×1 000),(c)——吸附Cs+的B4DC6/P120(×5 000)
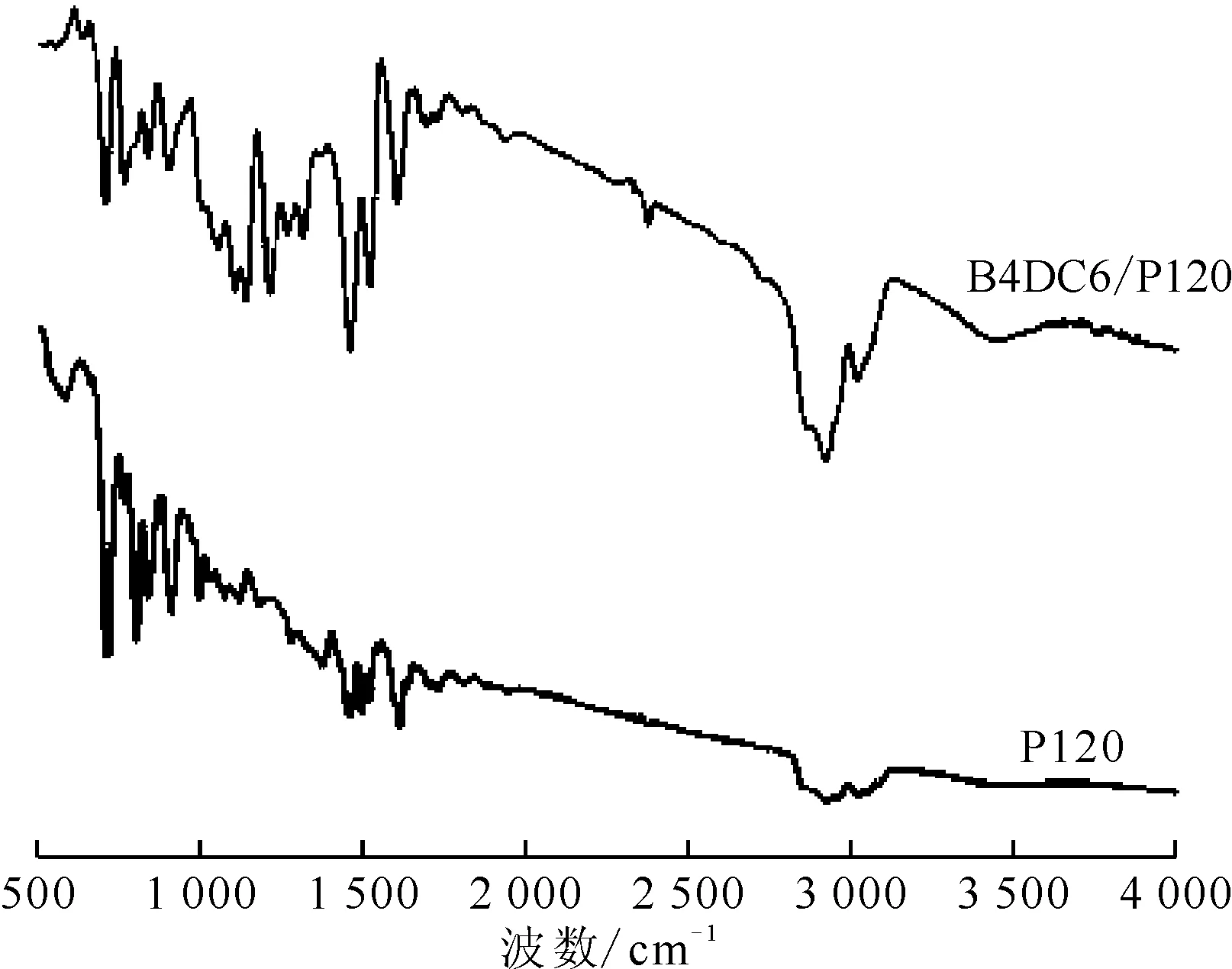
图3 B4DC6/P120及P120的FTIR谱
对吸附动力学数据分别采用准一级动力学模型(式(6))和准二级动力学模型(式(7))拟合如下[16]:
(6)
(7)
式中:qt和qe分别为在t时刻和吸附平衡时的吸附容量,mg/g;k1为准一级吸附速率常数,min-1;k2为准二级吸附速率常数,g/(mg·min);t为吸附时间,min。两种模型拟合曲线示于图5,拟合模型参数列入表2。由准一级动力学方程得到的平衡吸附容量理论值为5.60 mg/g,与实验所得吸附容量5.22 mg/g相比无明显偏差。准一级动力学方程拟合曲线的相关系数r2=0.989,明显好于准二级动力学方程(r2=0.784)。这说明相较于准二级动力学方程,吸附剂对Cs+的吸附过程更符合准一级动力学方程,虽然杯芳烃双冠醚理论上可以萃取两个Cs+,但动力学方程显示其更可能只结合了一个Cs+。
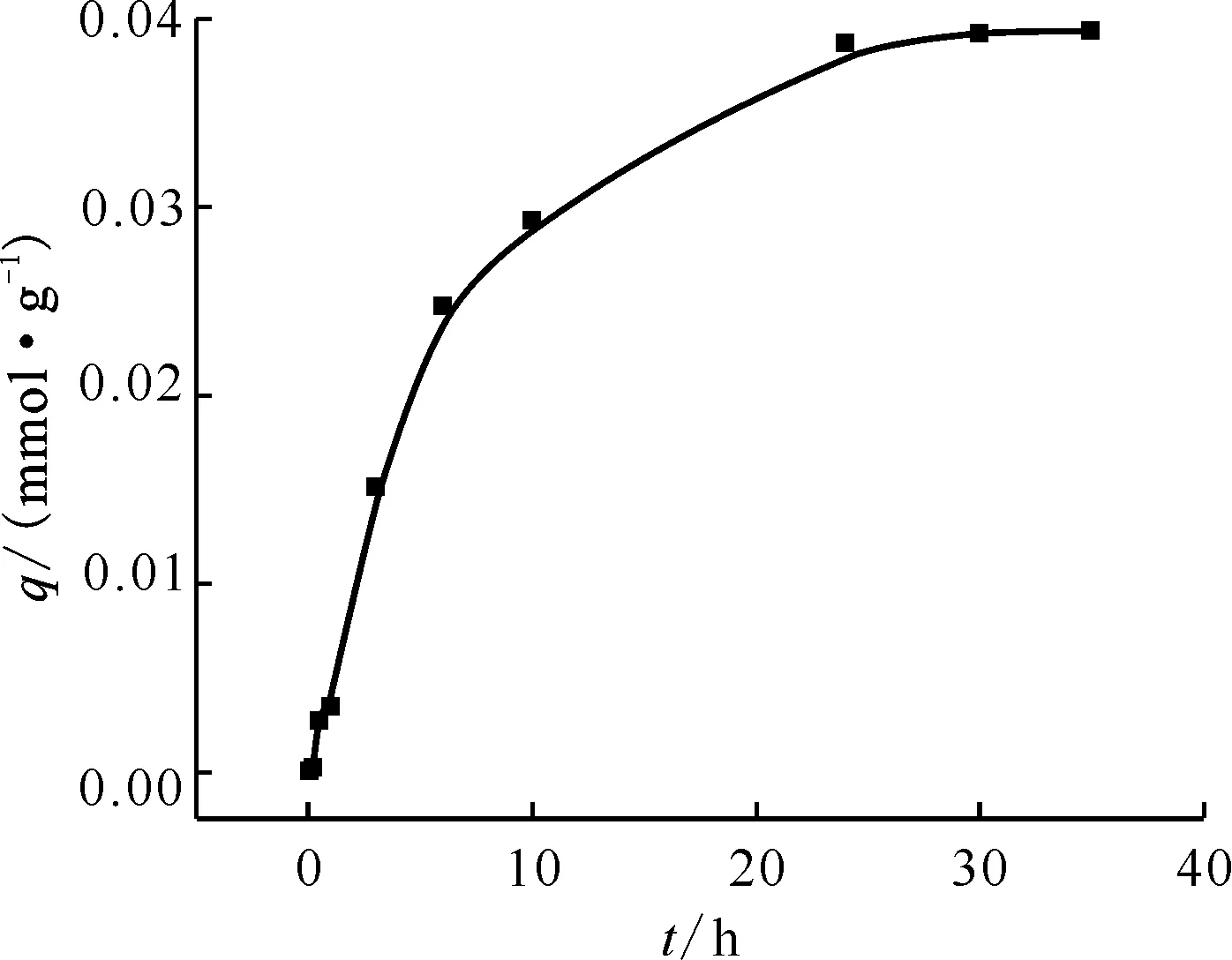
0.10 g吸附剂,c(HNO3)=2.0 mol/L,ρ0=80 mg/L,25 ℃
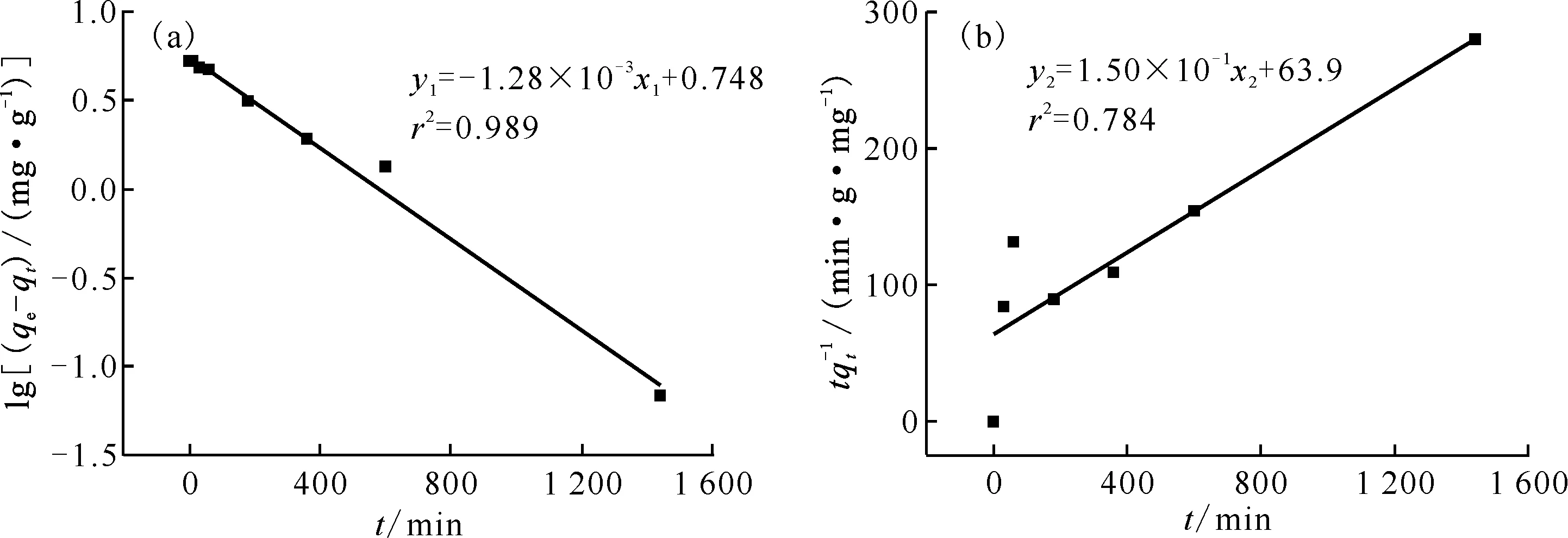
图5 准一级动力学(a)与准二级动力学(b)模型

表2 准一级动力学与准二级动力学模型参数
0.05 g吸附剂,ρ0=80 mg/L,25 ℃
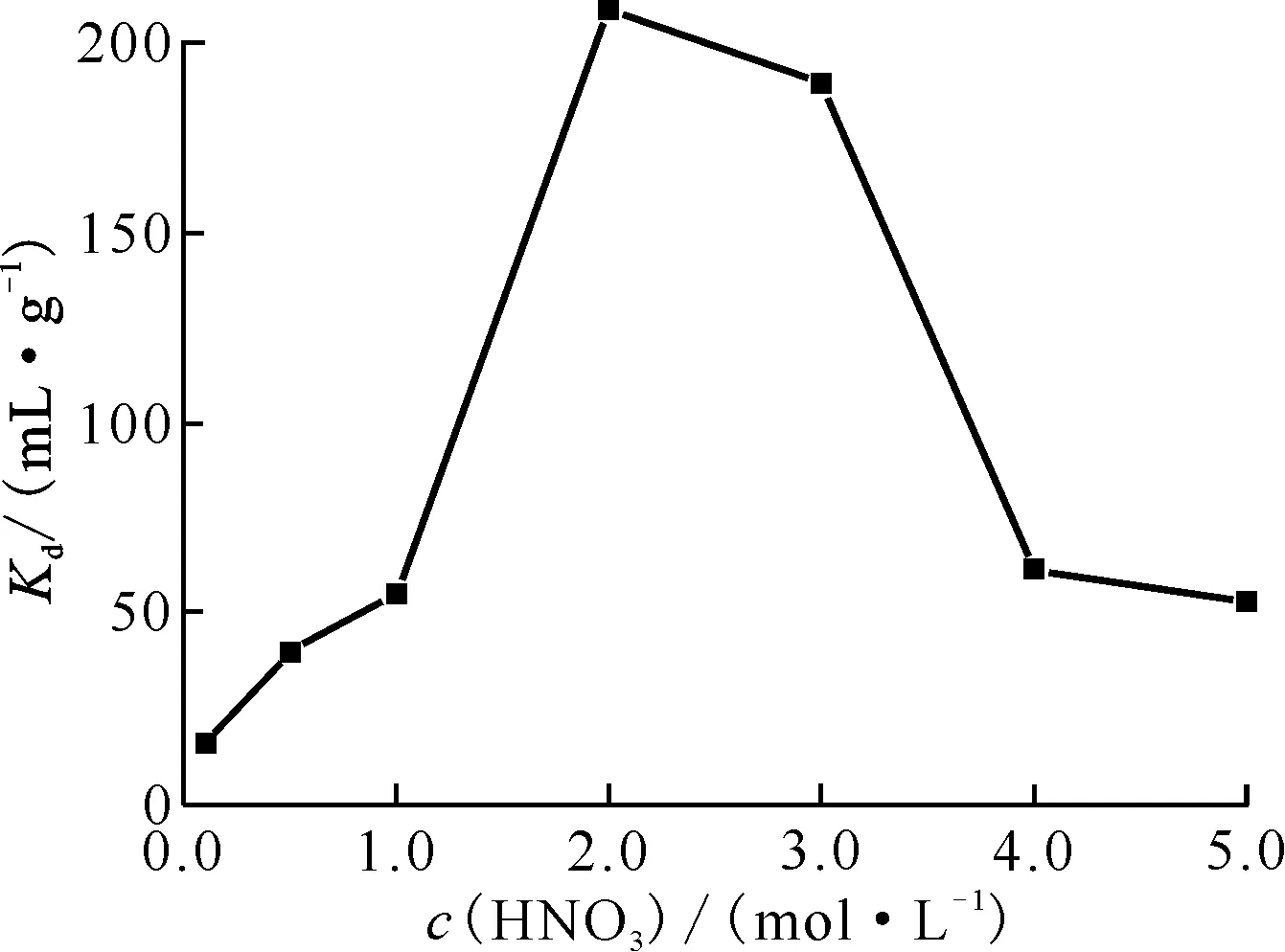
2.2.2HNO3浓度对Cs+吸附性能的影响 考察不同酸度条件下B4DC6/P120对Cs+的吸附性能,结果示于图6。由图6可知,B4DC6/P120对Cs+的吸附分配系数随着酸度的升高先增大后减小。当HNO3浓度为2.0~3.0 mol/L时,B4DC6/P120对Cs+表现出良好的吸附性能,在2.0 mol/L和3.0 mol/L HNO3时Cs+的吸附分配系数分别为208 mL/g和189 mL/g。当HNO3浓度从0.1 mol/L增加至2.0 mol/L,B4DC6/P120对Cs+的吸附分配系数明显增加,说明在低HNO3浓度下,B4DC6与Cs+之间的配位作用占主导地位,即B4DC6/P120对Cs+的吸附占主导地位,吸附过程表示如下[14]:
CsNO3·B4DC6/P120
(8)
当HNO3浓度大于2.0 mol/L时,B4DC6/P120对Cs+的吸附分配系数有所降低,说明在较高HNO3浓度条件下,B4DC6与HNO3分子之间的缔合作用占主导地位,与B4DC6/P120对Cs+的吸附过程形成竞争反应,缔合过程表示如下[14]:

HNO3·B4DC6/P120
(9)
2.2.3温度对Cs+吸附性能的影响 考察不同温度条件下B4DC6/P120对Cs+的吸附性能,结果示于图7。由图7可知,B4DC6/P120对Cs+的吸附容量随温度的升高明显增大,说明升高温度有利于Cs+的吸附,降低温度有利于Cs+的解吸。
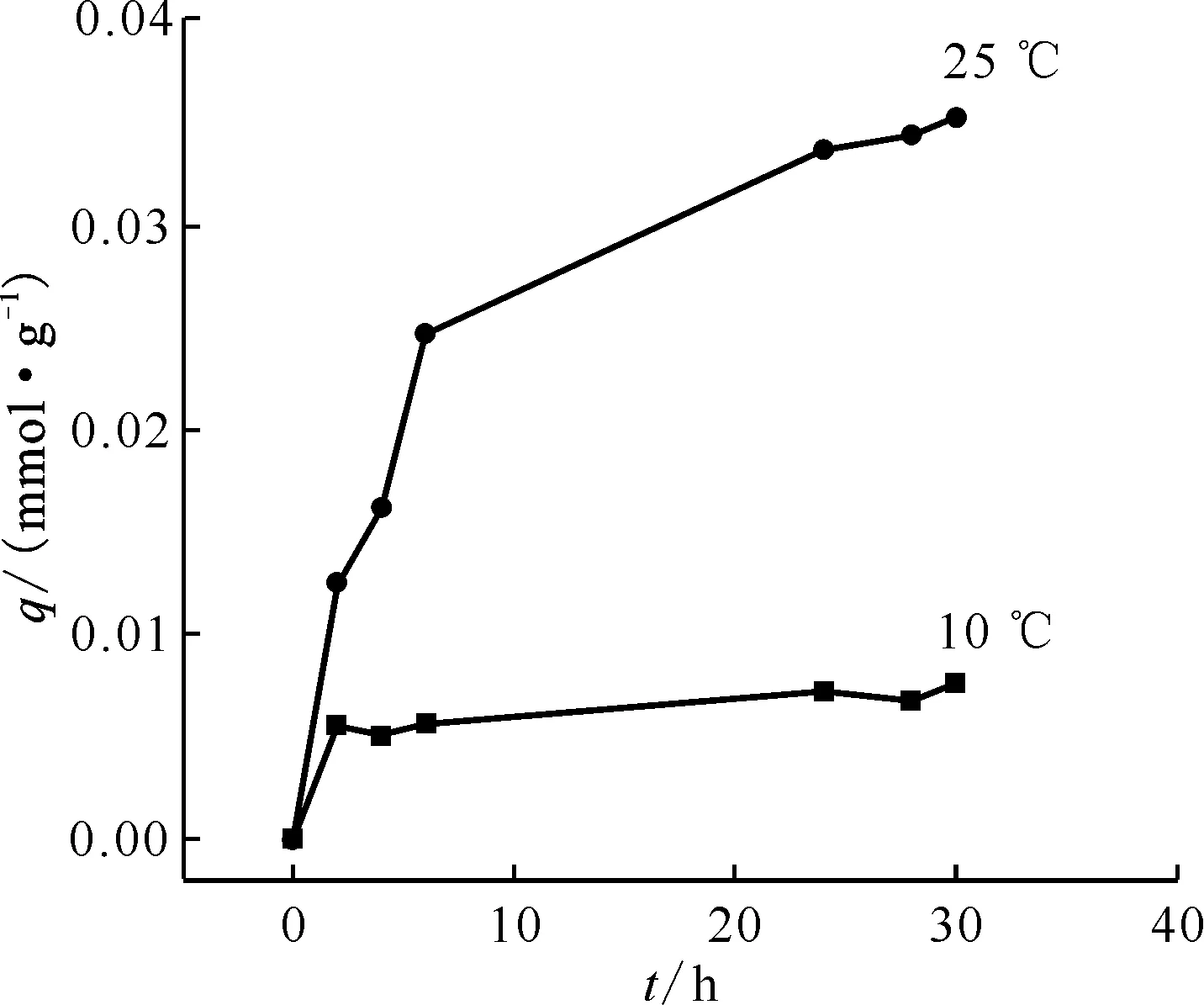
0.05 g吸附剂,c(HNO3)=3.0 mol/L,ρ0=80 mg/L

0.05 g吸附剂,模拟高放废液(c(HNO3)=3.0 mol/L),25 ℃
2.2.4共存离子对Cs+吸附性能的影响 利用模拟高放废液考察了多种共存离子条件下B4DC6/P120对Cs+的吸附性能,结果示于图8。从图8可以看出,B4DC6/P120对Na+、Rb+、Sr2+、Ba2+、Fe3+、Nd3+、Ru3+、Ce3+、Eu3+和Mo6+基本不吸附或吸附性能较弱,对Cs+、Pd2+和Zr4+吸附能力较强。B4DC6/P120对Cs+和对其它金属离子的分离因子列入表3。表3结果表明:B4DC6/P120对Cs+的选择性良好,对Cs+和其它金属离子的分离因子较高,除Pd2+和Zr4+外,分离因子均大于10,说明在HNO3浓度为3.0 mol/L时,采用B4DC6/P120为固定相的萃取色谱法可将Cs+与其它金属离子相分离。
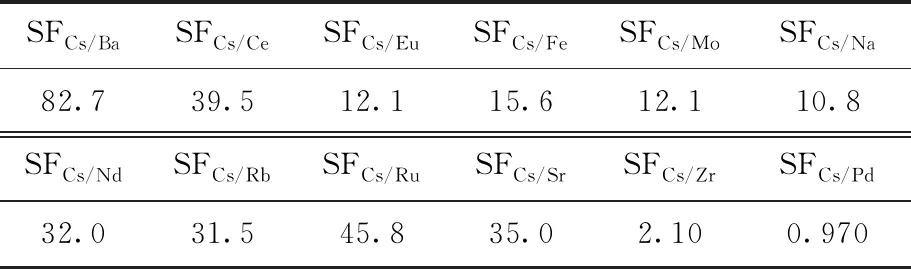
表3 Cs+对其它金属离子的分离因子
2.3 动态吸附实验
为了进一步验证B4DC6/P120对Cs+的吸附特性,将其装入离子交换柱中进行了动态吸附性能研究,结果示于图9。从图9可以看出,穿透曲线形状呈S形,表明萃取剂B4DC6并没有从载体P120中脱漏出来。ρ/ρ0=0.05的穿透点处理溶液量约为2.2 mL,吸附饱和时的溶液处理量约为9.0 mL,所对应的吸附容量分别为3.42×10-3mmol/g和6.99×10-3mmol/g,交换柱对Cs+的总去除率为49.0%。
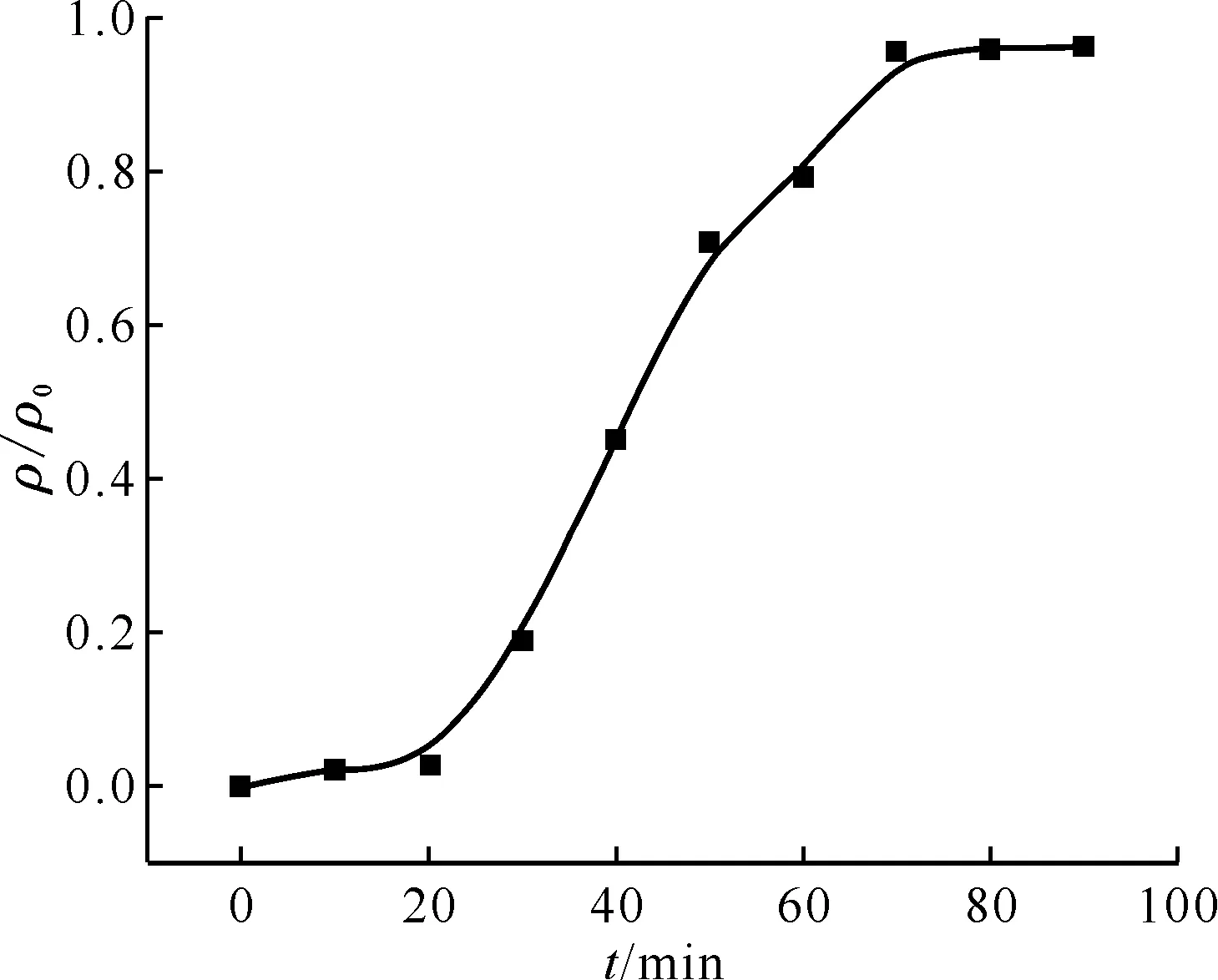
0.14 g吸附剂,c(HNO3)=3.0 mol/L,ρ0=30 mg/L,流速0.1 mL/min,室温
3 结 论
(1) B4DC6/P120对Cs+的吸附平衡时间约为24 h,其吸附过程符合准一级动力学方程。
(2) B4DC6/P120对Cs+的吸附性能随着酸度的升高先增大后减小,HNO3浓度为2.0~3.0 mol/L时,对Cs+的吸附性能良好;高温有利于Cs+的吸附。
(3) 模拟高放废液吸附结果显示,B4DC6/P120对Cs+具有较好的吸附性能和较高的选择性,对Pd2+和Zr4+之外的金属离子的分离因子均大于10。
(4) B4DC6/P120对Cs+的动态饱和吸附容量为6.99×10-3mmol/g。
