草酸铈成核和晶体生长动力学
2021-09-07李传博吕洪彬晏太红郑卫芳
王 博,李传博,吕洪彬,晏太红,郑卫芳
中国原子能科学研究院 放射化学研究所,北京 102413
PUREX流程中,钚尾端处理工艺中需将硝酸钚溶液转化为草酸钚沉淀[1-3],这是核燃料循环中最重要的环节之一。其对钚尾端得到的草酸钚产品的粒径、形貌、比表面积、密度等均有严格要求,例如为了有利于沉淀颗粒的过滤,希望沉淀的粒度越大越好[2],但为了煅烧后氧化钚的活性适宜,又需控制粒度不能过大。所以控制草酸钚沉淀颗粒的形貌和粒径,使其达到后续工序的使用要求显得十分重要。成核和晶体生长动力学是沉淀制备过程中的重要理论基础,它影响着沉淀颗粒的形貌和粒径,并对沉淀颗粒的性能起决定性作用[4]。因此,获得草酸钚沉淀动力学的基础数据,对于沉淀工艺的优化指导、模拟和沉淀反应器的放大设计有着重要的现实意义。目前国内外的公开研究报道中,还没有草酸钚沉淀动力学的研究数据。由于钚是一种毒性强、材料昂贵的放射性核素,宜首先采用非放的模拟元素进行有关草酸盐沉淀动力学的研究。
有关结晶动力学的研究,大多数采用以粒数衡算方程为基础的间歇动态法、连续稳态法和连续动态法来同时求得成核和晶体生长动力学参数[5-8],该方法主要适用于亚稳区较宽的结晶动力学研究,对于几乎无亚稳区的快速沉淀动力学的研究,并不适宜。有学者采用连续稳态法通过数学方法推算得到了特定条件下草酸铈的沉淀动力学数据[9]。
有关快速沉淀反应动力学的研究,Nielsen[10]首先提出了一种用于成核测量的快速混合技术,该方法的原理是:采用机械力将两股等体积的反应试剂迅速、同时推入至一定长度的细管(成核管)中进行瞬间混合并反应成核,晶核和母液随即被迅速喷入至含有一定组分和体积的稀释液中进行稀释,使晶核在稀释液中缓慢成长至可测粒径尺度(通常大于1 μm),并需避免二次成核、晶核溶解或聚集引起成核总数量的变化。该方法已经用于碳酸钡[11]、草酸亚铁[12]和草酸铀(Ⅳ)[13]等物质的沉淀动力学研究,但测定成核动力学时反应液稀释倍数(即反应料液进入稀释液后的稀释倍数,下文简称稀释倍数)对成核数量测定的影响未明确给出。稀释倍数对成核速率的测量有着重要影响,必须避免晶核在稀释液中发生溶解、聚集或团聚。本研究拟提出一种对于不同浓度反应液成核时最佳稀释倍数的确定方法,并研究草酸铈成核动力学和晶体生长动力学。
1 实验原理
1.1 成核动力学
对于沉淀反应成核,根据经典成核理论,初级成核速率可以表示为[14]:
(1)
式中:RN为初级成核速率,即单位时间、单位体积内成核的数量,m-3·s-1;AN和BN分别为成核动力学参数,AN的单位为m-3·s-1;S为过饱和比,按照公式(2)定义为[11]:
(2)

初级成核速率RN可通过公式(3)计算得到:
(3)
式中:N为成核的数量;V为成核管的体积,m3;t为成核过程所用的时间,即为混合的反应料液通过成核管的时间,s。
为得到成核动力学参数AN和BN,将式(1)两边取对数,得到式(4),以lnRN-1/(lnS)2作图可以得到一条直线,通过斜率-BN和截距lnAN,即可计算得到成核动力学参数AN和BN。
(4)
成核动力学参数AN为总的成核速率常数,其为温度的函数:
(5)
式中:AN0为成核动力学参数的指前影响因子,m-3·s-1;Ea为活化能,J/mol;T为温度,K。
1.2 反应成核时的稀释倍数
沉淀反应成核时,稀释倍数是影响成核动力学测定的关键因素,为得到真实、准确的晶核数量,须保证沉淀生成的晶核只在稀释液中发生缓慢生长,至仪器可测粒径范围,需要控制好稀释液的体积,防止稀释液体积过小发生二次成核或聚集,或稀释液体积过大发生晶核溶解。不同的反应料液浓度对应的最佳稀释倍数不同。本研究定义了稀释过饱和比,原理如下:假设两股反应料液未经成核管直接进入到稀释液中被迅速稀释,则结合稀释液中含0.1 mol/L草酸,可得稀释液中草酸铈的稀释过饱和比Sn,如下式所示:
(6)
式中,n为反应料液的稀释倍数。本研究中Sn取值为1.65,通过计算得到不同条件下的稀释倍数,可有效避免生成的晶核在稀释液中发生二次成核、聚集或溶解。
1.3 生长动力学
对于稳态操作下的混合悬浮混合产品排除 (MSMPR)结晶器,如果悬浮料液中,晶体生长与原晶粒的初始粒度无关,则粒数衡算方程可表示为[15]:
(7)
式中:L为颗粒粒径大小,m;n(L,t)为颗粒的粒数分布;G(t)为颗粒线性生长速率,m/s。通过转化为矩方程,可以推导得到[11]:
(8)

根据铈元素在液相和固相中的物料守恒:
VL(c0(Ce3+)-ct(Ce3+))=2Vs(cs-cs,0)
(9)
式中:c0(Ce3+)及ct(Ce3+)分别为初始时刻和反应t时间后溶液中的Ce3+摩尔浓度,mol/L;cs,0及cs分别为初始时刻和反应t时间后浆料中固体的摩尔浓度,mol/L;VL和Vs分别为结晶器中溶液和悬浮液的体积,L。将式(9)带入式(8),可以得到:
(10)
其中ns(t)=Vscs(t),为悬浮液中固体颗粒的摩尔数量。为保证获得准确的dct(Ce3+)/dt,采用三次样条插值函数对Ce3+浓度随时间变化曲线进行拟合[16]。
生长速率由经验公式表示[4]:
G(t)=kgδg(t)
(11)
其中,kg和g为生长动力学参数,δ为相对过饱和度,定义如下:
(12)
将公式(11)的两边取对数,以lnG-lnδ作图可得到生长动力学参数kg和g。考虑温度对生长速率的影响,则生长速率可表示为:
(13)
其中kg0为生长动力学参数的指前影响因子,m/s。
2 实验部分
2.1 原料与仪器
六水合硝酸铈,纯度99.95%,麦克林试剂公司;二水合草酸、硝酸,分析纯,国药集团;明胶,ACROS公司。
QICPIC/R-LIXELL激光颗粒粒形分析仪,德国新帕泰克公司;SBSS型颗粒计数器,德国PAMAS公司;成核动力学装置,自制;千眼狼5KF20高速摄像机,合肥富煌君达高科信息技术有限公司;IRIS Intrepid Ⅱ型电感耦合等离子体原子发射光谱仪(ICP-AES),美国Thermo公司;Quanta 650 FEG扫描电镜,美国FEI公司;D8 advance型X射线衍射仪(XRD),德国Bruker公司。
2.2 成核动力学装置
成核动力学实验装置示意图示于图1。图中进样针内分别盛有相同体积的硝酸铈和草酸溶液,并经过水浴加热至实验温度,开启气压阀门,进样针内的两股反应液在0.35 MPa的气压下被推入成核管内(成核管长7.85 cm),迅速混合并成核。生成的晶核及溶液随即迅速喷入至一定体积、剧烈搅拌着的稀释液中,使成核停止,降低搅拌转速,晶核缓慢生长。
2.3 实验方法
2.3.1草酸铈的溶解度 为计算不同实验条件下草酸铈的过饱和比,需要得知该条件下草酸铈的溶解度。Sarver等[17]研究了草酸铈的溶解度,但是无不同温度、低硝酸浓度下的溶解度数据。本研究测量了不同温度和硝酸浓度下的草酸铈溶解度:分别向5 mL 0.250~1.500 mol/L硝酸+0.100 mol/L草酸溶液中加入2 g草酸铈颗粒,在25 ℃下恒温14 d,混匀、离心,取上清液,用ICP-AES测量母液中铈离子的浓度。改变温度从25 ℃到50 ℃,重复上述操作。

图1 成核动力学实验装置示意图
2.3.2成核动力学
(1) 成核时间的测定
成核管中充满去离子水,0.35 MPa的气压下,推动进样针中的硝酸铈和草酸溶液流经成核管。用高速摄像机拍摄该过程中成核管管口液体流出的时间。则成核时间可由下式计算得到:
t=t1V/V′
(14)
式中:t、t1分别为成核时间、液体流出时间,s;V和V′分别为成核管的体积和反应料液的总体积,cm3。
(2) 反应成核时稀释倍数的确定
25 ℃时,在0.35 MPa气压的推动下,1.39 mL含0.430 mol/L硝酸+0.357 mol/L硝酸铈溶液和1.39 mL 0.735 mol/L草酸溶液于成核管中发生初级成核,在一定体积的稀释液(0.750 mol/L硝酸+0.100 mol/L草酸+2 g/L明胶)中快速稀释,明胶作为分散剂可以减少颗粒的团聚[10],搅拌速率1 100 r/min,稀释后降低转速至450 r/min,生长5 min,用颗粒计数器分析稀释液中颗粒的数量,颗粒计数器测量的直径按最大弦长定义。改变稀释倍数(73.6~789倍),考察Sn(1.36~3.69)变化时对成核速率的影响。同样方法用0.167 mol/L硝酸铈溶液和0.450 mol/L草酸溶液反应成核,考察不同Sn(1.37~3.59)对成核速率的影响。各实验条件列于表1。
(3) 成核速率的测定
实验方法同上,在反应温度25~50 ℃时,0.030~0.400 mol/L硝酸铈溶液和0.250~0.800 mol/L草酸溶液在成核管中反应成核,控制稀释倍数使Sn=1.65。成核时间通过高速摄像机测得为4.35 ms。测得不同条件下的草酸铈成核速率,各实验条件列于表2。

表1 确定稀释倍数的实验条件

表2 测定成核速率的实验条件
2.3.3生长动力学 将340 mL 0.750 mol/L硝酸+0.100 mol/L草酸的草酸铈饱和溶液和1.39 mL 0.800 mol/L草酸溶液加入至带挡流板的批式反应容器中,25 ℃下恒温20 min,加入60 mg草酸铈晶种(中位粒径D50为9.15 μm),超声30 s,搅拌,快速加入1.39 mL 0.30 mol/L硝酸+0.400 mol/L硝酸铈溶液,使晶种生长,分别于30、60、120、180、240 s时取样分析晶粒粒度和母液中铈离子浓度,测量的粒度按最大弦长定义。同样方法,改变温度从25 ℃到50 ℃,考察温度变化对生长动力学的影响。本实验过程中相对过饱和度不超过9,生长过程中不发生成核反应。
3 结果与讨论
3.1 草酸铈的溶解度
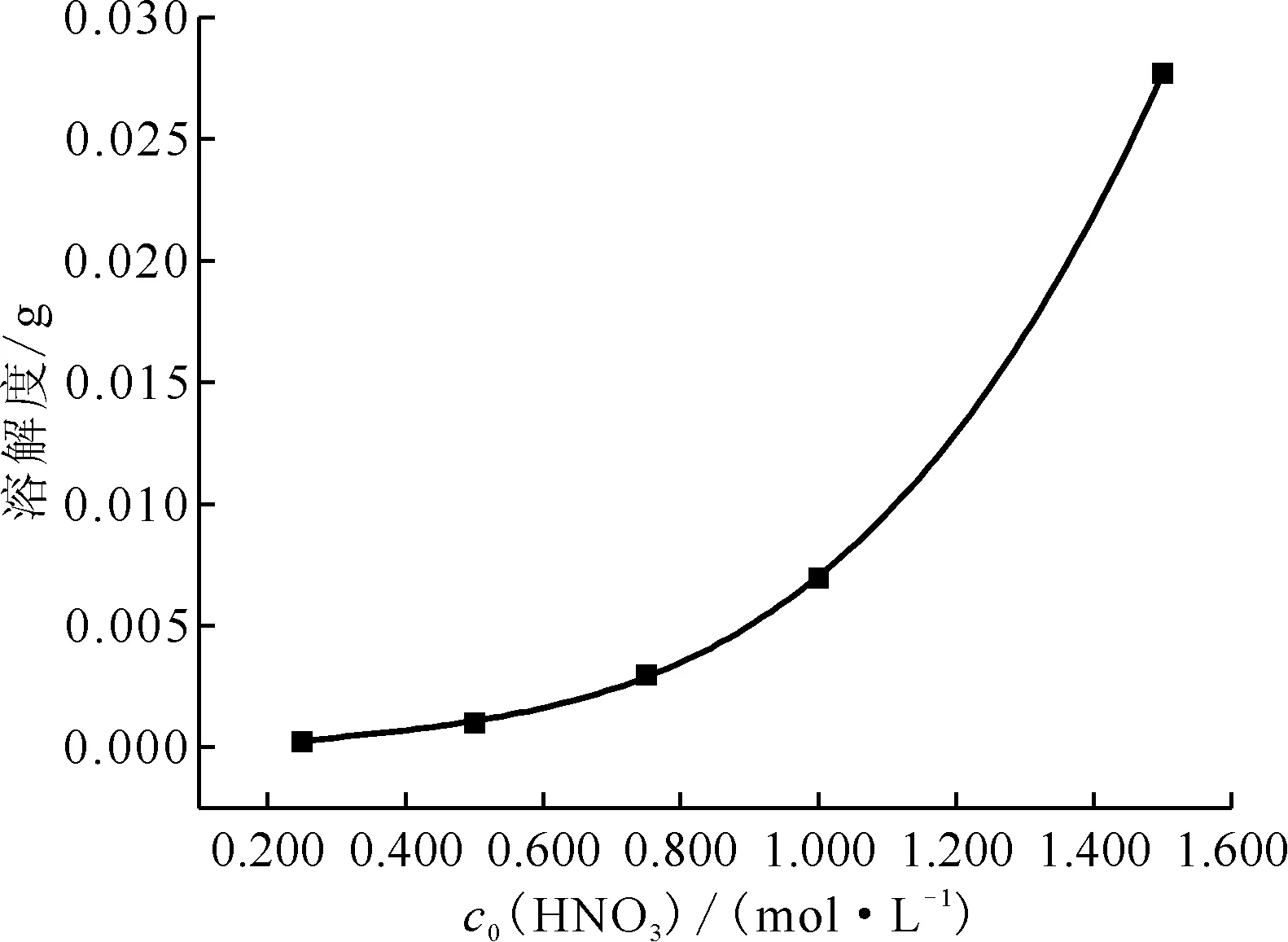
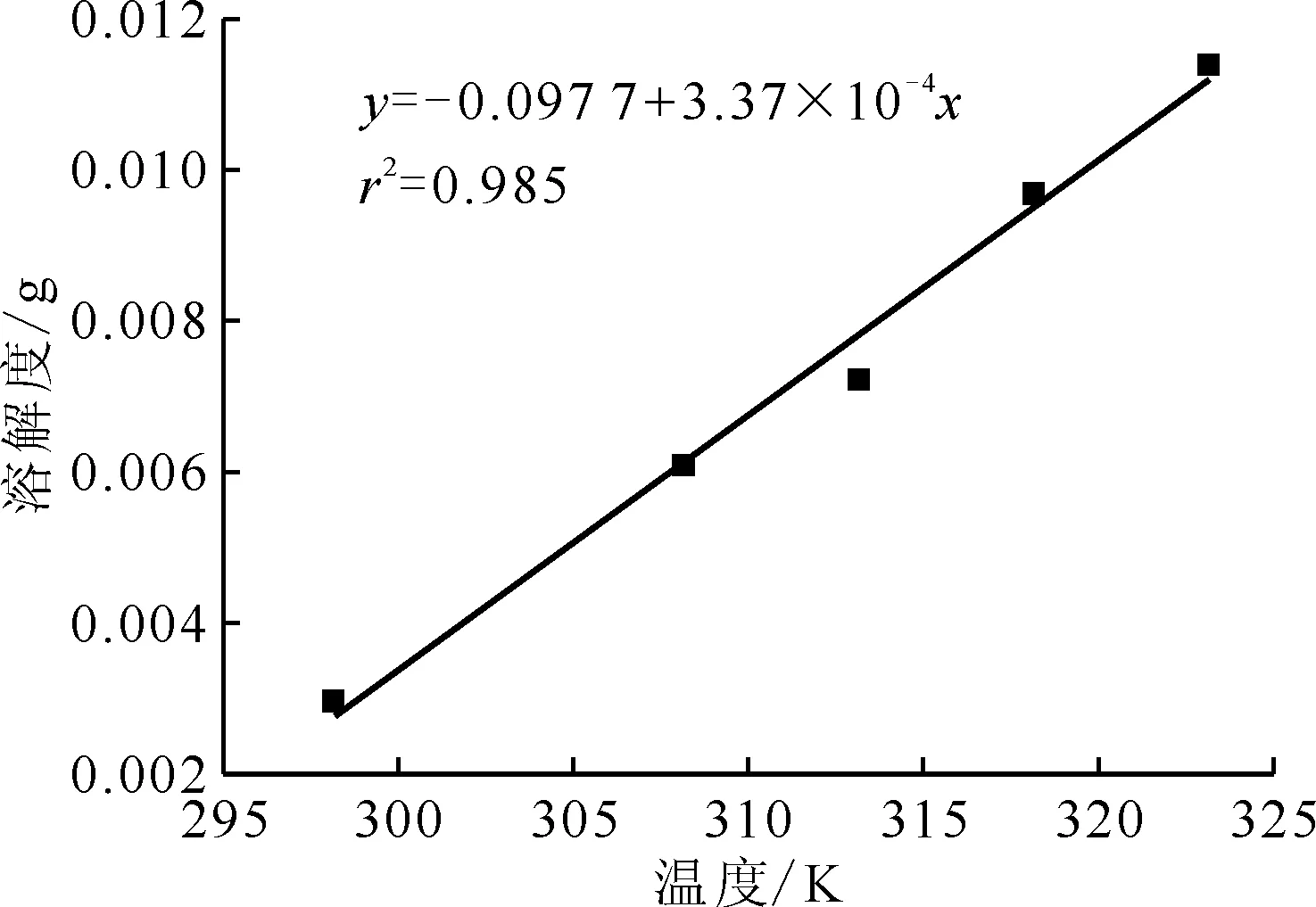
25 ℃时,在0.250~1.500 mol/L硝酸+0.100 mol/L草酸溶液中草酸铈溶解度随硝酸浓度的变化示于图2。不同温度下,0.750 mol/L硝酸+0.100 mol/L草酸溶液中草酸铈溶解度数据示于图3。草酸铈的溶解度随着温度及硝酸浓度的增大而增大。25 ℃时,本研究所用稀释液的草酸铈溶解度为2.98 mg。
25 ℃
3.2 草酸铈成核动力学
3.2.1稀释倍数 改变稀释倍数,硝酸铈浓度分别为0.167 mol/L和0.357 mol/L时,考察了不同稀释过饱和比Sn对成核速率的影响,结果示于图4。由图4可以看出:随着Sn的增大,成核速率先增大后减小,当成核速率最大时,为最佳的Sn值。将成核速率归一化处理,由图4中小图可以看出:在最佳Sn附近,斜率较大,这说明了Sn的微小改变会导致成核速率测量的巨大误差:硝酸铈浓度为0.357 mol/L时,Sn从1.63变至1.54时,成核速率降低了60%;硝酸铈浓度为0.167 mol/L时,Sn从1.69变至1.50时,成核速率降低了40%。在硝酸铈浓度为0.167 mol/L和0.357 mol/L时,最佳Sn基本保持不变,分别为1.69和1.63,此外,在不同温度和硝酸铈浓度条件下的成核速率测定中,多点Sn的实验也表明了最佳Sn为1.65,由此可以看出,通过定义的Sn值可以方便地确定最佳稀释液倍数,有效保证成核速率测量的准确性。Sn的改变,即稀释倍数的改变,极大地影响了成核速率的测量结果,这是因为过多或过少的稀释液会导致晶核发生溶解或聚集。因此,适宜的稀释倍数是得到准确的成核速率的关键。图5给出了最佳Sn时的典型累积颗粒计数分布图。从图5的累计分布可以看出,稀释倍数最佳时,颗粒集中在1~3 μm的区间内,没有大颗粒的出现。图6为成核实验结束后的草酸铈的扫描电镜图。由图6可以看出,最佳Sn时,草酸铈颗粒为单分散颗粒,多数粒径尺寸为2~3 μm。最佳Sn时,稀释液中的过饱和度较小,生成的晶核既不发生溶解,也不发生聚集,可以认为草酸铈颗粒个数即为成核管中生成的晶核个数。
0.750 mol/L硝酸+0.100 mol/L草酸

c0(Ce3+),mol/L:■——0.357,●——0.167

Sn=1.69

Sn=1.69
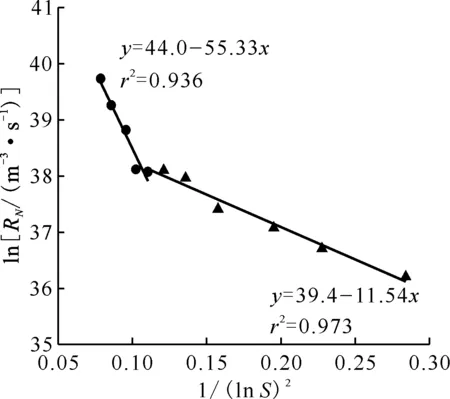
3.2.2成核动力学方程的确定 25 ℃时,过饱和比S在6.53~35.5范围内,考察了过饱和比对初级成核速率的影响,结果示于图7。由图7可以看出,初级成核速率相对于1/(lnS)2的点拟合为两条直线,S大于20.3时,过饱和比较大,初级成核速率相对于1/(lnS)2的直线倾斜角较大,草酸铈成核机制为均相成核[18],成核动力学参数AN为1.32×1019/(m3·s),BN为55.3,总的成核动力学方程为RN=1.32×1019·exp[-55.3/(lnS)2],校正决定系数为0.936;S小于20.3时,过饱和比较小,倾斜角较小,草酸铈成核机制为异相成核,成核动力学参数AN为1.28×1017/(m3·s),BN为11.5,总的成核动力学方程为RN=1.28×1017·exp[-11.5/(lnS)2],校正决定系数为0.973。对比已经报道的采用连续稳态法测得的草酸铈成核动力学方程[9]:RN=3.01×108·Δc1.65,可以看出,本研究直接测量得到的初级成核速率远大于基于粒数衡算方程推算得到的数据。这是因为粒数衡算模型方程求解的初级成核速率与结晶器结构、搅拌桨形状、搅拌强度等操作条件有关,为特定沉淀条件下的结晶动力学数据,且MSMPR结晶器中微观混合效果不如本实验所用装置,而粒数衡算方程的求解过程中忽略了团聚的影响。
▲——异相成核,●——均相成核25 ℃,稀释液:0.750 mol/L硝酸+0.100 mol/L草酸+2 g/L明胶
3.2.3温度对成核动力学的影响 考察了25~50 ℃时,不同温度对成核动力学的影响,结果示于图8。由图8可得:均相成核的指前影响因子AN0为3.86×1030/(m3·s),活化能Ea为67.4 kJ/mol;异相成核的指前影响因子AN0为3.10×1020/(m3·s),活化能Ea为19.1 kJ/mol。即均相成核速率方程为:RN=3.86×1030·exp[-67.4×103/RT]·exp[-55.3/(lnS)2];异相成核速率方程为:RN=3.10×1020·exp[-19.1×103/RT]·exp[-11.5/(lnS)2]。由成核速率方程可以看出,温度升高,成核速率加快。

稀释液:0.750 mol/L硝酸+0.100 mol/L草酸+2 g/L明胶(a)——异相成核,0.133 mol/L硝酸铈+0.500 mol/L硝酸,0.700 mol/L草酸;(b)——均相成核,0.333 mol/L硝酸铈+1.100 mol/L硝酸,0.400 mol/L草酸
3.3 草酸铈生长动力学
3.3.1生长动力学方程的确定 生长过程中,溶液中Ce3+浓度(ct(Ce3+))随着时间的增加逐渐降低,典型图例示于图9。图10给出了一个典型的草酸铈生长实验前后的粒度分布,草酸铈晶种从9.15 μm 生长至28.97 μm。在25 ℃时,考察了相对过饱和度对晶体生长速率的影响,结果示于图11。通过最小二乘法求解生长动力学参数,kg为3.94×10-9m/s,g为2.09,总的生长速率方程为:G(t)=3.94×10-9·δ2.09(t),校正决定系数为0.978,G的单位为m/s。根据晶体扩散理论,生长动力学方程的指数近似等于2,这说明了草酸铈的生长过程主要由界面反应过程控制[19]。
3.3.2温度对生长动力学的影响 考察了25~50 ℃时不同温度对生长动力学的影响,lnkg0相对于1/T的变化示于图12。由图12可得:kg0=4.81×105m/s,活化能Ea为80.3 kJ/mol,即kg=4.81×105·exp[-80.3×103/RT],校正决定系数为0.981。草酸铈晶体生长速率方程为:G(t)=4.81×105·exp[-80.3×103/RT]·δ2.09(t)。由生长速率方程可以看出,随着温度的升高,草酸铈晶体的生长速率增大。结合草酸铈成核动力学方程,在反应结晶的过程中,成核速率和晶体生长速率均随温度的升高而增大,但生长速率的温度系数大于成核速率的温度系数,随温度的升高晶体生长速率增大更快。因此,在一定温度范围内,升高温度有利于得到粒度较大的晶体。这一结果与文献[20]中报道的实验现象一致。

图9 Ce3+浓度随时间变化的典型图例

●——反应0 s,▲——反应240 s

25 ℃,0.400 mol/L硝酸铈+0.300 mol/L硝酸;0.800 mol/L草酸;稀释液:0.750 mol/L硝酸+0.100 mol/L草酸

0.200 mol/L硝酸铈+0.900 mol/L硝酸;0.500 mol/L草酸;稀释液:0.750 mol/L硝酸+0.100 mol/L草酸
3.4 草酸铈成核和晶体生长的XRD分析
图13为草酸铈成核及晶体生长实验结束后晶体颗粒的XRD图。由图13可知,10°~30°的主要衍射峰与Ce2(C2O4)3·10H2O的标准图谱(20-0268)出峰位置相匹配,但XRD图谱中还有部分吸收峰未能解析,因此推断制备的样品为含有结晶水的草酸铈。
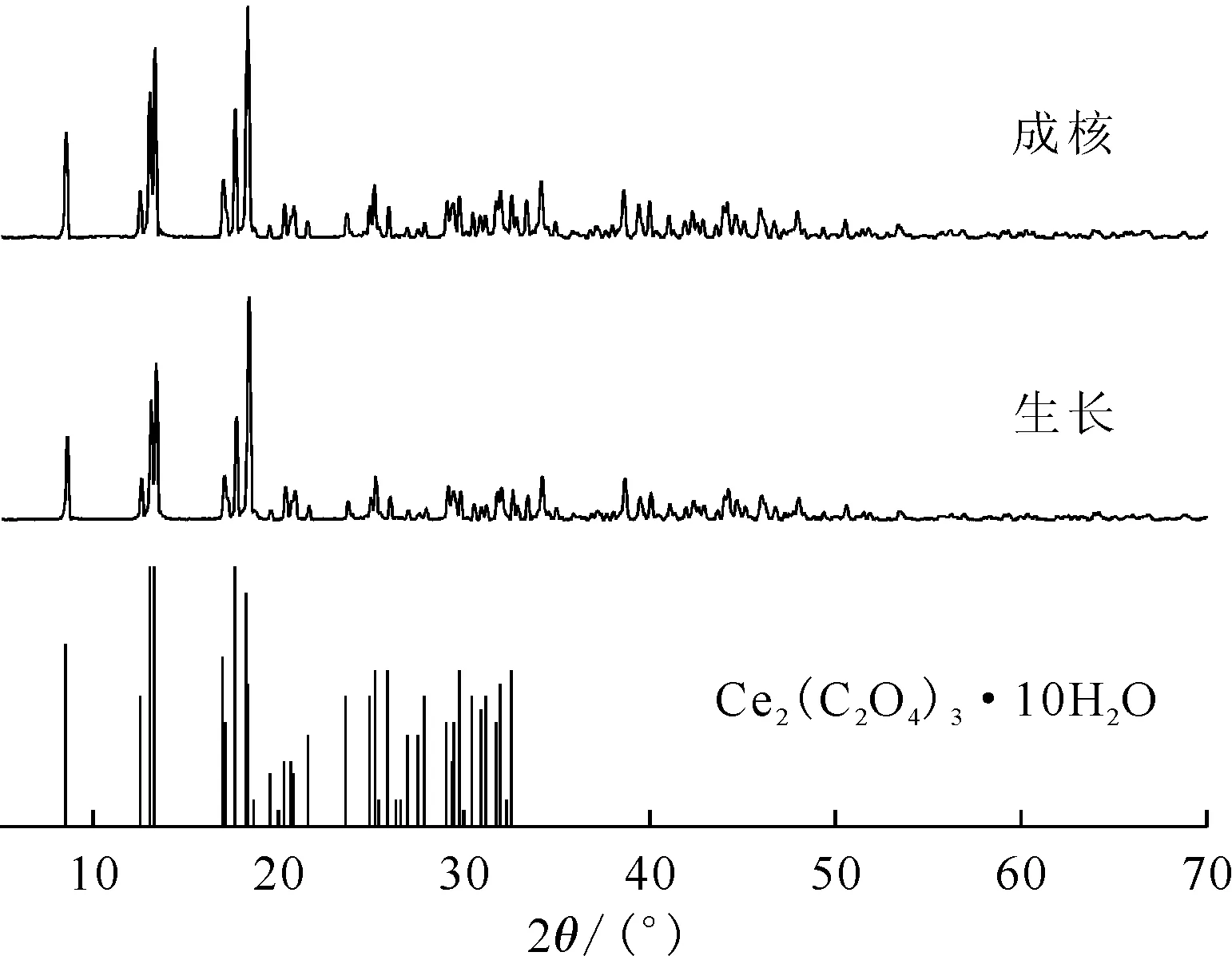
图13 草酸铈样品的XRD图
4 结 论
(1) 提出了测量草酸盐成核动力学时稀释倍数的计算方法,该方法有效地应用于草酸铈成核速率的测定,草酸铈的最佳Sn=1.65时,保证了成核速率测量的准确性。
(2) 在较宽的温度和反应试剂浓度变化范围内,测定了草酸铈成核动力学方程。S大于20.3时,高过饱和比草酸铈成核机制为均相成核;S小于20.3时,低过饱和比草酸铈成核机制为异相成核。
(3) 测定了草酸铈晶体生长动力学方程,草酸铈的晶体生长主要由界面反应过程控制。在一定温度范围内,随温度的升高,晶体生长速率相比成核速率增大较快,有利于得到粒度较大的晶体。
