黄钾铁矾的制备及其对U(Ⅵ)的吸附
2021-09-07魏红福董发勤刘明学陈木兰
魏红福,董发勤,刘明学,张 伟,何 苗,陈木兰
1.中国工程物理研究院 激光聚变研究中心,四川 绵阳 621900;2.西南科技大学 生命科学与工程学院,四川 绵阳 621010;3.固体废物处理与资源化教育部重点实验室,四川 绵阳 621010;4.西南科技大学 分析测试中心,四川 绵阳 621010
铀是一种天然的放射性元素,常被用于各种民用和军事项目。在铀矿的开采、提炼、加工和偶发事故中,会对水体和土壤等环境造成铀的放射性污染[1]。铀的半衰期非常长,如235U的半衰期为7.04亿年,238U的半衰期长达44.68亿年,一旦发生污染就会在环境中长期存在。铀可以通过口、鼻和皮肤进入人体,对人类健康构成了长期的潜在风险,包括辐射危害、生物动力学毒性、代谢毒性和化学毒性等。这些危害对哺乳动物的繁殖和发育造成严重损害,包括生育能力下降、胚胎发育异常和癌症等[2-4]。近十年来,开发铀污染环境的修复技术引起了人们的极大关注和广泛研究,报道了多种修复方法,包括物理-化学法[5-6](吸附、沉淀、离子交换和膜分离等)、微生物法[7]、植物法[8]等,其中吸附法作为一种简单、高效的分离方法引起了人们广泛的研究。
黄钾铁矾(KFe3(SO4)2(OH)6)作为一种含铁硫酸盐的次生矿物,主要形成于酸性、富含硫的自然环境中,这些环境包括由含黄铁矿的沉积物形成的酸性硫酸盐土壤、硫化矿床风化带、酸性高盐湖泊沉积物、酸矿废水区域、黄铁矿煤矸石的风化场地等[9]。在冶金工业上,湿法炼锌除铁工艺也会产生大量黄钾铁矾废弃物[10]。黄钾铁矾这种次生矿物长时间未得到有效的开发利用,直到近年来人们发现其具有较高的比表面积和较多的表面羟基,是一种优良的吸附材料,而且其晶体结构中多个晶体化学位置都能被其它元素取代,形成广泛的类质同象。基于这些特性,黄钾铁矾能够将有毒、有害元素以共沉淀或吸附的方式固定起来,从而减轻对环境的危害。因此,现在黄钾铁矾广泛用于含As(Ⅴ)、Cr(Ⅵ)、Cu(Ⅱ)、Hg(Ⅱ)和Tl(Ⅰ)等有毒元素废水的处理[11-18],但是却鲜有其用于含铀废水处理的报道。
本工作拟选取黄钾铁矾作为吸附剂,研究其对U(Ⅵ)吸附过程中的影响因素、吸附动力学和吸附等温线,探讨黄钾铁矾对U(Ⅵ)的吸附机理,并比较两种制备方式获得的材料在吸附性能上的差异,以期为铀污染废水的处理提供一种廉价的吸附材料。
1 材料与方法
1.1 材料和仪器
所用试剂均为市售分析纯,其中硝酸铀酰(UO2(NO3)2·6H2O)和偶氮胂Ⅲ(C22H18As2N4O14S2)购买自Sigma-Aldrich公司。
Alpha-1500紫外可见光分光光度计,上海谱元仪器有限公司;X Pert pro X射线衍射仪,荷兰帕纳科;Ultra55高分辨冷场发射扫描显微镜(SEM)分析系统,带有Oxford ie 450x-max 80能量色散X射线光谱仪(energy-dispersive X-ray spectrometer, EDS),德国Carl Zeiss公司;Spectrum One红外吸收光谱仪,美国PE公司;In Via激光拉曼光谱仪,英国Renishaw公司;85-2控温磁力搅拌器,江苏金怡仪器科技有限公司。
1.2 实验方法
1.2.1U(Ⅵ)储备液的配制 称取2.11 g硝酸铀酰,用少量去离子水溶解后,加入10 mL浓HNO3,转移至1 000 mL容量瓶中,用去离子水定容,摇匀,即得4.2 mmol/L的U(Ⅵ)储备液。使用前,用去离子水稀释至所需浓度即可。U(Ⅵ)在不同pH值水溶液中的形态分布采用Visual MINTEQ软件(3.0版)计算[19]。
1.2.2黄钾铁矾的制备及表征 水热法制备黄钾铁矾:称取5.60 g KOH、17.20 g Fe2(SO4)3·5H2O 溶于100 mL去离子水中,加入聚四氟乙烯反应器中,在带有搅拌及螺旋冷凝器的油浴加热器上,于95 ℃下搅拌回流4 h,然后将溶液在室温下再静置20 h,过滤收集沉淀,用去离子水洗涤3次,然后于60 ℃条件下干燥24 h备用[9,13,20]。黄钾铁矾的生物制备方法参照文献[21]进行。水热法合成的黄钾铁矾采用X射线衍射(XRD)、扫描电子显微镜、拉曼光谱和傅里叶变换红外光谱等方法进行表征。
1.2.3吸附动力学实验 固液比(m/V)为1.0 g/L,U(Ⅵ)的初始浓度为0.42 mmol/L,溶液pH值分别为5.0、6.0和7.0,298 K时,置于磁力搅拌器上搅拌。吸附过程中定时用注射器取样,样品液用直径为0.22 μm的超滤膜过滤,收集滤液,用偶氮胂Ⅲ法测定滤液中U(Ⅵ)的浓度[19]。每组实验均做3组平行实验。采用准一级动力学和准二级动力学对实验数据进行拟合分析,研究吸附过程的机理。准一级和准二级动力学方程分别如式(1)、(2)[22-23]。
ln(qe-qt)=lnqe-k1t
(1)
(2)
式中:qe和qt分别为吸附达到平衡时和t时刻的吸附量,mg/g;k1为准一级动力学速率常数,min-1;k2为准二级动力学速率常数,g/(mg·min)。
1.2.4吸附条件实验 称取一定量的黄钾铁矾加入石英玻璃槽中,然后加入一定体积4.2 mmol/L的硝酸铀酰溶液,用0.17 mol/L的NaCl溶液定容至80 mL,用0.10 mol/L的HCl或NaOH溶液调节溶液的pH值,将配制好的溶液置于磁力搅拌器上搅拌,考察吸附时间、固液比、U(Ⅵ)初始浓度、溶液pH值和离子强度等因素对吸附过程的影响。取样,过滤,测定滤液中的U(Ⅵ)浓度。平衡吸附量(qe,mg/g)的计算方法如式(3)。
(3)
式中:c0和ce分别为溶液中U(Ⅵ)的初始和平衡浓度,mmol/L;V为溶液总体积,L;m为吸附剂质量,g。U(Ⅵ)去除率(R)的计算方法如式(4)。
(4)
式中:c0和ct分别为溶液中U(Ⅵ)的初始浓度和吸附过程中t时刻的浓度,mmol/L。
1.2.5等温吸附实验 固液比为1.0 g/L,溶液pH值分别为5.0、6.0、7.0,298 K时,配制不同初始浓度的U(Ⅵ)溶液,搅拌吸附24 h,过滤,测定滤液中的U(Ⅵ)浓度。采用Langmuir和Freundlich两种等温模型对实验数据进行拟合,Langmuir模型如式(5),Freundlich模型如式(6)[24-25]。
(5)
(6)
式中:qm为最大吸附量,mg/g;KL为Langmuir模型的平衡吸附常数,L/mg;KF为Freundlich模型常数,mg/g;n为吸附强度相关常数。
2 结果与讨论
2.1 黄钾铁矾的表征

2.2 吸附动力学
在固液比(m/V)为1.0 g/L,U(Ⅵ)初始浓度为0.42 mmol/L,溶液pH分别为5.0、6.0和7.0的条件下,对黄钾铁矾吸附U(Ⅵ)随时间的变化进行了研究,结果示于图2。由图2可知:不同pH条件下,黄钾铁矾对U(Ⅵ)的吸附均可分为两个阶段:0~20 min为快速吸附阶段,20 min内的吸附量达到平衡吸附量的76%以上;20 min以后为慢速吸附阶段。在100 min之内,所有的吸附过程基本均能达到平衡。在溶液pH值为5.0、6.0和7.0的条件下,达到平衡时的吸附量分别为(57.3±1.6)、(76.4±1.5)、(88.8±1.6) mg/g(n=3)。
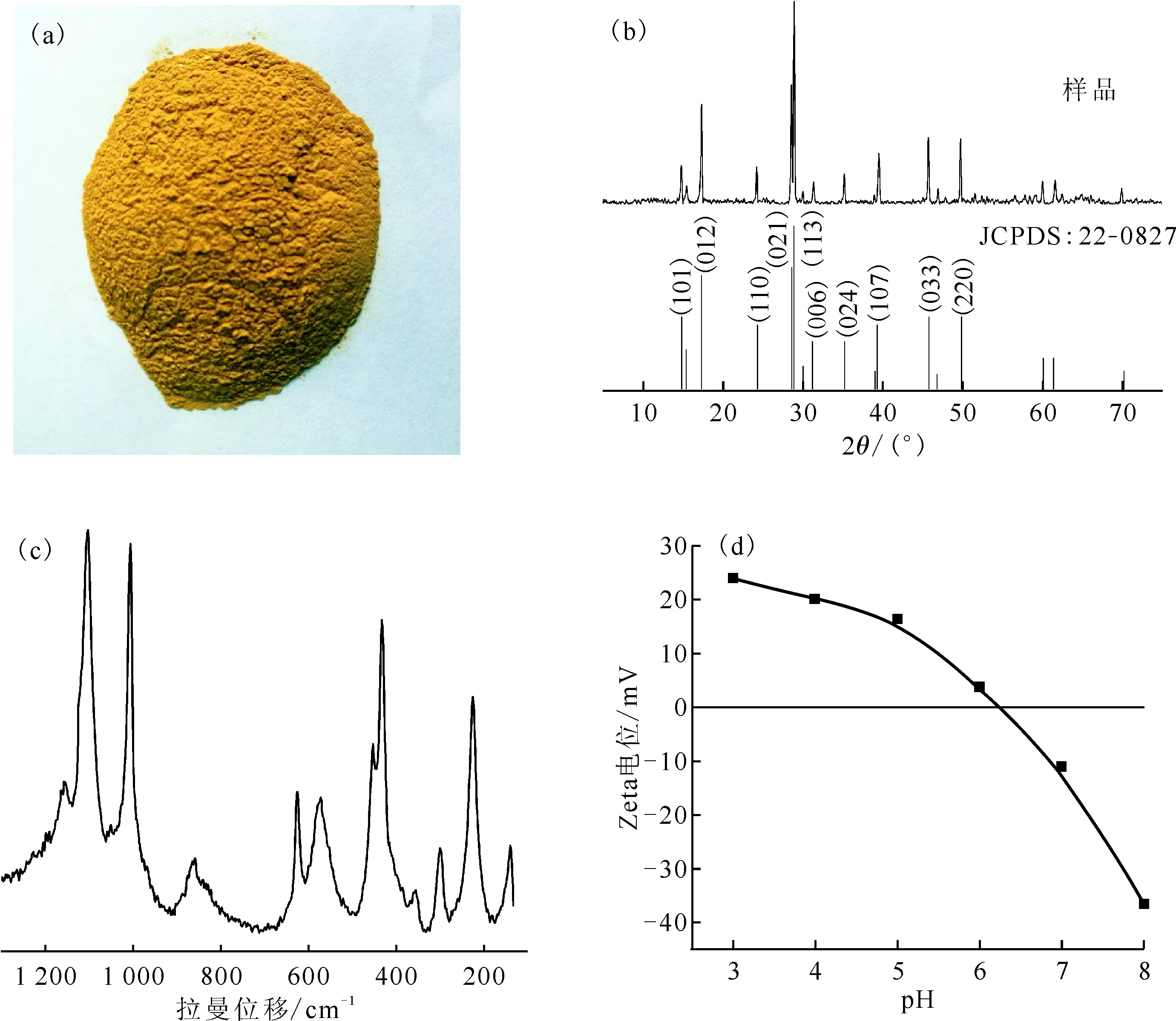
图1 黄钾铁矾的外观(a)、XRD图(b)、Raman光谱(c)和Zeta电位(d)
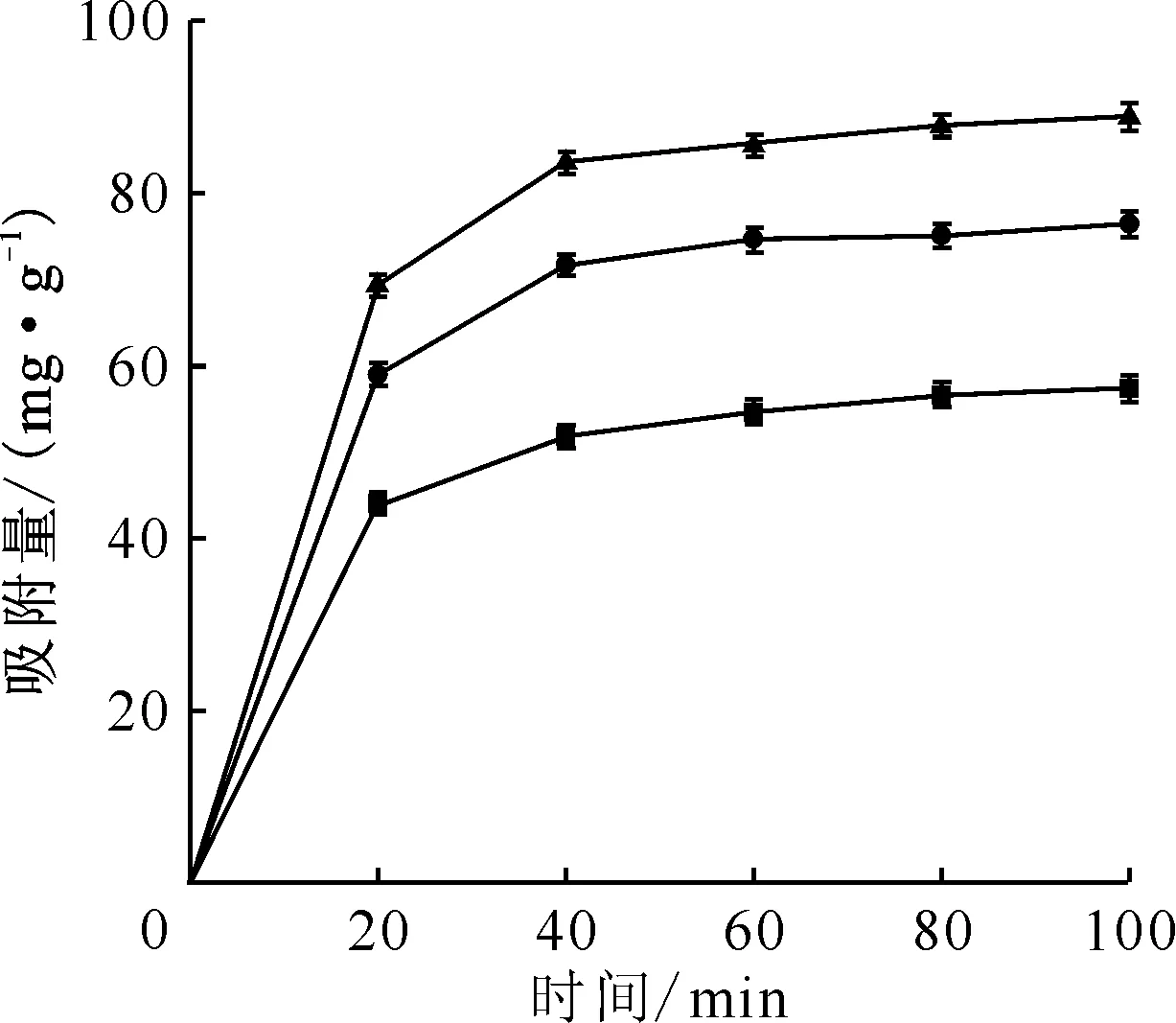
c0(U(Ⅵ))=0.42 mmol/L,m/V=1.0 g/L,c0(NaCl)=0.17 mol/L,T=298 K;pH:■——5.0,●——6.0,▲——7.0
将图2中的实验数据分别采用准一级动力学方程和准二级动力学方程进行线性拟合,分别以ln(qe-qt)和t/qt为纵坐标,时间为横坐标作图,拟合结果示于图3,拟合参数列入表1。准一级动力学拟合结果表明,除pH=5.0外,其它两种pH条件下的拟合相关性系数(r2)均较低,并且吸附量的理论计算值(qcal)与实验测定值(qexp)相差较大,最大的差值达到36%,这表明准一级动力学方程不适合用来拟合该吸附过程。用准二级动力学方程拟合三种pH条件下黄钾铁矾吸附U(Ⅵ)的实验数据,其线性相关系数均在0.99以上,而且吸附量的理论计算值与实验值接近,误差在5%以内,拟合程度较好。因此,黄钾铁矾对U(Ⅵ)的吸附更符合准二级动力学模型,表明吸附过程受化学作用力支配,整个吸附过程中化学吸附占主导作用[30-33]。
2.3 黄钾铁矾对U(Ⅵ)的吸附
吸附过程受到体系中很多因素的影响,包括溶液pH值、离子强度、固液比和U(Ⅵ)初始浓度等,结果示于图4。

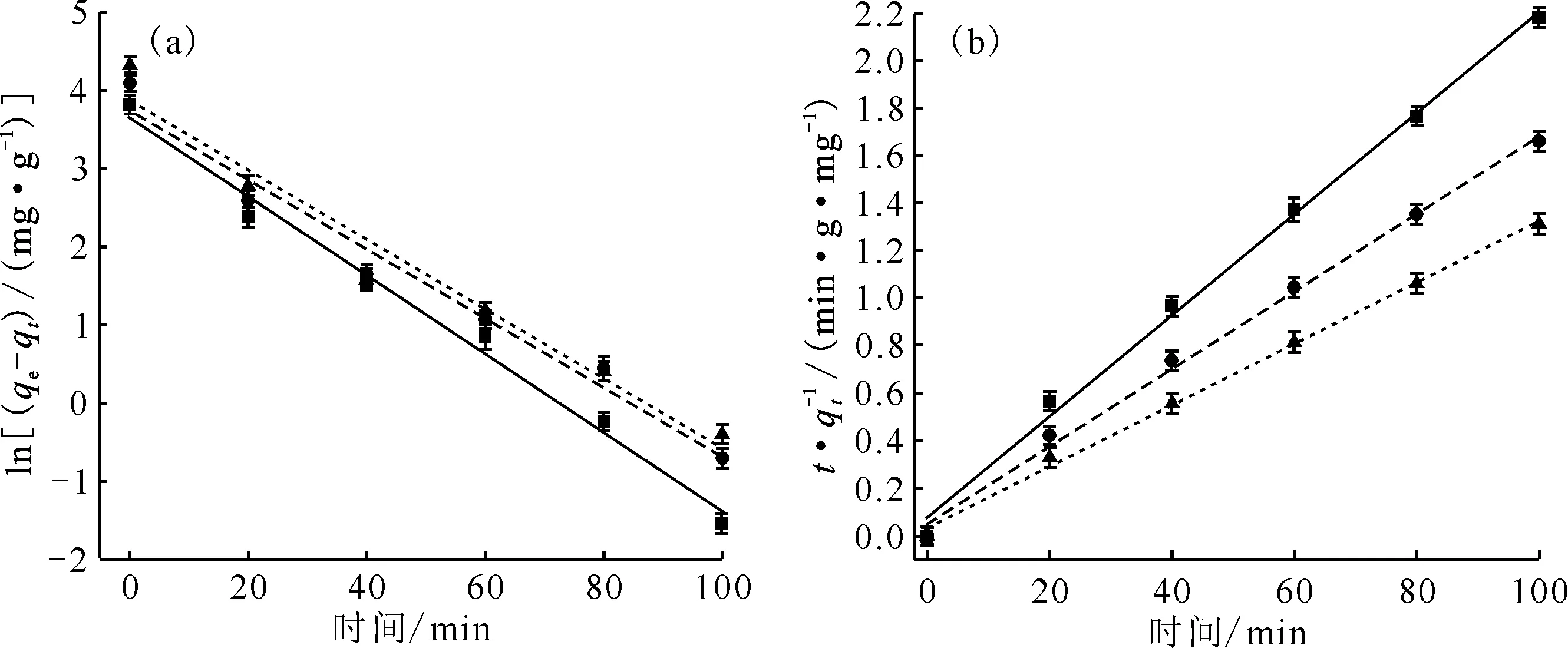
(a):pH:■——5.0,y=-0.051x+3.670,r2=0.986;●——6.0,y=-0.044x+3.752,r2=0.969;▲——7.0,y=-0.045x+3.883,r2=0.952;(b):pH:■——5.0,y=0.021x+0.078,r2=0.996;●——6.0,y=0.016x+0.051,r2=0.997;▲——7.0,y=0.013x+0.035,r2=0.998

表1 黄钾铁矾吸附U(Ⅵ)的动力学模型拟合参数
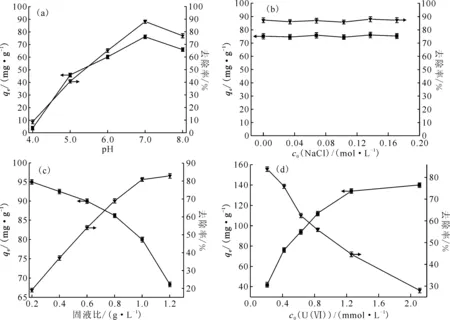
T=298 K,t=100 min(a)——c0(U(Ⅵ))=0.42 mmol/L,c0(NaCl)=0.17 mol/L,固液比为1.0 g/L;(b)——c0(U(Ⅵ))=0.42 mmol/L,pH=7.0,固液比为1.0 g/L;(c)——c0(U(Ⅵ))=0.42 mmol/L,pH=7.0,c0(NaCl)=0.17 mol/L;(d)——pH=7.0,c0(NaCl)=0.17 mol/L,固液比为1.0 g/L
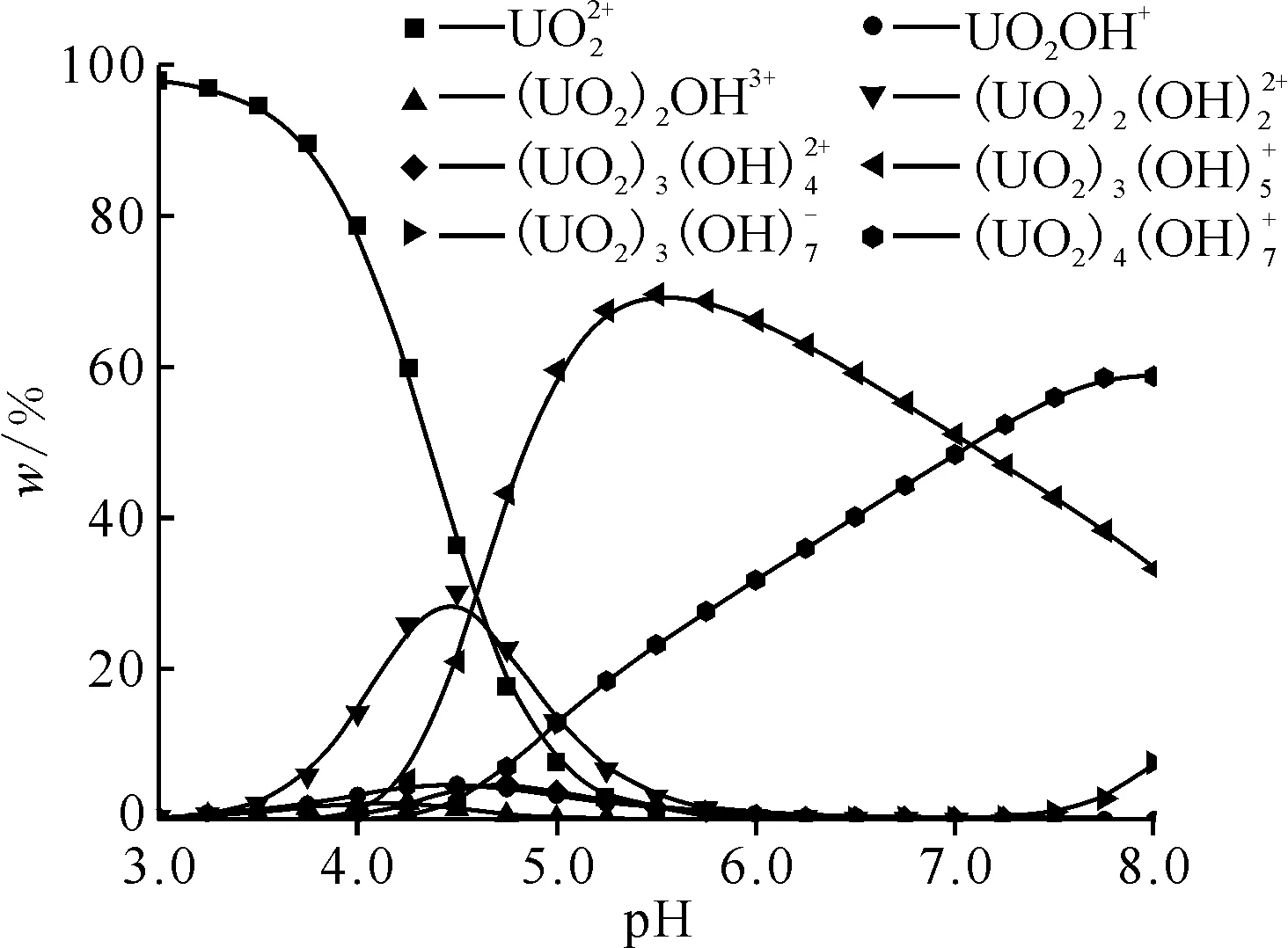
c0(U(Ⅵ))=0.21 mmol/L,c0(NaCl)=0.17 mol/L,T=298 K
固液比对吸附的影响示于图4(c)。由图4(c)可知:随着固液比的增加,吸附量逐渐减小,去除率逐渐增大;当固液比较低时,吸附位点较少,溶液中有足够的U(Ⅵ),能够达到饱和吸附,所以吸附量较高;而当固液比增大时,吸附位点增加,溶液中的U(Ⅵ)不能使吸附剂完全达到饱和吸附,导致吸附量降低[35]。当固液比达到1.0 g/L时,平衡吸附量达到(80.0±1.3) mg/g(n=3),去除率达到(81.0±1.0)%,当固液比超过1.0 g/L时,去除率只有少量增加,因此固液比选择1.0 g/L较为适宜。U(Ⅵ)初始浓度对吸附的影响示于图4(d)。由图4(d)可知:当U(Ⅵ)浓度从0.21 mmol/L增加到2.1 mmol/L时,固液相之间的浓度差增大,U(Ⅵ)与黄钾铁矾之间的相互作用增强,使黄钾铁矾对U(Ⅵ)的吸附量增大,平衡吸附量从(42.0±2.5) mg/g增加到(140±2.3) mg/g。当溶液中U(Ⅵ)的初始浓度增大到2.1 mmol/L时,平衡吸附量趋于稳定,去除率随着U(Ⅵ)浓度的增大而逐渐减小,这是由于溶液中有大量的U(Ⅵ),吸附位点都达到饱和吸附所致[34-35]。
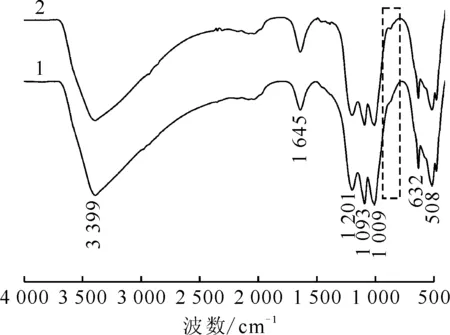
1——黄钾铁矾,2——黄钾铁矾+U(Ⅵ)

黄钾铁矾吸附U(Ⅵ)前后的SEM图谱及EDS图谱示于图7。由图7可知:黄钾铁矾呈花瓣状簇型,且有晶体团聚现象,表面比较粗糙,颗粒尺寸在2~10 μm[47-48];该矿物主要组成元素为Fe、K、O和S;黄钾铁矾与U(Ⅵ)作用后表面形貌没有发生改变,部分物质沉淀在其表面,使表面变得更为粗糙,能谱分析表明其表面含有U元素。黄钾铁矾吸附U(Ⅵ)之后的XRD图谱(图8)也证实了黄钾铁矾表面存在U的物相。
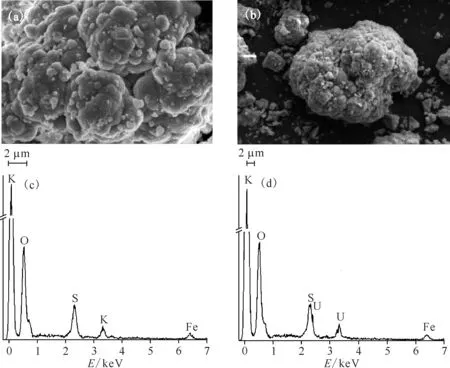
(a)、(c)——吸附前,(b)、(d)——吸附后

图8 黄钾铁矾吸附U(Ⅵ)的XRD
2.4 吸附等温线
在固液比为1.0 g/L,溶液pH分别为5.0、6.0和7.0,U(Ⅵ)初始浓度范围为0.21~1.68 mmol/L,298 K的条件下,对U(Ⅵ)的等温吸附过程进行了研究,结果示于图9。从图9可以看出,随着U(Ⅵ)初始浓度的增大,固液相之间的浓度差随之增大,导致U(Ⅵ)与黄钾铁矾之间相互作用增强,从而使平衡吸附量不断增大。黄钾铁矾对U(Ⅵ)的吸附受到溶液的pH值影响,溶液pH为5.0~7.0时,达到平衡时吸附量分别为(63.3±2.3)、(123±2.2)和(140±2.4) mg/g。
采用Langmuir和Freundlich模型对图9中的实验数据进行线性拟合,分别以ce/qe-ce、lnqe-lnce作图,拟合曲线示于图10。根据曲线斜率和截距计算等温模型的相关参数,结果列入表2。由表2可知:Langmuir模型的相关系数大于Freundlich模型的相关系数,并且均在0.99以上,通过Langmuir模型计算的平衡吸附量与实验值接近,而Freundlich模型的平衡吸附量计算值与实验值的差值要大一些,这表明黄钾铁矾对U(Ⅵ)的吸附更符合Langmuir模型,即黄钾铁矾对U(Ⅵ)的吸附是单层吸附[33]。在溶液pH值为5.0、6.0和7.0的条件下,通过Langmuir模型计算的最大吸附量(qm)分别为77.7、141、154 mg/g。表3为黄钾铁矾与其它文献报道的相关吸附材料的对比,表中列出了实验条件和最大吸附量等相关数据。结果表明,在实验条件下,黄钾铁矾对U(Ⅵ)的最大吸附量高于大多数相关吸附材料的值,虽然CTAB-MT对U(Ⅵ)的最大吸附量高于黄钾铁矾,但其制备工艺较复杂,成本较高,综合来看,黄钾铁矾是理想的U(Ⅵ)吸附材料。

m/V=1.0 g/L,c0(NaCl)=0.17 mol/L,t=100 min,T=298 KpH:■——5.0,●——6.0,▲——7.0

pH:■——5.0,●——6.0,▲——7.0

表2 黄钾铁矾吸附U(Ⅵ)的Langmuir和Freundlich等温拟合参数
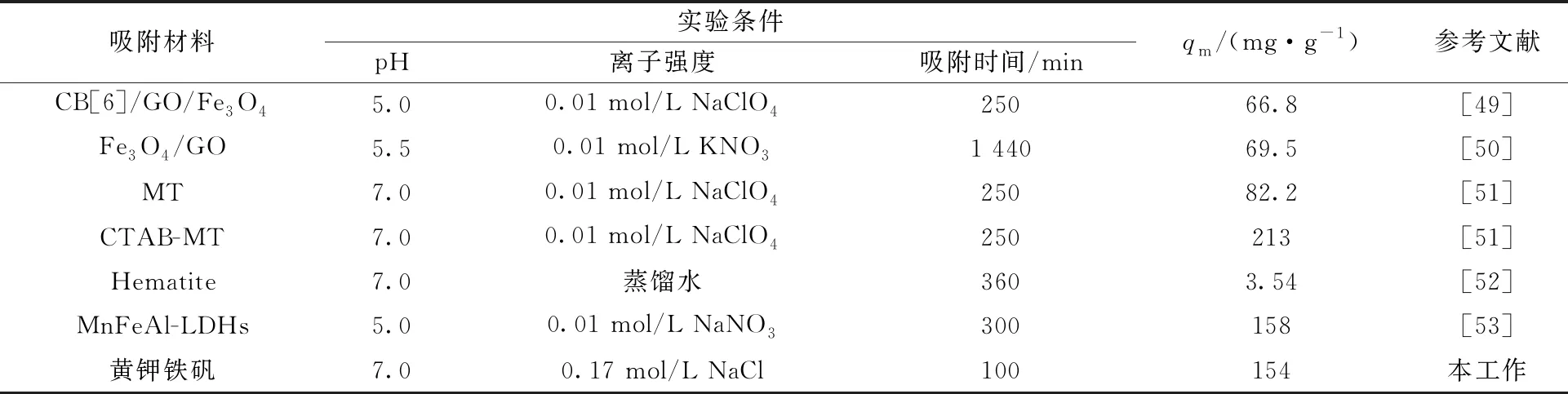
表3 不同吸附材料对U(Ⅵ)吸附能力的对比
2.5 黄钾铁矾制备方式对U(Ⅵ)吸附的影响
不同合成途径获得的黄钾铁矾的物理和化学性质存在较大差异,包括表面形貌、溶解速率、比表面积和结晶度等,这些性质差异对吸附有强烈的影响[54]。对比了通过生物法和水热法两种方式获得的黄钾铁矾对U(Ⅵ)的吸附,结果示于图11。由图11可知,在所有条件下,生物法制备的黄钾铁矾对U(Ⅵ)的去除率均高于水热法制备的黄钾铁矾,在pH=7.0时,去除率达到最大,生物法与水热法制备的黄钾铁矾对U(Ⅵ)的去除率分别为(93.2±1.4)%和(88.0±1.2)%。吸附的差异主要与黄钾铁矾的表面形貌和比表面积等性质相关,生物法制备黄钾铁矾的比表面积为12.6 m2/g,颗粒堆积较为疏松,孔径较大,而水热法制备的黄钾铁矾的比表面积为4.8 m2/g,颗粒堆积致密,孔径较小。该结果与Ahoranta等[54]和Paikaray等[55]报道的结果一致。
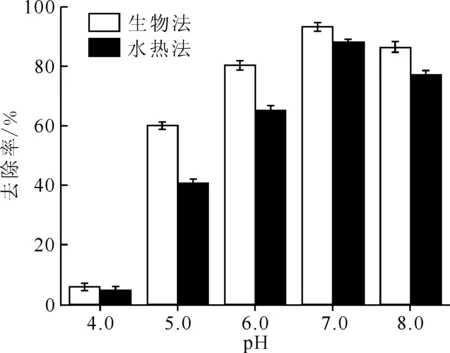
c0(U(Ⅵ))=0.42 mmol/L,m/V= 1.0 g/L,c0(NaCl)=0.17 mol/L,t=100 min,T=298 K
3 结 论
(1) 采用水热法合成了黄钾铁矾,通过XRD、Raman光谱等方法证实其为黄钾铁矾。
(2) 黄钾铁矾对U(Ⅵ)具有较强的吸附能力,最佳吸附条件为:固液比1.0 g/L、U(Ⅵ)初始浓度为0.42 mmol/L、298 K、pH=7.0,达到平衡时的吸附量为(76.0±1.4) mg/g(n=3),去除率达到了(88.0±1.3)%(n=3)。
(3) 动力学分析表明,黄钾铁矾对U(Ⅵ)的吸附符合准二级动力学模型。等温线拟合表明,黄钾铁矾对U(Ⅵ)的吸附过程符合Langmuir模型,说明黄钾铁矾对U(Ⅵ)的吸附是单层吸附。
(4) 生物法制备的黄钾铁矾结构较疏松,比表面积更大,其对U(Ⅵ)的去除率优于水热法制备的黄钾铁矾。
