基于HPLC的大黄居群蒽醌类成分含量测定及品质评价研究
2021-09-06朱红红侯小琪王戌梅
朱红红,侯小琪,张 淼,周 涛,冯 力,王戌梅, 2*
基于HPLC的大黄居群蒽醌类成分含量测定及品质评价研究
朱红红1,2,侯小琪3,张 淼4,周 涛1,冯 力1,王戌梅1, 2*
1. 西安交通大学药学院,陕西 西安 710061 2. 陕西省中医药管理局七药资源及抗肿瘤重点实验室,陕西 西安 710061 3. 贵阳药用植物园,贵州 贵阳 5500022 4. 礼县春天药业有限责任公司,甘肃 陇南 742200
以采自11个省共27个居群的大黄et药材的根为研究对象,测定其总蒽醌及5个游离蒽醌成分的含量,为大黄的道地性形成研究提供参考。采用赛分RP-C18液相色谱柱(Amethyst C18-H,250 mm×4.6 mm,5 μm),以甲醇-0.1% 磷酸水(85︰15)溶液为流动相,体积流量1 mL/min,柱温30℃,检测波长为254 nm。利用主成分分析(principal components analysis,PCA)、偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)、正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)及聚类分析等方法对含量测定结果进行分析。所选取的大黄药材均达到了《中国药典》2020年版规定的总蒽醌及5个游离蒽醌的含量标准,根据蒽醌成分含量差异可将不同居群的大黄划分为2大类,并与大黄传统的道地产区和非道地产区相吻合。芦荟大黄素、大黄素及大黄酸的含量在2组之间具有显著性差异,表现为道地产区的含量显著高于非道地产区。不同产地的大黄蒽醌含量存在明显差异,蒽醌含量可作为评价大黄的道地性指标。
大黄;蒽醌类;芦荟大黄素;大黄素;大黄酸;品质评价;地理分布;指纹图谱
中药材品质评价的根本在于分析其化学成分含量并构建化学成分指纹图谱,建立药材质量与化学成分之间的相关性。中药材大多来源于植物物种,物种的基本组成单位是居群,药材的质量差异也就体现为不同居群的药用植物所含化学成分的差异。道地药材也即种内的某些特异居群[1]。因此,对不同居群的药材原植物的化学成分进行研究,有助于阐明不同产地药材的品质差异,并为道地药材的质量评价提供参考标准。
大黄是我国传统的大宗药材之一,具有泻下攻积、清热泻火、凉血解毒等功效[2]。大黄的基原植物为蓼科(Polygonaceae)大黄属Linn. 植物掌叶大黄Linn.、唐古特大黄(Maxim. ex Regel) Maxim. ex Balf或药用大黄Baill,以上植物的干燥根及根茎入药即为中药大黄。课题组前期基于大黄原植物的叶片分裂程度、地理分布格局和ISSR分子标记的研究结果表明,大黄原植物的3个种是不成立的,应当作为一个物种[3-6]。基于SSR分子标记、少数几个核基因以及简化基因组的研究结果进一步表明,大黄原植物遗传变异的地理分布格局可划分为东、西2大支,分别对应传统的非道地产区和道地产区[7-10]。大黄含有蒽醌类、二蒽酮类、鞣质及多糖等多类药效活性成分,其中的蒽醌类是研究最多的活性成分,具有广泛的药理作用。大黄中的蒽醌类主要分为游离型和结合型[11],其中的游离型蒽醌如大黄酸、大黄素具有抗肿瘤、抗炎、抗菌及调节肾功能等作用[12-13];结合型蒽醌如大黄酸苷、大黄素甲醚苷具有抗肿瘤、解毒、消痈等作用[14-15]。大黄的质量控制一般以蒽醌类成分的含量为标准,如《中国药典》2020年版将大黄中的总蒽醌及5个游离蒽醌的含量作为大黄质量控制的指标[2]。
大黄原植物在我国分布范围较广,主要分布于山西、宁夏、甘肃、青海、西藏、四川、重庆、云南、陕西、河南、湖北11省(自治区或直辖市)。据历代本草记载,四川、甘肃和青海所产大黄的品质多优于其他分布区,为大黄的道地产区[16]。近年来涉及大黄质量分析的研究[17-20]多采用大黄的栽培品种,并没有涉及广泛分布的野生大黄,因此不足以揭示我国大黄资源的品质差异规律。本研究按照《中国药典》2020年版规定的大黄总蒽醌及5个游离蒽醌(芦荟大黄素、大黄酸、大黄素、大黄酚及大黄素甲醚)的含量测定方法,在大黄原植物分布区内采集了27个自然居群进行蒽醌类含量测定,利用主成分分析(principal components analysis,PCA)、偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)及正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)方法对测定的结果进行统计分析,以期找寻我国野生资源大黄主要药效成分的地理分布规律,为大黄的优质种源筛选及质量控制研究提供理论依据。
1 仪器与试药
1.1 仪器
LC-2030C 3D型高效液相色谱仪(日本岛津公司)、S1-M82型中药材高速粉碎机(九阳股份有限公司)、AL204型电子天平(梅特勒-托利多仪器有限公司)、KH-250E型超声波清洗器(昆山禾创超声仪器有限公司)。
1.2 试药
对照品芦荟大黄素(批号110795-201007)、大黄酸(批号110757-200206)、大黄素(批号 110756-200110)、大黄酚(批号 110796-201118)、大黄素甲醚(批号110758-201013)购自中国食品药品检定研究院,质量分数均大于98%。
甲醇(色谱纯和分析纯)和磷酸(分析纯)购自西安科洛化玻仪器有限公司,盐酸(分析纯)购自国药集团化学试剂陕西有限公司,三氯甲烷(分析纯)购自西安安保化工有限责任公司。
本研究所用大黄原植物的根及根茎材料于2017—2019年采集自11个省(自治区或直辖市),经西安交通大学药学院王戌梅教授鉴定,均为中药大黄正品基原植物掌叶大黄Linn.、唐古特大黄(Maxim. ex Regel) Maxim. ex Balf或药用大黄Baill。阴干后粉碎,过四号筛(75目),备用。实验材料信息详见表1。
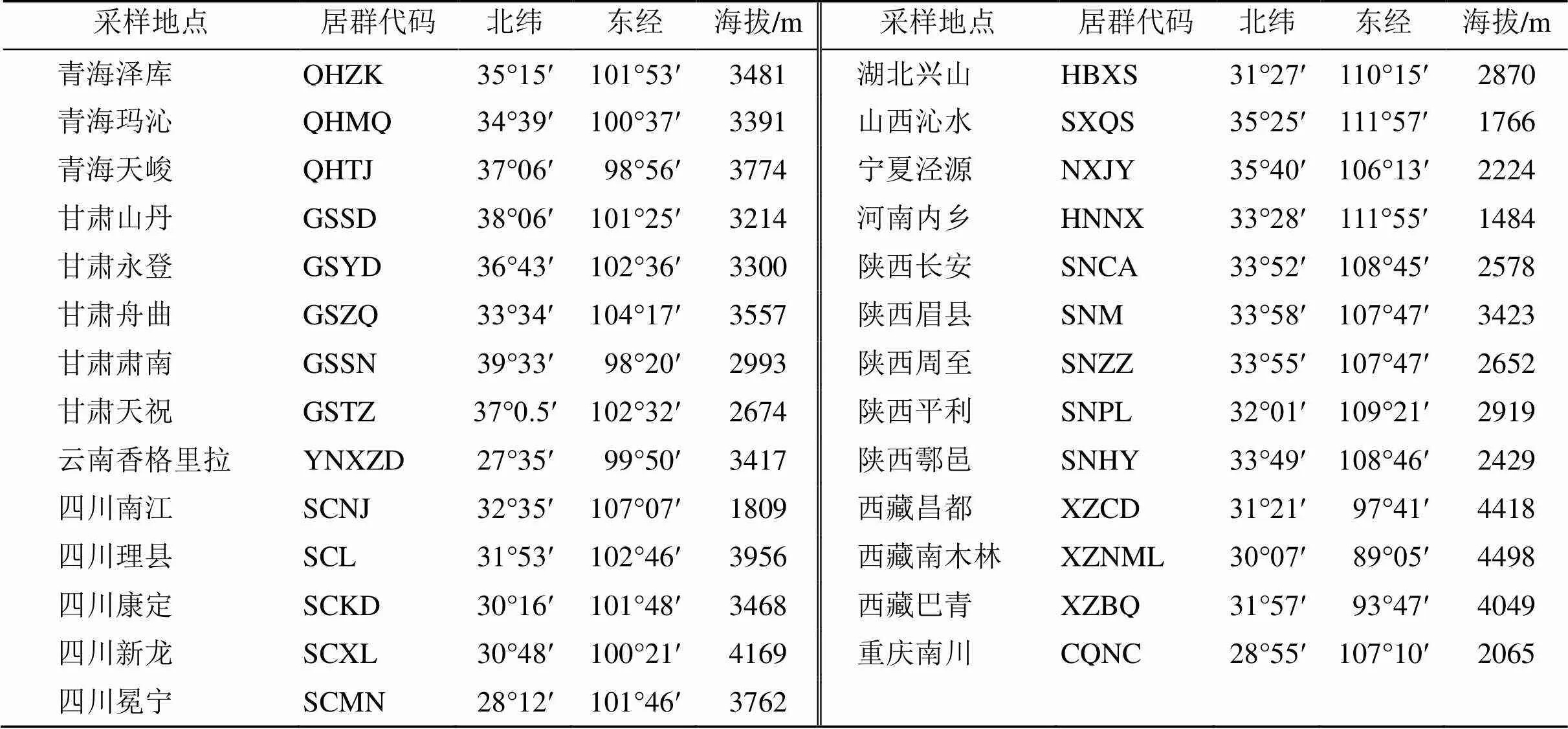
表1 所采集的大黄药材来源信息
2 方法与结果
2.1 混合对照品溶液的制备
精密称取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品适量,加入甲醇溶解,制得芦荟大黄素、大黄酸、大黄素、大黄酚的质量浓度均为16 μg/mL,大黄素甲醚的质量浓度为8 μg/mL的混合对照品溶液。
2.2 供试品溶液的制备
2.2.1 总蒽醌测定的供试品溶液制备 称取过筛(四号筛)后的粉末约0.15 g置锥形瓶中,加入25 mL甲醇,称重后加热回流1 h,置冷,再次称定质量,加甲醇补足损失的质量,摇匀后滤过。精密量取5 mL滤液置烧瓶中,蒸干溶剂,加10 mL 8%盐酸溶液,超声2 min后加三氯甲烷10 mL,加热回流1 h后置分液漏斗中,分取三氯甲烷层。酸液用三氯甲烷提取3次,每次10 mL,合并三氯甲烷液,减压回收溶剂至干,残渣加甲醇溶解后转移至10 mL量瓶中,加甲醇至刻度,摇匀,滤过,取滤液,即得。
2.2.2 5个游离蒽醌测定的供试品溶液制备 称取过筛(四号筛)后的药材粉末约0.5 g置锥形瓶中,加入25 mL甲醇,称定质量后加热回流1 h,置冷,再次称重,用甲醇补足损失的质量,摇匀,滤过,取滤液,即得。
2.3 色谱条件
色谱柱:赛分RP-C18液相色谱柱(Amethyst C18-H,250 mm×4.6 mm,5 μm);流动相为甲醇- 0.1%磷酸水溶液(85∶15);检测波长为254 nm;体积流量为1 mL/min;柱温为30 ℃;进样量为10 μL。以上色谱条件下的混合对照品和样品(GSZQ)色谱图见图1。
2.4 方法学考察
2.4.1 线性关系考察 精密吸取芦荟大黄素对照品溶液2、5、10、20、30、50 μL,其余对照品溶液2、5、10、20、30 μL,按“2.3”项的色谱条件进样,测定峰面积值,以峰面积积分值为纵坐标(),各成分质量浓度为横坐标(),测得5个成分的回归方程及线性范围(表2),结果表明线性关系良好。
2.4.2 精密度考察 将甘肃舟曲的样品(GSZQ)按照“2.2”项方法制得供试品溶液,按“2.3”项的色谱条件重复进样6次,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚峰面积的RSD分别为2.22%、2.43%、1.87%、1.22%、1.87%,表明仪器精密度良好。
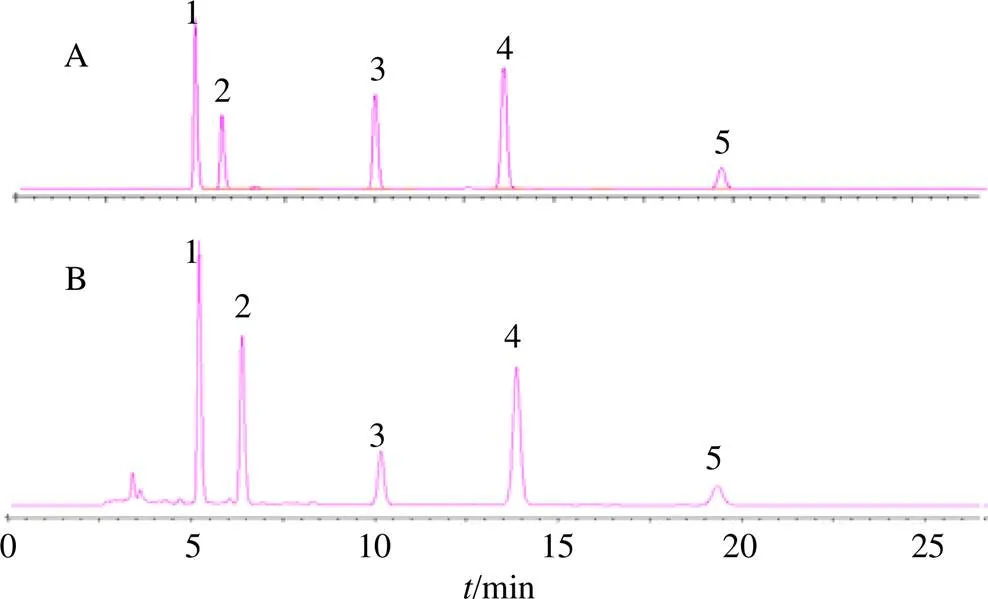
1-芦荟大黄素 2-大黄酸 3-大黄素 4-大黄酚 5-大黄素甲醚

表2 5个成分回归方程及线性范围
2.4.3 重复性考察 将GSZQ的样品按照“2.2”项平行制备6份供试品溶液,按“2.3”项的色谱条件进样,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚质量烦分数的RSD分别为1.10%、1.85%、1.40%、1.16%、2.12%,表明方法重复性较好。
2.4.4 稳定性考察 将GSZQ的样品按照“2.2”项制备供试品溶液,分别于制备后的0、4、8、12、24 h进样,测量芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的峰面积积分值,计算RSD分别为2.24%、1.53%、2.76%、1.15%、2.89%,表明制得的样品溶液在24 h内稳定性良好。
2.4.5 加样回收率考察 将GSZQ的样品按照“2.2”项制备6份供试品溶液,分别精密加入混合对照品溶液制得样品,进样分析,计算芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚5个成分的平均加样回收率,依次为99.88%、99.75%、99.91%、99.77%、99.91%,RSD分别为0.74%、1.32%、0.82%、0.91%、1.01%。
2.5 样品测定
分别取27个居群的大黄粉末,每份样品按“2.2”项的处理方法重复制备3份供试品溶液,按“2.3”项的色谱条件进样,记录对照品溶液和供试品溶液中待测物质的峰面积,按照外标法分别计算芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的含量,其中总蒽醌成分的含量按“2.2”项下方法处理后得到的5个游离蒽醌成分的总量计。不同居群的大黄总蒽醌和5个游离蒽醌成分的含量测定结果见图2。本研究大黄的总蒽醌及5个游离蒽醌成分的含量均达到了《中国药典》2020年版规定的标准(总蒽醌不得少于1.5%)。整体上,对游离蒽醌类成分而言,青海天峻和泽库,四川理县、冕宁和新龙,甘肃永登、天祝和肃南以及西藏昌都等居群的含量较高,总蒽醌在四川南江、山西沁水、云南香格里拉、陕西眉县等居群中含量较高。
2.6 PCA、PLS-DA和OPLS-DA判别分析结果
含量测定结果表明,地理距离较近的大黄中蒽醌类成分含量的相似度较高,因此拟采用PCA、PLS-DA以及OPLS-DA的分析方法对5个游离蒽醌成分的含量进行分析。将本研究27个居群的大黄进行含量测定后获得的数据使用SIMCA-P 14.1进行统计学分析,得到的PCA结果如图3所示,结果表明,第1主成分(PC 1)解释了85.14%的方差,第2主成分(PC 2)解释了11.25%的方差,即前2个因子可解释原变量的96.39%的信息。PCA将27个居群的大黄从地理上大致分为了2组,一组包括甘肃肃南、青海玛沁、四川理县、云南小中甸等16个居群,另外一组包括陕西周至、山西沁水、湖北兴山、宁夏泾源等11个居群,这2组与大黄传统道地产区和非道地产区相吻合。对这2个组的居群分别进行PLS-DA和OPLS-DA分析,结果如图4和5所示。在提前分组的基础上,PLS-DA和OPLS-DA分析的得分图结果均显示2个组能明显分开且第1、2主成分共能解释超过99.99%的差异,对模型的可靠性进行假设检验,其结果证明此模型较可靠。
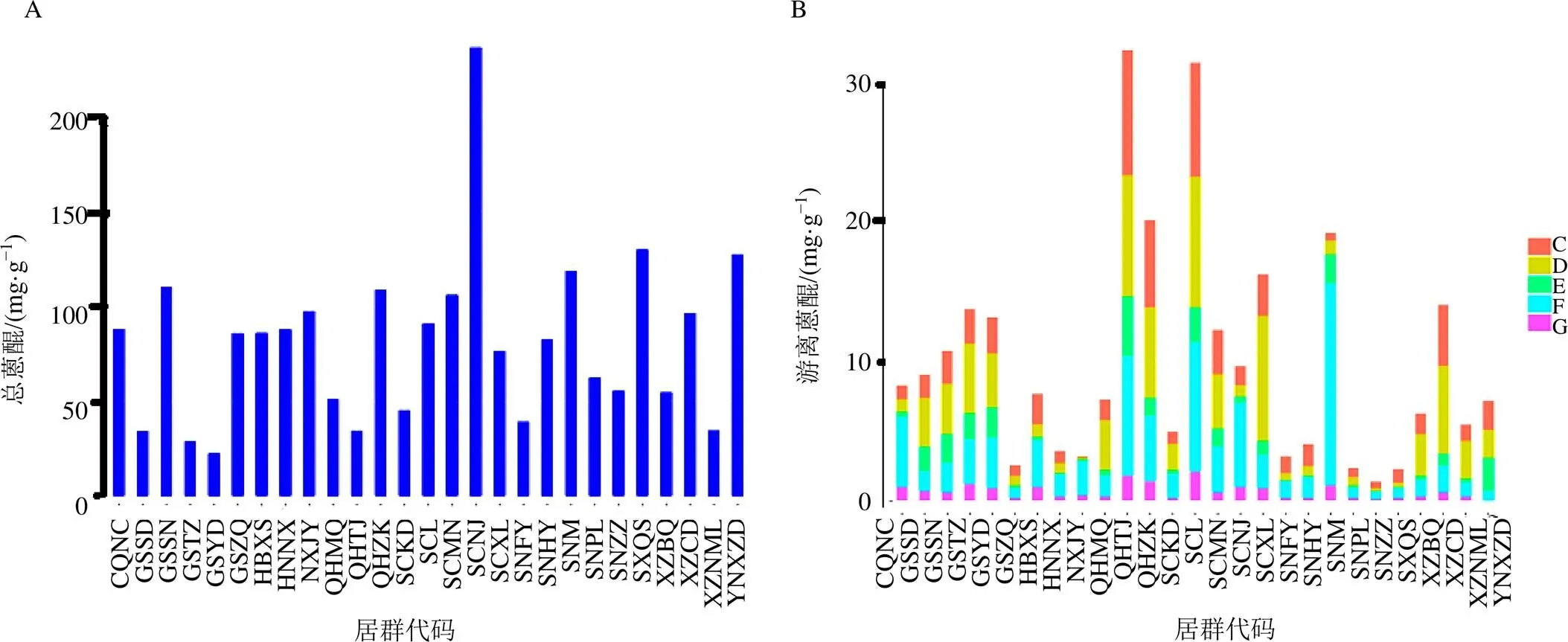
C-芦荟大黄素 D-大黄酸 E-大黄素 F-大黄酚 G-大黄素甲醚
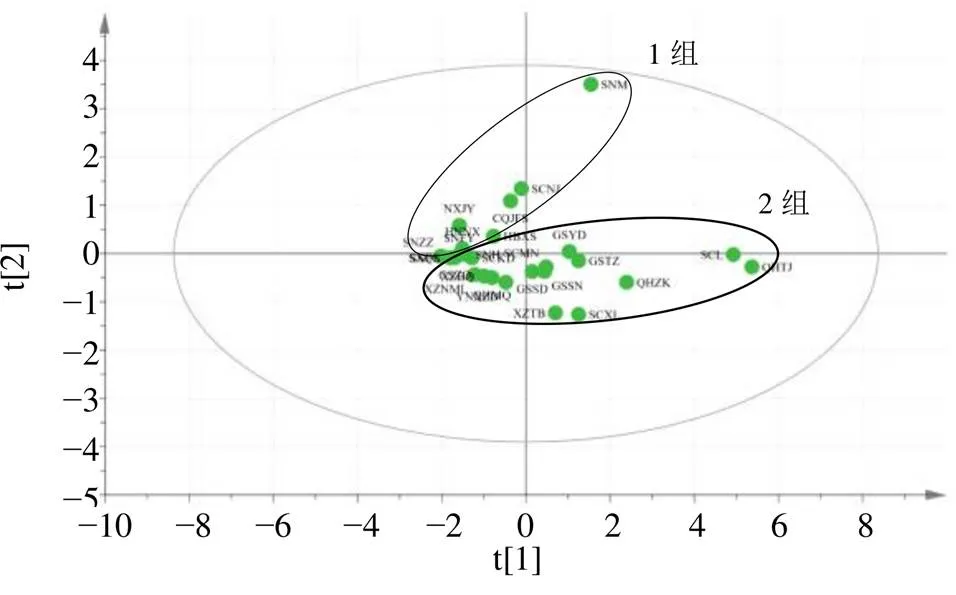
图3 27个居群大黄的PCA图
2.7 聚类分析结果
将含量测定结果的数据经过IBM SPSS Statistics 20进行标准化后,使用组内联接法为聚类方法,Squared Euclidean Distance为测量距离方进行聚类分析,结果见图6。结果表明,27个居群的大黄被大致分为2大支,其中,除陕西平利居群(SNPL)外其余的陕西居群、山西沁水、湖北兴山、河南内乡、重庆南川、四川南江及宁夏泾源居群聚为一支;甘肃、青海、西藏、云南的所有居群及除南江以外的四川居群则聚为另一大支,在这一大支中,云南香格里拉居群则单独聚为一小支。
2.8 统计学检验结果
将27个居群的大黄按照上述结果分为道地产区(16个居群)和非道地产区(11个居群)2组,然后使用Student′s t test的统计学检验方法研究总蒽醌及5个游离蒽醌成分在这2组中的差异性(图7)。结果表明游离蒽醌类中的芦荟大黄素和大黄素的含量2大产区之间具有显著性差异(<0.05),大黄酸的含量在2大产区之间差异性极显著(<0.01),而大黄酚和大黄素甲醚在2大产区之间差异不显著。总蒽醌在道地和非道地产区之间差异无统计学意义。
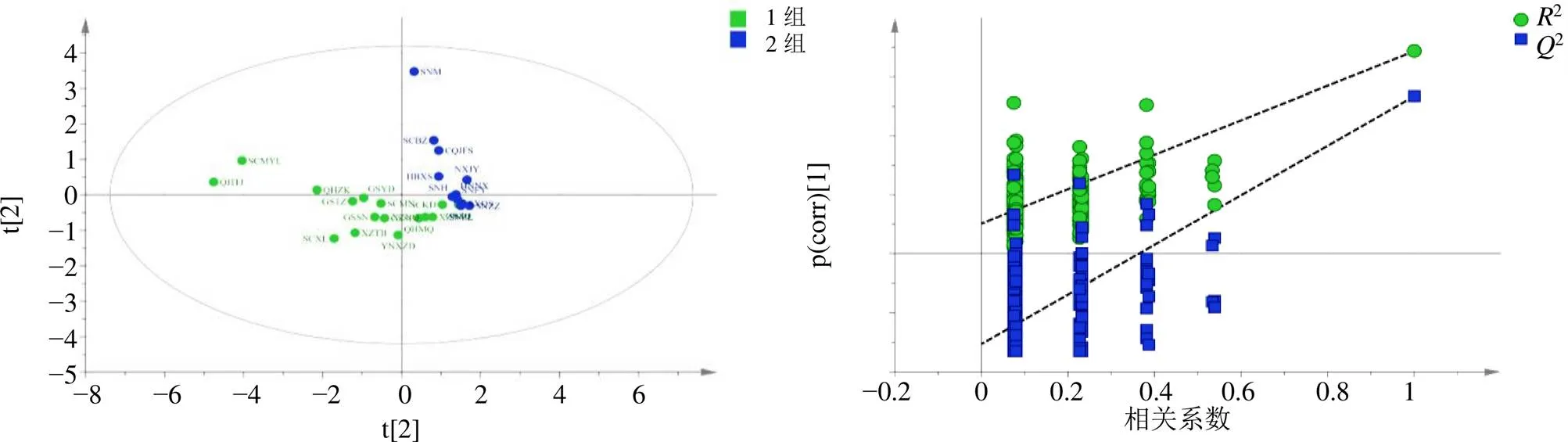
图4 27个居群大黄的PLS-DA得分图(左) 和置换检验图(右)
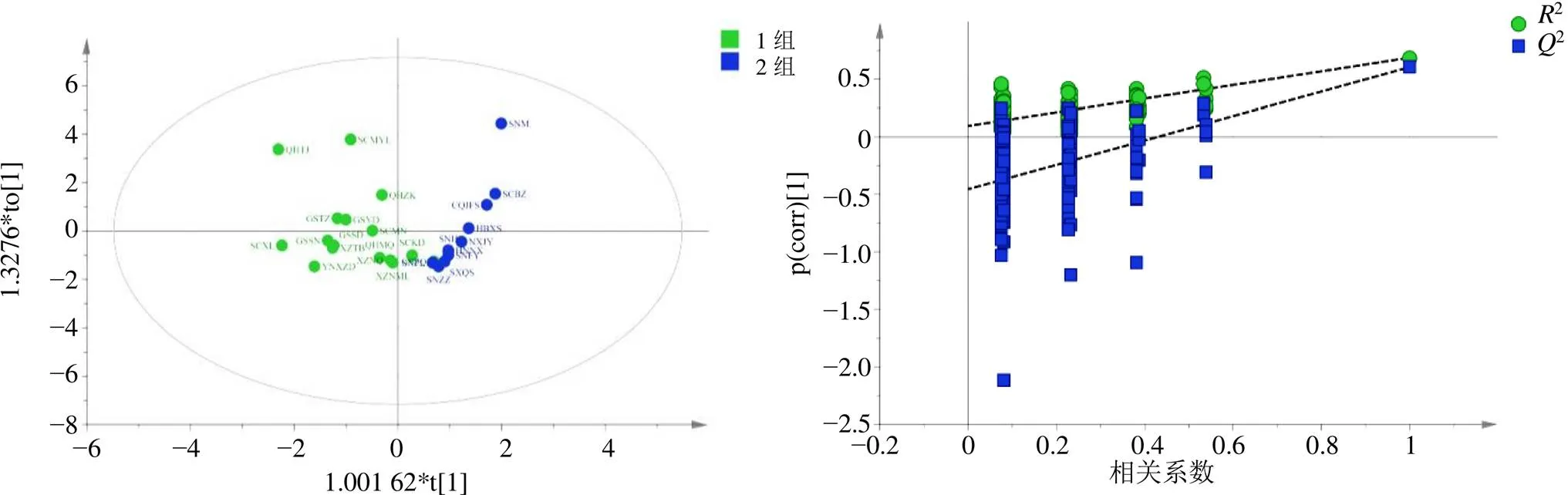
图5 27个居群大黄的OPLS-DA (左)和置换检验图(右)

图6 基于大黄蒽醌类成分的聚类图
3 讨论
3.1 测定成分的选择
目前大黄中已明确化学结构的成分有160多个,包括蒽醌及其苷类、蒽酮及其苷类、鞣质类、二苯乙烯类、苯丁酮类等成分,其作为道地性形成的物质基础,在大黄道地性的研究中具有重要价值[22]。蒽醌类成分是大黄中含量最多的活性成分,也是大黄的主要药效成分[11,23],同时也是《中国药典》2020年版大黄质量控制的重要指标,因此本研究选择测定总蒽醌及5个游离蒽醌成分作为研究大黄品质差异的指标。
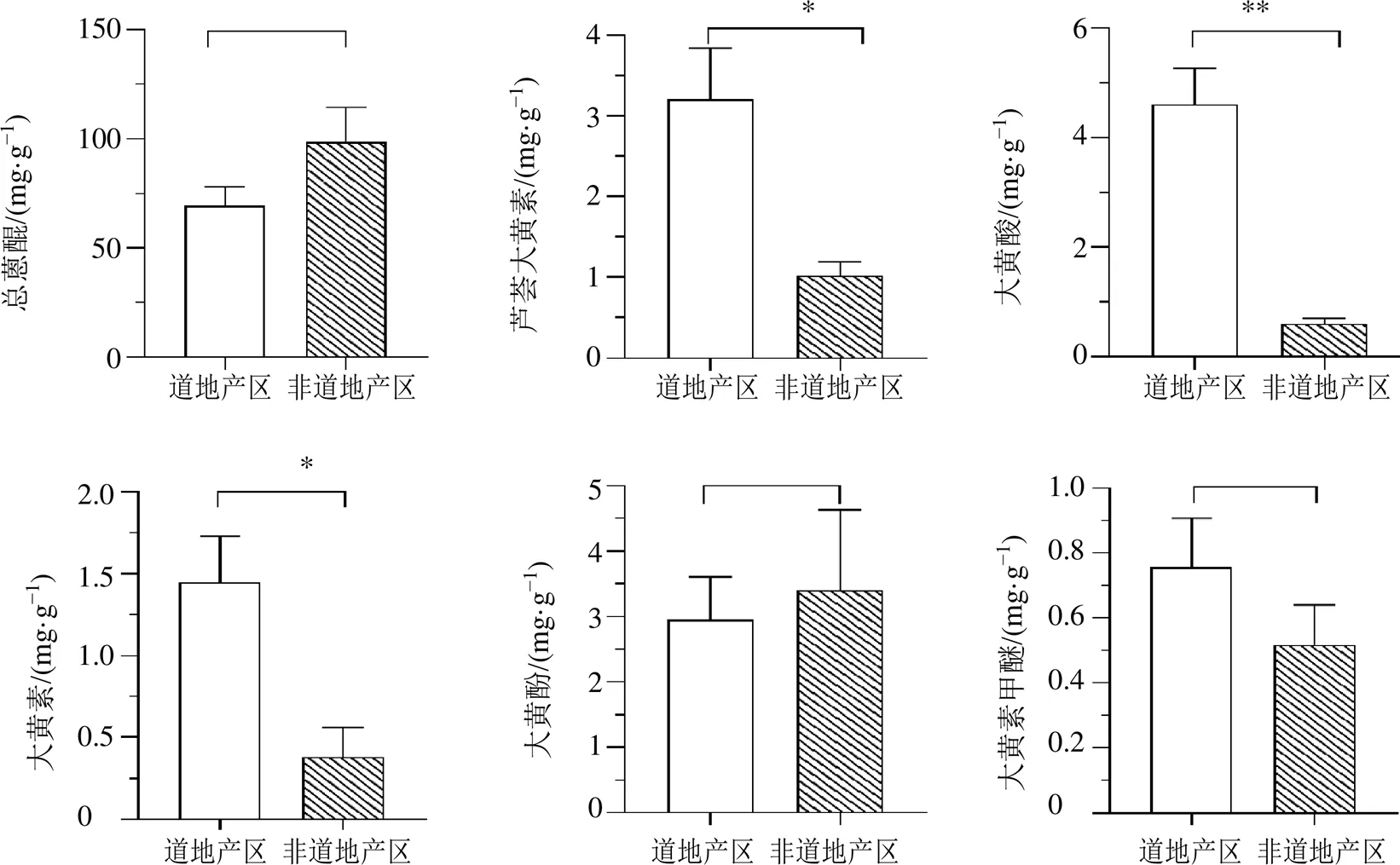
**P < 0.01 *P < 0.05
3.2 结果分析
药材的有效成分组成及含量是中药材品质的重要体现,而药效成分的生物合成与积累是遗传和环境长期协同进化的结果[24-25]。本研究以野生大黄为研究对象,从居群水平分析了野生大黄的主要药效成分蒽醌类成分的含量。27个大黄原植物居群可聚为2大支,除个别居群外,这2大支分别对应传统上划分的大黄道地和非道地产区。如采自甘肃、青海和四川的居群大多聚为一支,然而采自四川的南江居群却与非道地产区的居群聚为一大支。推测造成上述聚类结果的可能原因是四川境内地势复杂,其中四川南江在自然区域上属于秦巴山区,而理县和新龙县则位于川西高原,不同地区之间小气候的差异导致药效成分之间的积累存在差异,从而影响基于成分分析的聚类结果,然而该结果却与课题组前期对大黄原植物遗传层面的分析结果相吻合[9-10]。综合遗传和化学成分的分析结果,表明不能单纯的以行政区域来划定某种药材的道地产区,而应该重视在居群水平上的研究,并以山脉、盆地或河谷等自然区划来区分药材的道地与非道地产区也许更为合理。另外,本研究野生大黄中的总蒽醌及5个游离蒽醌成分的含量,在四川、甘肃和青海的大多数居群中均较高,此结果也得到了商彤等[26]以青海所产大黄为种源,分别在四川若尔盖、甘肃宕昌和河北沽源进行同质园实验结果的证实,即游离蒽醌类成分的含量是受遗传和环境共同影响。课题组前期大量的野外资源调查也表明,大黄原植物喜冷凉、光照充足且较为潮湿的环境。因此,无论是野生还是栽培的大黄原植物,多生长于降水较多、海拔较高的地区,这些生境有利于蒽醌类成分的积累。统计学分析结果显示芦荟大黄素、大黄素和大黄酸在两大类群间有显著差异,且除大黄酚外其余4个游离蒽醌成分的含量在道地产区均比非道地产区高,而总蒽醌在两大类群间差异不显著。现代药理实验表明,游离蒽醌类成分是大黄清热解毒、抑菌消炎的主要成分,不同于结合蒽醌和二蒽酮类以泄下作用为主[27-29],因此,道地产区的大黄可能在清热抑菌等方面优于非道地产区的大黄。然而,本研究主要是基于《中国药典》2020年版中大黄的含量测定,大黄道地性的物质基础除了总蒽醌和游离蒽醌成分以外,还包括结合蒽醌类、二蒽酮类及鞣质类等成分,因此,今后拟将以上成分纳入大黄质量评价研究,以期深入揭示野生大黄在不同分布区的品质差异。
利益冲突 所有作者均声明不存在利益冲突
[1] 黄璐琦, 张瑞贤. “道地药材”的生物学探讨 [J]. 中国药学杂志, 1997, 32(9): 53-56.
[2] 中国药典 [S]. 一部. 2020: 24
[3] Wang X M, Hou X Q, Zhang Y Q, e. Morphological variation in leaf dissection ofcomplex (Polygonaceae) [J]., 2014, 9(10): e110760.
[4] Wang X M, Yang R, Feng S F,. Genetic variation inand(Polygonaceae), two medicinally and endemic species in China using ISSR markers [J]., 2012, 7(12): e51667.
[5] Wang X M, Hou X Q, Zhang Y Q, et. Genetic diversity of the endemic and medicinally important plant Rheumas revealed by Inter-Simple Sequence Repeat (ISSR) markers [J]., 2012, 13(3): 3900-3915.
[6] Wang X M, Hou X Q, Zhang Y Q,. Distribution pattern of genuine species of rhubarb as traditional Chinese medicine [J]., 2010, 4(18): 1865-1876.
[7] 孙晓洁. 基于查尔酮合酶基因变异的大黄道地性形成的遗传学机制研究 [D]. 西安: 西安交通大学, 2016.
[8] 李文丽. 基于ALS、BAS基因变异的大黄道地性形成的遗传学机制研究 [D]. 西安: 西安交通大学, 2019.
[9] Wang X M, Feng L, Zhou T,. Genetic and chemical differentiation characterizes top-geoherb and non-top-geoherb areas in the TCM herb rhubarb [J]., 2018, 8(1): 9424.
[10] Feng L, Ruhsam M, Wang Y H,. Using demographic model selection to untangle allopatric divergence and diversification mechanisms in thecomplex in the Eastern Asiatic Region [J]., 2020, 29(10): 1791-1805.
[11] 傅兴圣, 陈菲, 刘训红, 等. 大黄化学成分与药理作用研究新进展 [J]. 中国新药杂志, 2011, 20(16): 1534-1538.
[12] 李晓红, 李蒙, 陶艳蓉. 大黄酸及其衍生物药理作用研究新进展 [J]. 现代药物与临床, 2010, 25(6): 417-421.
[13] 马继雄. 大黄素药理作用研究进展 [J]. 青海师范大学学报: 自然科学版, 2011, 27(4): 48-51.
[14] 刘商. 何首乌中大黄素-8--β--葡萄糖苷的分离纯化与抗癌活性研究 [J]. 新中医, 2015, 47(4): 264-266.
[15] 李洋. HPLC法同时对大黄3类药理活性物质质量控制及指纹图谱初步研究 [D]. 成都: 西南交通大学, 2010.
[16] Wang J B, Li H F, Jin C,. Development and validation of a UPLC method for quality control of rhubarb-based medicine: Fast simultaneous determination of five anthraquinone derivatives [J]., 2008, 47(4): 765-770.
[17] 贾晗, 付绍智. 大黄的成分比较研究综述 [J]. 内蒙古中医药, 2016, 35(6): 117-118.
[18] 黄以钟, 潘大仁, 王占成, 等. 不同生长时期对马蓝药效成分的影响 [J]. 中国农学通报, 2009, 25(16): 75-78.
[19] 马莹, 郭娟, 毛亚平, 等. 药用植物有效成分生物合成途径解析及其应用 [J]. 中华中医药杂志, 2017, 32(5): 2079-2083.
[20] 李磊, 孙平, 冯成强. 不同产地野生与栽培掌叶大黄中蒽醌类成分含量的比较 [J]. 时珍国医国药, 2010, 21(9): 2251-2253.
[21] 李磊, 刘瑞, 袁波, 等. 大黄HPLC指纹图谱分析 [J]. 中国药学杂志, 2005, 40(17): 1302-1305.
[22] 焦东海, 杜上鉴. 大黄研究 [M]. 上海: 上海科学技术出版社, 2000: 236.
[23] Guan Q, Liang S, Wang Z,. ¹H NMR-based metabonomic analysis of the effect of optimized rhubarb aglycone on the plasma and urine metabolic fingerprints of focal cerebral ischemia-reperfusion rats [J]., 2014, 154(1): 65-75.
[24] 王跃华, 孙雁霞, 徐文俊, 等. 不同产地大黄质量分析研究 [J]. 成都大学学报: 自然科学版, 2007, 26(3): 177-179.
[25] Pérez-Enciso M, Tenenhaus M. Prediction of clinical outcome with microarray data: A partial least squares discriminant analysis (PLS-DA) approach [J]., 2003, 112(5): 581-592.
[26] 商彤, 胡会娟, 孟磊, 等. 遗传和环境对唐古特大黄功效成分含量的影响研究 [J]. 中国中药杂志, 2018, 43(11): 2246-2253.
[27] Xiao P G, He L Y, Wang L W. Ethnopharmacologic study of Chinese rhubarb [J]., 1984, 10(3): 275-293.
[28] 郑俊华, 果德安. 大黄的现代研究 [M]. 北京: 北京大学医学出版社, 2007: 236.
[29] 张明明, 胡会娟, 李娇, 等. 不同采收期对唐古特大黄功效组分含量的影响 [J]. 中国现代中药, 2020, 22(5): 735-740.
Content determination of anthraquinone and quality evaluation of the population of source plants of rhubarb based on HPLC
[1]ZHU Hong-hong1, 2, HOU Xiao-qi3, ZHANG Miao4, ZHOU Tao1, FENG Li1, WANG Xu-mei1, 2
1. School of Pharmacy, Xi′an Jiaotong University, Xi′an 710061, China 2. Key Laboratory ofResources and Anti-tumor Activities, Shaanxi Administration of Traditional Chinese Medicine, School of Pharmacy, Xi’an Jiaotong University, Xi’an 710061, China 3. Guiyang Medicinal Botanical Garden, Guiyang 550002, China 4. Lixian Spring Pharmaceutical Co. Ltd., Longnan 742200, China
To provide a reference for the study of the geoherblism formation of rhubarb, the content of total anthraquinone and five free anthraquinone compounds of source plants of rhubarb collected from 27 populations of 11 provinces were determined.Amethyst C18-H column (4.6 mm × 250 mm, 5 μm) was chosen, the mobile phase consisted of methanol-0.1% phosphoric acid water (85:15) with isocratic elution at a flow of 1.0 mL·min-1, and the column temperature was 30°C. The detection wavelength was set at 230 nm. The results were analyzed using multiple statistical methods (e.g., principal components analysis (PCA), partial least squares discrimination analysis (PLS-DA), orthogonal partial least squares discrimination analysis (OPLS-DA) and cluster analysis).The content of total anthraquinone and five free anthraquinone compounds was in accord with the standard of Chinese Pharmacopoeia, and the rhubarb from different populations could be divided into two clusters, which is consistent with the traditional geoherb and the non-geoherb areas. In addition, the content of three compounds, namely aloe-emodin, emodin and rhein, in the geoherb areas were significantly higher than that of non-geoherb areas.There are significant differences among the anthraquinone content from different populations, which can be used as the index to evaluate geoheblism of rhubarb.
et; anthraquinone; aloe-emodin; emodin; rhein; quality evaluation; distribution pattern; fingerprint
R286.2
A
0253 - 2670(2021)17 - 5295 - 08
10.7501/j.issn.0253-2670.2021.17.022
2021-08-06
国家自然科学基金资助项目(31770364)
朱红红(1996—),女,硕士研究生,研究方向为中药药效物质基础及中药质量评价。Tel: 18434824942 E-mail: zhh3073405237@stu.xjtu.edu.cn
王戌梅,女,沈阳药科大学2009级中药资源学博士校友,博士生导师,教育部高等学校中药学类专业教学指导委员会《药用植物学》课程联盟理事,陕西省天然药物学会常务理事,主持国家自然科学基金项目3项,主持省部级项目8项,获陕西省科学技术研究成果二等奖1项。研究方向为中药学。Tel: 13109529573 E-mail: wangxumei@mail.xjtu.edu.cn
[责任编辑 时圣明]
