环维黄杨星D的结构修饰及黄杨宁片的剂型改进研究进展
2021-09-06阮静雅张紫鑫吴丽杰
高 畅,阮静雅,张紫鑫,吴丽杰,王 涛,张 祎
环维黄杨星D的结构修饰及黄杨宁片的剂型改进研究进展
高 畅,阮静雅,张紫鑫,吴丽杰,王 涛*,张 祎*
天津中医药大学 天津市中药化学与分析重点实验室,天津 300167
环维黄杨星D(cyclovirobuxine D,CVB-D)为小叶黄杨及其同属植物的主要活性成分,具有保护心脑血管等多种药理作用。以其为主要成分的临床常用药黄杨宁片对于冠心病和心绞痛具有明确治疗作用。但是,在临床应用过程中发现,黄杨宁片作为一种口服片剂,存在着水溶性差、生物利用度低,在胃肠道内具有多个吸收位点、释药不稳定,难以透过血脑屏障,并具有心脏蓄积及肝肾毒性等缺点。因此,有必要通过结构修饰或剂型改变来解决CBV-D存在的上述问题。对CVB-D的结构修饰及黄杨宁片剂型改进的研究进展进行综述,以期为其进一步的研究开发提供理论依据。
环维黄杨星D;衍生物;结构修饰;黄杨宁片;剂型改进;防治心脑血管疾病
环维黄杨星D(cyclovirobuxine D,CVB-D,图1)是从黄杨科植物小叶黄杨Siebold & Zucc. var.Rehd. et Wils.及同属植物中提取分离得到的具有广泛生理活性的甾体生物碱[1]。早在1969年,中国人民解放军卫生队在对民间验方进行挖掘时就发现,含黄杨木的“郭氏验方”可用于治疗多种心脏疾病[2]。1974年之后,对黄杨木开展了一系列研究,发现其主要药效物质CVB-D(质量分数约为0.321%)[3]能通过改善心肌舒缩功能[4]、抗心肌缺血[5]、抗心肌损伤[6]、抗心律失常[7]、改善血流动力学与血液微循环[8]等发挥对心血管的保护作用。同时,CVB-D还对脑血管具有很好的保护作用,可用于预防和治疗缺血性脑卒中[9-10]。
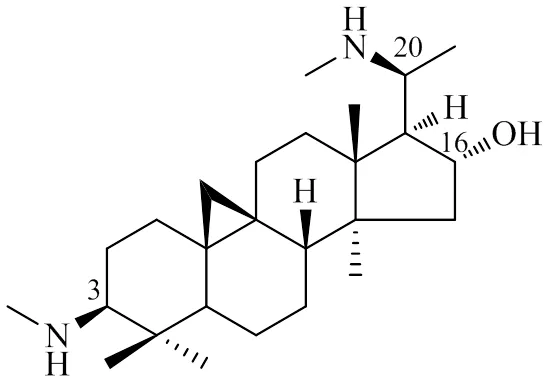
图1 环维黄杨星D的化学结构
基于其良好的生物活性,南京军区空军后勤部卫生处以CVB-D为主要成分,制备了黄杨宁片,用于临床试验,发现其对心绞痛等疾病疗效显著[11]。2000年,黄杨宁片作为我国继青蒿素、麻黄碱后的又一具有广阔应用前景的临床新药,被《中国药典》按成方制剂和单味制剂收载,用于治疗气滞血瘀所致的心脑血管疾病,如心律失常、冠心病、心绞痛[12]等临床证候。然而,研究发现CVB-D具有心脏蓄积[9]及肝肾毒性[13-14]。同时,CVB-D还具有水溶性差、口服起效慢、生物利用度低,在胃肠道内具有多个吸收位点、血药浓度达峰时间长、释药不稳定、难以透过血脑屏障等缺点,对于重度患者和吞咽困难患者的治疗比较受限[9,15]。为解决上述存在问题,国内外专家学者开展了大量的结构修饰与构效关系研究及其新剂型的探索。本文以修饰位点分类,对近10年来CVB-D的结构修饰及衍生物的活性研究进展进行综述。同时,对黄杨宁片剂型改进的研究进展加以讨论,以期为其进一步的研究开发提供理论依据。
1 CVB-D的结构修饰
CVB-D结构中便于结构修饰的位点主要有3个,分别为3-氨基、20-氨基及16-羟基,主要的结构修饰反应包括成盐、酰基化以及聚乙二醇化,从而形成了丰富多样的衍生物。通过对上述3个位点的修饰,不仅能达到增加溶解度、降低毒副作用的目的,还能改善CVB-D的药理活性,为其作为心脑血管和阿尔茨海默病等疾病治疗药物的研发提供思路。
1.1 3-氨基、20-氨基的衍生化
为了解决CVB-D水溶性差、溶解度低的问题,专家学者合成了CVB-D的盐酸盐[16]、柠檬酸盐[17]以及富马酸盐[18]等一系列无机或有机盐衍生物。研究表明CVB-D的3-氨基、20-氨基盐酸盐JLX001(图2)可通过下调血栓素/磷脂酶C-β-3/蛋白激酶C通路抑制缺血性脑损伤,并减轻脑损伤引起的脑梗死和脑水肿[19]。JLX001还可通过调节氧化应激、抗炎,抑制Toll样受体2/4-核因子-κB信号通路[16],下调c-Jun氨基末端激酶信号通路,减少神经元凋亡[20],上调腺嘌呤核糖核苷酸依赖的蛋白激酶-UNC-51类似自噬激活激酶1信号通路激活诱导自噬[21],或通过降低基质金属蛋白酶9的表达和激活Wnt/β-联蛋白信号通路,减轻缺血性脑损伤[22]。
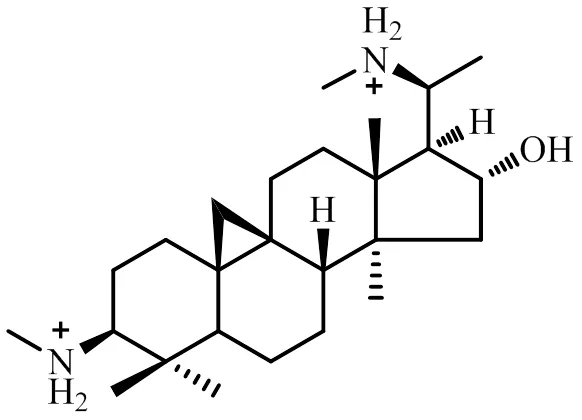
图2 JLX001的化学结构
以含氮杂环具有独特的生物活性、较低的生物毒性和较高的水溶性为依据,向涛课题组[1,23]对CVB-D结构中的3-氨基、20-氨基进行酰化反应,得到了含有氮杂环的CVB-D系列酰胺产物(1~14,图3),并以ICR小鼠为模型,研究对比了CBV-D及其酰胺衍生物的耐缺氧生物活性。结果表明,与对照组相比,化合物2、8~14能延长缺氧环境下小鼠的生存时间。将CVB-D的单、双取代衍生物进行对比,小鼠耐缺氧实验结果提示双取代衍生物的活性明显强于单取代衍生物,其中,差异最为明显的是化合物3与10、化合物6与13这2组衍生物。同等给药剂量(7.5 mg/kg)下,单取代化合物3和6的延长率小于−5%,而双取代化合物10、13的延长率高达20%以上,明显优于CVB-D组(17.52%),显著提高了机体的耐缺氧能力。构效关系研究表明,C-3、C-20位二酰胺化衍生物活性显著强于C-3位单酰胺化衍生物,咪唑或吗啉基的引入可将其活性提高约25%。
为了解决市售黄杨宁片水溶性差、有效成分含量低的问题,蔡苹[24]对CVB-D结构中20-氨基进行了药物设计,合成了多个CBV-D与丹参酮ⅡA的复合物(15~18,图4)。这些复合物与CVB-D和丹参酮ⅡA相比,显著改善了二者在水中的溶解性,同时保留了二者防治心血管类疾病的药效。药理实验结果表明,以上改造得到的复合物均可延长小鼠的耐缺氧时间,提升耐缺氧能力,与CVB-D相同给药剂量(3 mg/kg)比较,化合物16~18的作用更好。其中,CVB-D组小鼠的耐缺氧时间为23.17 min,化合物17~19可将小鼠的耐缺氧时间均提升至23.73 min以上。
1.2 16-羟基的衍生化
高署等[25]对CVB-D的16-OH进行结构修饰,共得到32个衍生物(19~50,图5)。并对化合物19~28、30~42、47和48进行了耐缺氧和抗心肌缺血实验研究。结果表明,上述化合物均能显著延长小鼠在缺氧环境中的存活时间,与黄杨宁组[(52.482±7.823)min]相比,化合物24、26、28、35可将小鼠存活时间提升至59 min以上;化合物23、24、26、28、35、38和42可抑制冠状动脉左前降支结扎的大鼠心脏ST段抬高,抑制率均大于55%,明显高于黄杨宁组(大鼠心脏ST段抬高抑制率为44%),具有较好的抗心肌缺血作用。
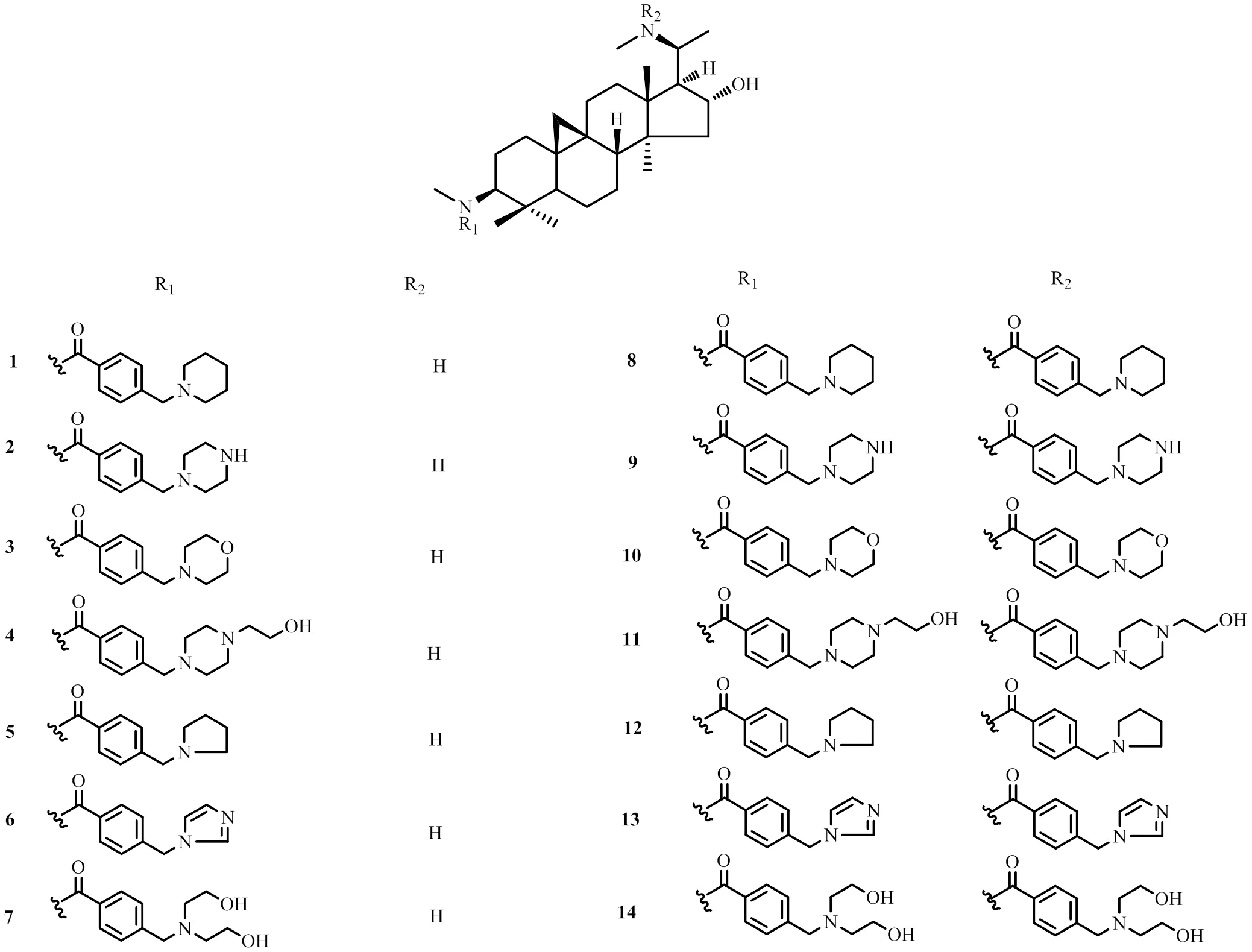
图3 化合物1~14的化学结构
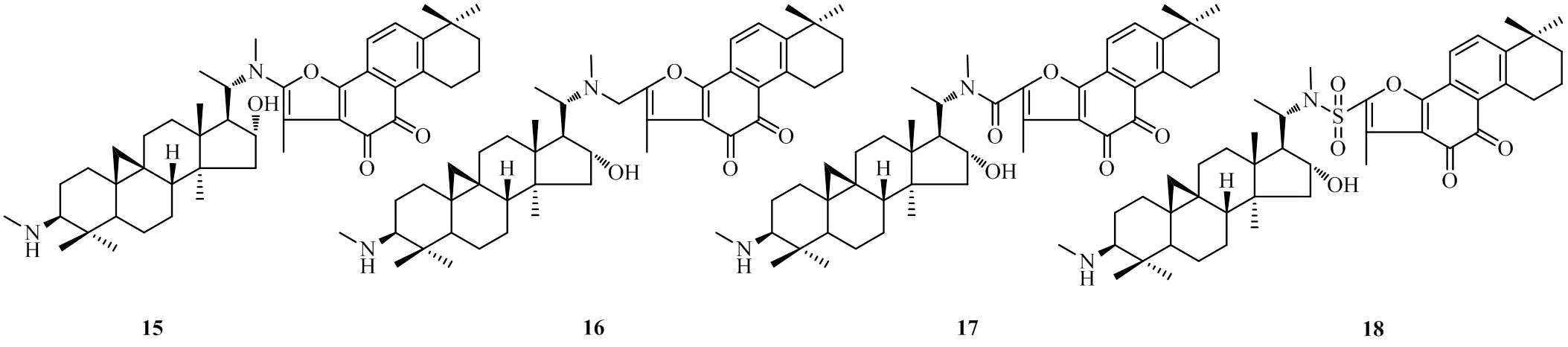
图4 化合物15~18的化学结构
采用类似方法,南敏伦等[26]合成了系列CVB-D的16-OH酰化衍生物(51~62,图5)。体外实验结果表明,所有化合物均具有抑制乙酰胆碱酯酶的作用,特别是化合物58~60、62的半数抑制率(half maximal inhibitory concentration,IC50)值均小于5.60 µg/mL,低于CVB-D(6.05 µg/mL)。研究探讨了CBV-D及其衍生物51~62对β-淀粉样蛋白片段25~35诱导人神经母细胞瘤SH-SY5Y细胞损伤的神经保护作用,发现它们对SH-SY5Y细胞均有不同程度的保护作用,与CVB-D相比,化合物58~60、62的细胞存活率更高、半数有效量更低。在相同剂量(100 µg/kg)下,CVB-D组的细胞存活率为82.68%,而化合物58~60、62可使其提升至85%以上。提示CVB-D衍生物可通过改善胆碱能系统的损伤发挥防治阿尔茨海默病的作用。
1.3 3-氨基、20-氨基或16-羟基的聚乙二醇衍生化
聚乙二醇是一类聚醚化合物,可通过自身的乙氧基与水形成氢键,在水和有机溶剂中均有良好的溶解性能[27]。药物与聚乙二醇偶联衍生化后,其水溶性及半衰期(1/2)均得到改善。CVB-D及其盐酸盐、硫酸盐、酒石酸盐、抗坏血酸盐等多种有机酸盐和无机酸盐均可与聚乙二醇的2个或多个端基发生衍生化,形成二聚体或多聚体[28],不仅能改善CVB-D的溶解性,还可减轻毒副作用。徐立华等[29]对大鼠分别连续28 d尾iv聚乙二醇衍生化CVB-D(PEGylated cyclovirobuxine D,PEG-CVB-D)和CVB-D,发现与对照组比较,CVB-D(4 mg/kg)能升高雌性大鼠血液的尿酸水平,而PEG-CVB-D低、中、高剂量(2、4、8 mg/kg)组较对照组无明显差异;肝组织病理学切片结果表明,在相同剂量下,PEG-CVB-D组的毒性明显低于CVB-D组。以上研究结果提示聚乙二醇修饰可有效降低CVB-D的肝、肾毒性。
迄今为止,对CVB-D的结构修饰方式局限于化学衍生化方法,其修饰产物的相关药理作用均得到了显著提升,但该方法存在副产物多、结构修饰方向较为局限等缺点。因此,在后续研究中,专属性强、作用条件温和可控,产物收率高,能突破常规化学方法无法完成的合成反应、酶转化和微生物转化方法应得到重视。
2 CVB-D剂型及给药方式的改进
作为脂溶性生物碱,CVB-D水溶性差、口服生物利用度低,且其以口服形式进入体内后,经过肝肠循环,在胃肠道内具有多个吸收位点,这使得CVB-D体内吸收的药-时曲线呈现出明显的双峰现象,致使药物有效血药浓度不易维持[30]。此外,在治疗脑部病变时,由于其血脑屏障透过率低,使得药物的脑内生物利用度过低,难以达到治疗效果等。近年来,为了解决上述问题,国内外专家学者将研究热点聚焦于其剂型改造方面。
2.1 改造CVB-D剂型以提高生物利用度和改善药物释放的稳定性
2.1.1 改造CVB-D剂型以提高生物利用度
(1)CVB-D羟丙基-β-环糊精包合物(cyclovirobuxine D hydroxypropyl-β-cyclodextrin complex,CBHD):溶解度是影响药物生物利用度的重要因素。对于水溶性差的药物,应用环糊精分子的空穴结构对其进行包嵌形成环糊精包合物是改善溶解度的一种行之有效的方法。陈静等[15]使用研磨法制备CBHD,并对大鼠进行ig给药。实验结果提示,与CVB-D相比,CBHD显著提高了最大血药浓度(max)和药-时曲线下面积(AUC0-t),延迟了达峰时间,延长了1/2,使得其相对CVB-D的生物利用度高达248.58%。
(2)CVB-D磷脂复合物(cyclovirobuxine D phospholipid complex,CBPC):磷脂复合物是应用电荷迁移作用,使药物和磷脂分子形成较稳定的化合物或络合物。这一复合物的形成可较大程度地提升药物的溶解性能、胃肠道吸收率、体内作用时间和生物利用度。
陈静等[30]采用星点设计-效应面法对CBPC进行工艺优化,以筛选出的最佳工艺合成复合物后对大鼠进行ig给药并收集其血样。结果表明, CBPC的AUC0~t、max和平均驻留时间(MRT0~t)分别增加了2.74、1.19、1.81倍。由于磷脂具有亲脂性,还能发挥表面活性剂的作用。因此,CBPC既能增加药物的水溶性,促进药物的吸收,与CVB-D相比,其相对生物利用度可达274.84%;同时,其良好的亲脂性能还能延长CVB-D向生物膜的扩散时间,显示缓释效果。
在以上研究过程中发现,CVB-D的环糊精包合物和磷脂复合物均可通过增加溶解性达到提高生物利用度的作用,但其效果仍未达到理想状态。为了进一步提升其生物利用度和肠道靶向性,陈静[31]在上述研究的基础上将CVB-D与亲脂的磷脂复合物及亲水的羟丙基-β-环糊精包合物相结合,制备得到CVB-D羟丙基-β-环糊精磷脂复合物(cyclovirobuxine D hydroxypropyl-β-cyclodextrin complex,CBHP)。给药后大鼠药动学参数的变化提示,与CVB-D相比,CBHP不仅可明显提升1/2和MRT0-t,还可显著提高药物在小肠内的吸收速率常数、吸收百分率和有效渗透率,从而降低清除率。以上结果提示,CBHP可通过降低清除率、延长药物在体内的时间而改善相对生物利用度,并具有研制成结肠靶向制剂的潜力。
(3)CVB-D纳米制剂:纳米制剂因具有粒径小的特点,在改善药物溶解性、提高生物利用度方面同样具有广泛应用。张景勍等[32-33]联用磷脂复合物、包合物及纳米乳3种技术,制得CVB-D的水包油型环糊精磷脂复合物纳米乳和油包水型环糊精磷脂复合物纳米乳2种包合物,其AUC0-t大于磷脂复合物、包合物及纳米乳3种技术单独使用的总和,其生物利用度明显高于单独使用1种技术或2种技术所制包合物。该方法工艺简单、成本低廉、便于工业化生产。
除纳米乳外,纳米混悬液在提高药物溶解度方面同样具有良好的作用。杨建宏等[34]以CVB-D、超级崩解剂和稳定剂为原料,合成纳米混悬液,使药物以纳米的尺寸存在于混悬液中。该纳米混悬液颗粒小、稳定性高,药物的溶解速度和程度明显得到了提高,进而提升了其生物利用度。
(4)CVB-D固体分散体:癸酸钠是一种安全的肠道促吸收剂,多作用于细胞内和胞旁的通路而改善肠道黏膜的通透度,促进药物的吸收,提高其血药浓度和生物利用度。南敏伦等[35]选用CVB-D、载体材料和癸酸钠制成固体分散体,相较于药物单体,其固体分散体的表观溶解度提升了7~8倍,体外溶出度提升了5倍,相对生物利用度增加了25%以上。药效学实验结果表明,CVB-D固体分散体可改善超氧化物歧化酶活力、抑制丙二醛生成,提升脑系数、降低乙酰胆碱酯酶分泌,发挥预防阿尔茨海默病老年痴呆症的作用,且这种作用明显强于阳性药和CVB-D。
2.1.2 改造CVB-D剂型以改善药物释放稳定性 目前,市售黄杨宁片存在药物突释所致的释药不稳定性及需频繁给药[36]等缺点,给患者的生活带来不便。为了增强患者的顺应性,具有控释、缓释作用的剂型近年来受到了极大关注。
王玉华等[37]将CVB-D应用羟丙基-β-环糊精包合后,其溶解度可增加至原来的10.7倍。以此包合物为制剂中间体,加入辅料制成CVB-D包合物微孔渗透泵控释片。其体外释药曲线表明该制剂可以恒速释放CVB-D,体外试药曲线表明在第2、4、6、8、10 h,CVB-D包合物微孔渗透泵控释片的累积释药量约为物理混合物微孔渗透泵控释片的2倍,此剂型使CVB-D释放速度减小,利于维持血药浓度,达到减毒增效的目的。
2.2 改变CVB-D给药方式以提高生物利用度和改善药物释放的稳定性
2.2.1 改变CVB-D给药方式以提高脑内生物利用度 CVB-D具有潜在的脑保护作用,但由于血脑屏障的存在,药物分子很难进入脑内而发挥药效,导致了其较低的脑内利用度。脑靶向的经鼻给药方式可绕开血脑屏障,靶向进入脑内直接发挥作用,为解决这一问题提供了新的思路。
聚山梨酯80是一种表面活性剂,因其结构与低密度脂蛋白类似,能和低密度脂蛋白的受体结合,通过内吞作用进入大脑,常作为脑靶向制剂出现。Wei等[38]采用薄膜蒸发和超声技术合成了CVB-D血管紧张肽-聚山梨醇酯80脂质体包合物(angiopep-conjugated polysorbate 80-coated liposomes,T80-An2-CVB-D-Lps),分别对血脑屏障的体内和体外模型进行给药,评价不同给药方式和载药材料对药效的影响。研究结果表明,与非靶向脂质体和CVB-D溶液相比,T80-An2-CVB-D-Lps对于血脑屏障的穿透能力更强。药效学实验结果表明,对大鼠经鼻腔给予T80-An2-CVB-D-Lps后,脑中曲线下面积含量与血液中AUC含量的比值明显高于其他组,其数值分别为鼻腔给药非靶向制剂组、鼻腔给药CVB-D溶液剂组、尾静脉注射T80-An2-CVB-D-Lps组的1.73、1.26、2.74倍。以上研究结果提示,鼻腔给药T80-An2-CVB-D-Lps具有良好的脑靶向性。
除聚山梨酯80外,壳聚糖作为一种阳离子聚合物,同样可通过血脑屏障达到脑组织中,常作为靶向制剂和缓释制剂的药物载体。魏家保[39]使用离子交联法合成有壳聚糖包裹的CVB-D纳米粒,并评价了不同给药方式(口服、注射和鼻腔)对药动学参数和脑靶向指标的影响。结果表明,鼻腔给药组大鼠的脑局部药动学参数和脑靶向指标最高,与ig组相比,鼻腔给药在血液和脑组织中的绝对生物利用度分别提升了8%、20%。此外,在评估该剂型的靶向性时发现,鼻腔给药纳米粒组大鼠的嗅球、海马、剩余脑组织的药物浓度明显高于鼻腔给药溶液剂组和尾静脉注射纳米粒组,提示CVB-D可通过嗅球通路、体循环和三叉神经通路入脑。以上结果表明,CVB-D纳米粒鼻腔给药有希望研发成脑靶向性制剂。
2.2.2 改变CVB-D给药方式以改善药物释放的稳定性 制成贴剂的药物可经由皮肤吸收入血,避免肝脏的首关效应,更加有助于释药稳定性的提高。基于贴剂的以上优点,周莉玲等[36]采用有机溶剂分散法制得了一种使用安全、疗效稳定的CVB-D控释贴剂。其体外透皮速率常数明显高于参比贴剂,药物透皮曲线提示该剂型可连续48 h恒定地释放药物,维持血药浓度,避免出现波动。药效学实验结果表明该贴剂对于心肌缺血和心律失常的动物模型能发挥预防、治疗的作用,且随着用药剂量的增加,可呈现控释长效的效果。以上贴剂既避免了CVB-D溶解度差导致的低生物利用度,也通过控释技术解决了释药不稳定的缺点,但其相对低的载药量始终是其在中药开发领域的瓶颈之一,因此,其后续研发应注重寻找载药量更高的材料,提升药效。
3 结语
近年来,随着CVB-D衍生化及剂型改造研究的开展,其3-氨基、20-氨基或16-羟基衍生物作用于心血管疾病的有效性已经得以阐明。CVB-D衍生物在耐缺氧、抗心肌缺血、神经保护等方面的活性明显优于母核结构。目前,虽然以CVB-D为主要成分的口服片剂黄杨宁片已经上市,但通过衍生化和剂型改造改善其水溶性和生物利用度,改善肝肠循环引起的释药不稳定性,以及改善脑内生物利用度等方面的研究尚处于探索阶段,将其衍生物进行剂型改造用于治疗心血管疾病依然具有广阔的应用前景。
利益冲突 所有作者均声明不存在利益冲突
[1] 向涛, 杨鸿均, 陈程, 等. 3-C位单取代环维黄杨星D衍生物的合成及其抗耐缺氧活性研究 [J]. 有机化学, 2016, 36(2): 432-436.
[2] 梁秉文, 邓晨安, 王学斌, 等. 黄杨木生物碱Ⅰ、Ⅱ、Ⅲ、Ⅳ的分离与结构研究 [J]. 中国药学杂志, 1981, 16(4): 3-5.
[3] 梁秉文, 张正行, 方泰惠. 黄杨碱与心脑血管疾病 [M]. 北京: 化学工业出版社, 2011: 37.
[4] 陈章强, 胡申江. 糖尿病大鼠心肌力学的改变及环维黄杨星D的影响 [J]. 中国循环杂志, 2013, 28(z1): 27.
[5] 张建华, 许立, 蒋宝平, 等. 运用Micro-PET技术观察环维黄杨星D抗大鼠心肌缺血的实验研究 [J]. 南京中医药大学学报, 2016, 32(4): 359-361.
[6] Guo Q, Guo J, Yang R,. Cyclovirobuxine D attenuates doxorubicin-induced cardiomyopathy by suppression of oxidative damage and mitochondrial biogenesis impairment [J]., 2015, 2015: 151972.
[7] 余海滨, 刘红军, 沈俊岭, 等. 环维黄杨星D-甲醇结晶体对大鼠心室肌细胞内向整流钾电流的影响 [J]. 中药药理与临床, 2013, 29(3): 32-35.
[8] Yu B, Fang T H, Lü G H,. Beneficial effect of cyclovirobuxine D on heart failure rats following myocardial infarction [J]., 2011, 82(6): 868-877.
[9] 操锋, 靳静, 朱雄. 环维黄杨星D在制备预防或治疗缺血性脑卒中药物中的应用: 中国, CN106727605A [P]. 2017-05-31.
[10] 南敏伦, 赫玉芳, 赵昱玮, 等. 环维黄杨星D及组合物的制备方法及医药新用途: 中国, CN104693265A [P]. 2015-06-10.
[11] 唐有元, 邓晨安, 梁秉文. 中国小叶黄杨不同部位中生物碱含量的研究 [J]. 中草药, 1981, 12(3): 43.
[12] 中华人民共和国药典 [S]. 一部. 2020: 1593.
[13] 梁涛, 瞿凌晨, 梁卫, 等. 环维黄杨星D长期给药对大鼠肝脏毒性的研究 [J]. 中药药理与临床, 2013, 29(1): 62-65.
[14] 梁晓雯, 周玲玲, 黄艳, 等. 基因芯片技术研究环维黄杨星D对HK-2细胞毒性作用的机制 [J]. 中南药学, 2011, 9(6): 405-408.
[15] 陈静, 张景勍, 赵华, 等. 环维黄杨星D羟丙基-β-环糊精包合物理化性质与大鼠口服生物利用度 [J]. 重庆医科大学学报, 2017, 42(2): 200-204.
[16] Qiu Y, Yin Q, Fei Y,. JLX001 modulated the inflammatory reaction and oxidative stress in pMCAO rats via inhibiting the TLR2/4-NF-κB signaling pathway [J]., 2019, 44(8): 1924-1938.
[17] 曹捷, 高帆, 周战, 等. 一种药物原料及其制剂和用途: 中国, CN103172692A [P]. 2013-06-26.
[18] 上海壹志医药科技有限公司. 小叶黄杨碱衍生物的盐: 中国, CN103288912A [P]. 2013-09-11.
[19] Yan Y Y, Ao L Y, Zhou L,. Therapeutic effects of JLX001 on cerebral ischemia through inhibiting platelet activation and thrombus formation in rats [J]., 2018, 106: 805-812.
[20] Zhou L, Ao L Y, Yan Y Y,. JLX001 ameliorates ischemia/reperfusion injury by reducing neuronal apoptosis via down-regulating JNK signaling pathway [J]., 2019, 418: 189-204.
[21] Ao L Y, Li W T, Zhou L,. Therapeutic effects of JLX-001 on ischemic stroke by inducing autophagy via AMPK-ULK1 signaling pathway in rats [J]., 2019, 153: 162-170.
[22] Zhao B, Zhu J, Fei Y,. JLX001 attenuates blood-brain barrier dysfunction in MCAO/R rats via activating the Wnt/β-catenin signaling pathway [J]., 2020, 260: 118221.
[23] 孙贝贝, 向涛, 杨鸿均, 等. 环维黄杨星D的结构修饰及耐缺氧活性的研究 [J]. 华西药学杂志, 2016, 31(6): 553-555.
[24] 蔡苹. 一类具有丹参酮IIA和环维黄杨星D复合结构化合物的制备及其在防止心血管类疾病的应用: 中国, CN106146605A [P]. 2016-11-23.
[25] 高署, 彭家仕, 孙宏张, 等. 环维黄杨星D衍生物、其制备方法及其用途: 中国, CN102286054A [P]. 2011-12-21.
[26] 南敏伦, 赫玉芳, 赵昱玮, 等. 环维黄杨星D衍生物制备方法及医药新用途: 中国, CN105601697A [P]. 2016-05-25.
[27] 张羽, 连治国, 徐明波, 等. 聚乙二醇衍生物及其蛋白药物修饰研究进展 [J]. 药学实践杂志, 2018, 36(4): 301-306.
[28] 徐立华, 赵宣, 冯泽旺, 等. 具有提高的药物生物活性的低分子量聚乙二醇药物结合物: 中国, CN104208715A [P]. 2014-12-17.
[29] 徐立华, 马永婷, 邢精红, 等. 聚乙二醇化环维黄杨星D对大鼠长期给药肝、肾毒性研究 [J]. 中国中医药信息杂志, 2011, 18(5): 35-37.
[30] 陈静, 张景勍, 何丹, 等. 环维黄杨星D磷脂复合物药代动力学评价 [J]. 第二军医大学学报, 2016, 37(1): 17-21.
[31] 陈静. 环维黄杨星D羟丙基-β-环糊精磷脂复合物的研究 [D]. 重庆: 重庆医科大学, 2016.
[32] 张景勍, 雷婷婷, 赵华, 等. 一种明显提高难溶性药物生物利用度的水包油型纳米乳及其制备方法: 中国, CN106038488B [P]. 2019-08-23.
[33] 张景勍, 陈静, 蒋心惠, 等. 一种明显提高难溶性药物生物利用度的油包水型纳米乳及其制备方法: 中国, CN105997875B [P]. 2019-05-21.
[34] 杨建宏, 韩天燕, 张万年, 等. 一种环维黄杨星D纳米制剂及其制备方法: 中国, CN110051633A [P]. 2019-07-26.
[35] 南敏伦, 赫玉芳, 赵昱玮, 等. 环维黄杨星D固体分散体制备方法及其医药新用途: 中国, CN109078002A [P]. 2018-12-25.
[36] 周莉玲, 魏敏, 于洋, 等. 一种防治心血管系统疾病的控释透皮贴剂及其制备方法: 中国, CN101810596A [P]. 2010-08-25.
[37] 王玉华, 杨海燕, 郝海军. 环维黄杨星D包合物微孔渗透泵控释片的制备及处方优化 [J]. 中成药, 2020, 42(10): 2555-2560.
[38] Wei H, Liu T, Jiang N,. A novel delivery system of cyclovirobuxine D for brain targeting: Angiopep-conjugated polysorbate 80-coated liposomes via intranasal administration [J]., 2018, 14(7): 1252-1262.
[39] 魏家保. 环维黄杨星D纳米粒的制备与脑靶向性评价 [D]. 广州: 广州中医药大学, 2016.
Reaearch progress on structural modification of cyclovirobuxine D and dosage form improvement of Huangyangning Tablets
GAO Chang, RUAN Jing-ya, ZHANG Zi-xin, WU Li-jie, WANG Tao, ZHANG Yi
Tianjin Key Laboratory of Traditional Chinese Medicinal Chemistry and Analytical Chemistry, Tianjin University of Traditional Chinese Medicine, Tianjin 300167, China
As the main active constituent ofandplants, cyclovirobuxine D (CVB-D) has a variety of pharmacological effects such as cardio-cerebrovascular protection. Huangyangning Tablets (黄杨宁片), a commonly used clinical drug with CVB-D as its main ingredient, has a clear therapeutic effect on coronary heart disease and angina pectoris. However, in the process of clinical application, it was discovered that Huangyangning Tablets, as an oral tablet, had the disadvantages of poor water solubility, low bioavailability, multiple absorption sites in the gastrointestinal tract, unstable drug release, difficulty in penetrating the blood-brain barrier, as well as heart accumulation, liver and kidney toxicity, etc. Therefore, it is necessary to solve the above-mentioned problems through structural modification and/or dosage form change. Reaearch progress on structural modification of cyclovirobuxine D and dosage form improvement of Huangyangning Tablets are reviewed in this paper, in order to provide theoretical basis for its further research and development.
cyclovirobuxine D; derivative; structural modification; Huangyangning Tablets; dosage form improvement; prevention and treatment of cardiovascular and cerebrovascular diseases
R284.3
A
0253 - 2670(2021)17 - 5437 - 08
10.7501/j.issn.0253-2670.2021.17.035
2021-07-08
国家自然科学基金面上项目(82074118)
高 畅(1997—),女,硕士研究生。Tel: (022)59596163 E-mail: GC087159@163.com
王 涛,沈阳药科大学57期日语药学专业校友,研究员,天津中医药大学研究生院院长,国务院政府特殊津贴获得者、教育部新世纪优秀人才、杰出津门学者,研究方向为中药药效物质基础研究。Tel: (022)59596163 E-mail: wangtao@tjutcm.edu.cn
张 祎,沈阳药科大学61期药物分析专业校友,教授,博士生导师,教育部新世纪优秀人才,天津市131人才一层次人选,天津市高校“学科领军人才培养计划”人选,主持了5项国家级课题;获得天津市科技进步二等奖及教育部科技进步奖共3项;研究方向为中药药效物质基础研究。Tel: (022)59596163 E-mail: zhwwxzh@tjutcm.edu.cn
[责任编辑 崔艳丽]
