酥脆掘海绵Dysidea fragilis中杂萜类化学成分
2021-09-06尚如意许婷婷林厚文焦伟华
尚如意,许婷婷,林厚文*,焦伟华*
酥脆掘海绵Dysidea fragilis中杂萜类化学成分
尚如意1,许婷婷2,林厚文1*,焦伟华1*
1. 癌基因与相关基因国家重点实验室海洋药物研究中心,上海交通大学医学院附属仁济医院,上海 200127 2. 沈阳药科大学中药学院,辽宁 沈阳 110016
研究酥脆掘海绵中杂萜类化学成分。采用硅胶柱色谱、反相ODS中压柱色谱以及半制备高效液相色谱等多种色谱技术进行分离纯化,所获得化合物采用HRMS、NMR等波谱方法进行鉴定,绝对构型则通过量子化学计算(ECD)法确定。从酥脆掘海绵的95%乙醇提取物中分离得到了3个杂萜类化合物和1个二萜类化合物,分别鉴定为酥脆内酯(1)、黑麦草内酯(2)、cavernosine(3)和dictyol E(4)。化合物1为新化合物,首次对化合物2的核磁数据进行了全归属,纠正了其C-6和C-8位碳信号归属的错误。
酥脆掘海绵;杂萜;酥脆内酯;黑麦草内酯;海洋天然产物
海绵是一种低等多细胞动物,因其能产生结构新颖、活性显著的天然产物而受到国内外学者的广泛关注[1]。采自中国南海的酥脆掘海绵Montagu属于寻常海绵纲、网角海绵目、掘海绵科动物。掘属Montagu海绵广泛分布于亚热带、热带海域,从该属海绵中分离得到了萜类[2-4]、生物碱[5-8]、环肽[9]、大环内酯[10-12]以及甾体[13-16]类化合物,部分化合物显示出抗肿瘤[17-19]、抗病毒[20-22]、抗菌[23-25]、抗炎[26-27]等生物活性。
本研究对酥脆掘海绵中杂萜类化学成分进行了分离鉴定,综合采用硅胶柱色谱、反相ODS中压柱色谱以及半制备高效液相色谱等多种分离方法,从95%乙醇提取物中分离得到了3个杂萜类化合物和1个二萜类化合物,采用HRMS、NMR等波谱方法进行结构鉴定,绝对构型则通过量子化学计算(ECD)法确定,化合物分别鉴定为酥脆内酯(fragiloid,1)、黑麦草内酯(loliolide,2)、cavernosine(3)和dictyol E(4)。结构见图1。其中,化合物1为新化合物,首次对化合物2的核磁数据进行了全归属。
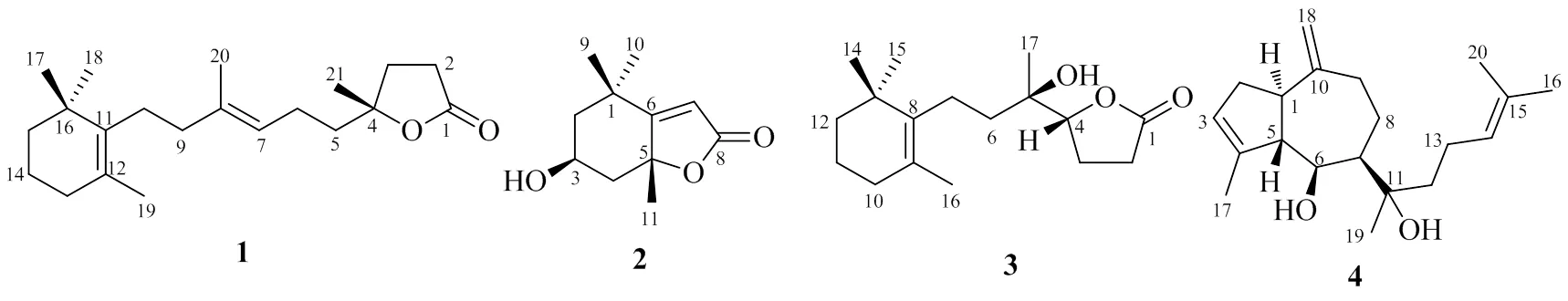
图1 化合物1~4的结构
1 仪器与材料
Bruker AVANCE-600型核磁共振仪(Bruker公司);Waters Xevo G2-XS Q-Tof、Waters Q-Tof micro YA019液质联用色谱仪(美国Waters公司);Waters 1525/2996制备高效液相色谱仪(美国Waters公司);半制备HPLC色谱柱:半制备色谱柱为YMC-Pack Pro C18RS(250 mm×10 mm,5 μm);Interchim puriflash 450 instruments中压色谱仪(Interchim公司);三泰SW-5223-120-SP C18快速分离柱(15 μm,孔径10 nm);柱色谱硅胶(200~300、300~400目,青岛海洋化工有限公司);GF254硅胶板(烟台江友硅胶开发有限公司);分析级甲醇、二氯甲烷、乙腈,上海凌峰化学试剂有限公司;色谱纯乙腈、甲醇,Merck公司。
海绵样本于2011年4月采自西沙群岛永兴岛,由中国科学院海洋研究所研究员李锦和鉴定为酥脆掘海绵Montagu,标本(编号XD10403)存放于上海交通大学医学院附属仁济医院的癌基因与相关基因国家重点实验室海洋药物研究中心。
2 提取与分离
酥脆掘海绵(湿质量600 g)用95%乙醇室温渗漉提取,提取液减压浓缩之后获得12.3 g浸膏。浸膏悬浮于0.5 L水中,用同体积二氯甲烷萃取3次,获得二氯甲烷层(6.5 g),经正相硅胶柱色谱,正己烷-醋酸乙酯(100∶0、99∶1、95∶5、9∶1、8∶2、7∶3、6∶4、1∶1、0∶1)梯度洗脱获得8个馏分(F1~F8)。对馏分F4和F5进行ODS中压柱色谱分离,采用10%~100%甲醇溶液梯度洗脱,然后再以90%甲醇进行半制备高效液相色谱分离纯化,从F4中获得化合物2(2.4 mg,R=35 min)和3(4.8 mg,R=40 min),以87%甲醇从F5中获得了化合物1(1.2 mg,R=38 min)和4(10.9 mg,R=30 min)。
3 结构鉴定
化合物1的1H-NMR (600 MHz, CDCl3) 在H0.99 (3H, s), 0.99 (3H, s), 1.59 (3H, s), 1.64 (3H, s), 1.40 (3H, s) 处显示出5个甲基单峰信号,在H5.11 (1H, m) 处显示出1个烯氢质子信号,在H2.60 (2H, m) 处显示出与羰基或烯碳相连的亚甲基氢信号。化合物1的13C-NMR (150 MHz, CDCl3) 和DEPT135谱(表1)显示出1个酯羰基碳信号 (C176.8)、4个烯烃信号 (C122.4和137.0、C137.1和127.0)、1个连氧季碳信号 (C86.7)、5个甲基碳信号 (C28.6, 28.6, 19.8, 16.0和25.6)、9个亚甲基碳信号 (C29.1, 33.0, 40.9, 22.4, 40.2, 27.8, 32.7, 19.5, 39.8) 和1个季碳信号 (C35.0)。
化合物1的1H-1H COSY谱显示出4组相互偶合的氢信号:H2-2/H2-3、H2-5/H2-6/H-7、H2-9/H2-10和H2-13/H2-14/H2-15,提示有4个自旋偶合系统的存在:CH2-2-CH2-3、CH2-5-CH2-6-CH-7、CH2-9-CH2-10和CH2-13-CH2-14-CH2-15(图2)。在HMBC谱中,17-CH3与C-15、C-16、C-18有相关,18-CH3与C-11、C-16、C-17有相关,19-CH3与C-11、C-12、C-13有相关,结合COSY推导出的片段CH2-13-CH2- 14-CH2-15,推导出1个含有3个甲基取代的环己烯结构,17-CH3和18-CH3位于C-16位,19-CH3位于C-12位。亚甲基H2-2与羰基碳C-1和连氧季碳C-4之间有HMBC相关,21-CH3与C-3、C-4、C-5之间有HMBC相关,结合COSY片段推导出的片段CH2-2-CH2-3,提示化合物1结构存在1个连接有甲基和侧链的五元内酯环结构,甲基连接在连氧碳C-4位上,COSY片段推导出的片段CH2-5-CH2-6-CH-7通过C-4与五元内酯环相连。20-CH3与C-7、C-8、C-9之间有HMBC相关,可以将COSY推导出的2个片段CH2-5-CH2-6-CH-7和CH2-9-CH2-10通过烯烃季碳C-8连接在一起,并且可以确定20-CH3在C-8位。亚甲基H2-10与环己烯环上的烯烃季碳C-11有HMBC相关,提示片段CH2-9-CH2-10通过C-11连接在环己烯环上,从而确定了化合物1的平面结构如图2所示。
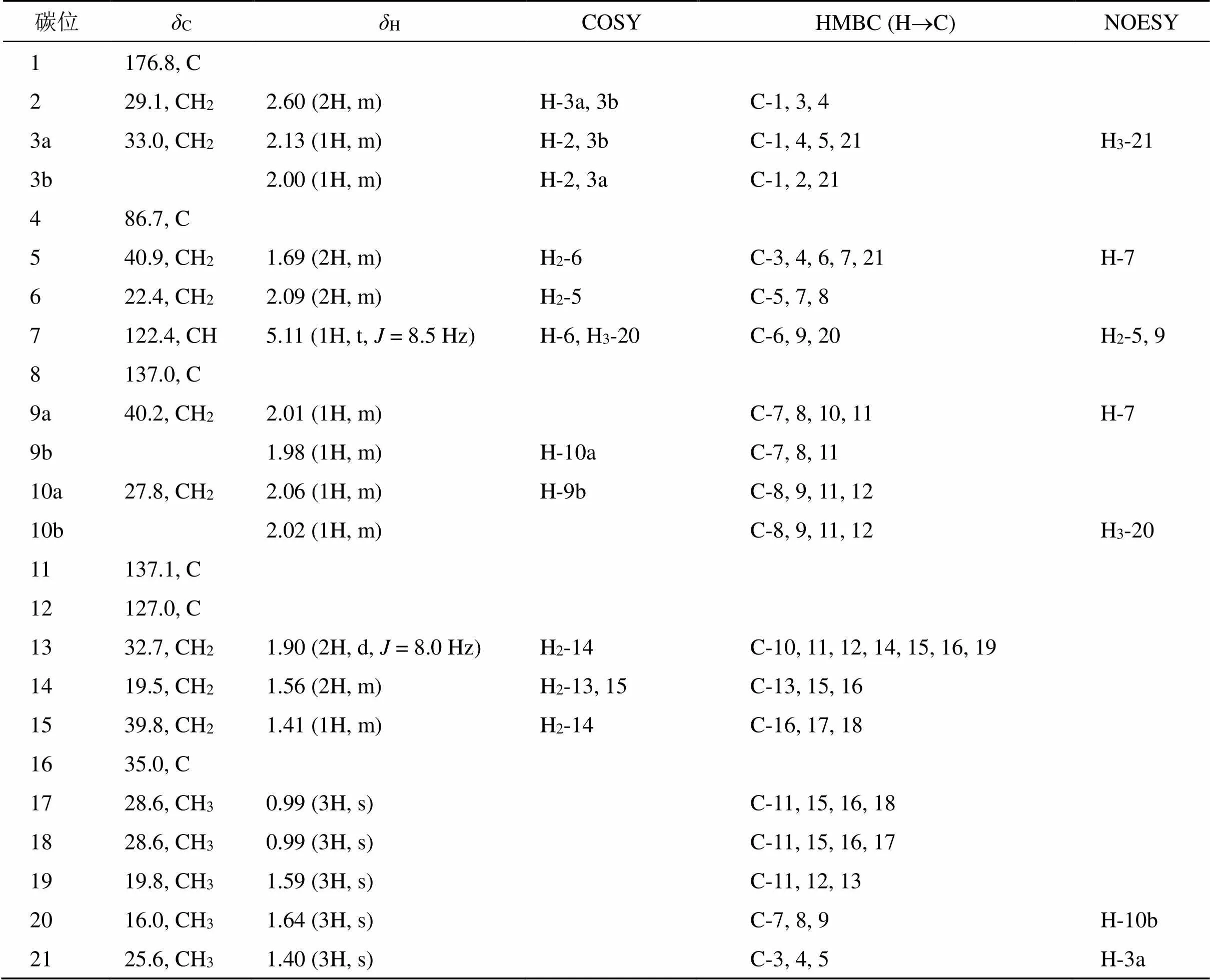
表1 化合物1的氢谱、碳谱和二维谱数据 (600/150 MHz, CDCl3)
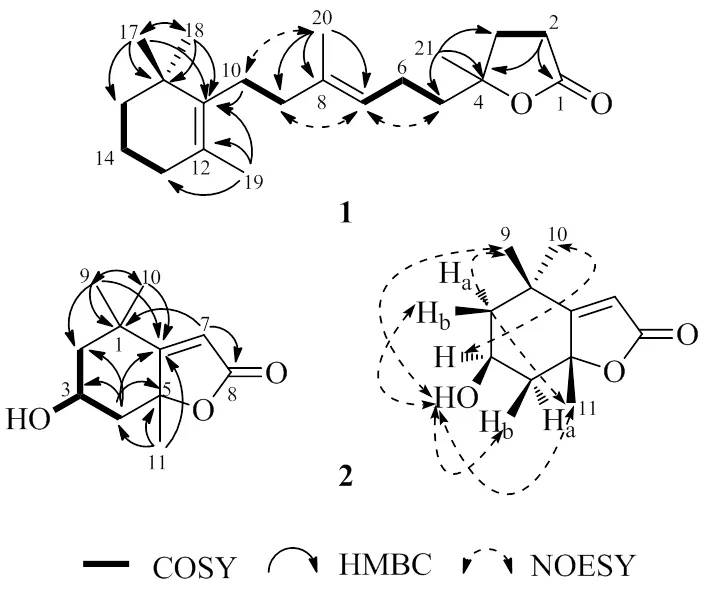
图2 化合物1和2的主要HMBC和NOESY相关
化合物1中双键的构型是通过NOESY谱确定的。H-7和H2-9之间、H-7和H2-5之间以及H2-10和H3-20之间存在ROESY相关,从而确定双键D8, 9为型(图2)。化合物1中手性碳C-4的绝对构型是通过比较实测ECD和计算ECD谱来确定的(图3),实测ECD (MeOH) 光谱在204 nm (D+7.8) 处有正性Cotton效应,与4-1a的计算光谱基本一致,由此可以确定C-4的构型为型。通过检索SciFinder,发现该化合物为未见文献报道的新化合物,命名为酥脆内酯。
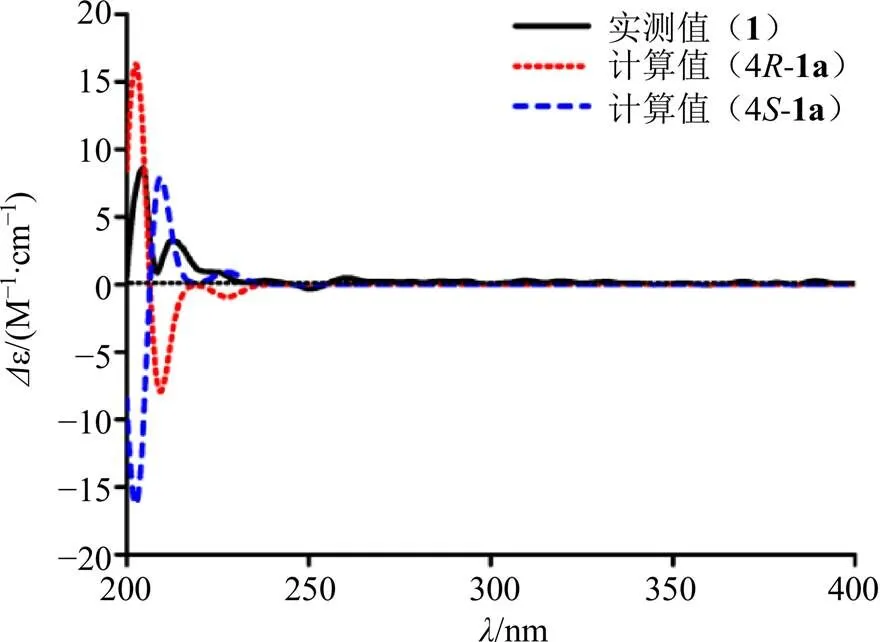
图3 化合物1的ECD实测值与计算值
化合物2:根据文献中报道的核磁数据,化合物2鉴定为黑麦草内酯[28]。仔细分析13C-NMR核磁数据发现文献中报道的C-6和C-8的碳化学位移有异常[28],因此对该化合物进行了二维核磁数据的全归属(表2)。化合物2的1H-NMR (600 MHz, DMSO-6) 在H5.78处显示1个单峰烯烃氢信号,在H4.99 (H,= 3.0 Hz) 处显示1个羟基氢信号,在H1.37, 1.19, 1.66处显示出3个单峰甲基信号。此外还显示出如下氢信号H1.42 (1H, dd,= 14.4, 3.6 Hz), 1.87 (1H, dt,= 14.4, 3.0 Hz), 1.63 (1H, dd,= 13.2, 3.0 Hz), 2.29 (1H, dt,= 13.2, 3.0 Hz)。化合物2的13C-NMR (150 MHz, DMSO-6) 和DEPT135谱显示出11个碳信号(表2),分别为1个酯羰基碳信号 (C171.7)、1个烯烃季碳信号 (C183.1)、1个烯烃次甲基碳信号 (C112.1)、1个连氧季碳信号 (C86.5)、1个连氧次甲基碳信号 (C64.9)、3个甲基碳信号 (C26.2、30.4和26.9)、2个亚甲基碳信号 (C45.3和46.6) 和1个季碳信号 (C35.7)。
化合物2的1H-1H COSY谱中,H2-2/H-3/ H2-4/3-OH的相关提示CH2-2-CH(OH)-3-CH2-4自旋偶合系统的存在。HMBC谱中,甲基H3-9与C-1、C-2、C-6、C-10之间有相关,甲基H3-10与C-1、C-2、C-6、C-9之间有相关,甲基H3-11与C-4、C-5、C-6之间有相关,从而确定六元环的存在,同时确定了甲基H3-9和H3-10位于C-1位,甲基H3-11位于C-5位。烯烃氢信号H-7与C-1、C-5、C-6和C-8之间有相关,提示结构中存在1个a,b-不饱和-g-丁内酯结构,并且通过C-5和C-6与六元环骈合在一起,从而最终确定了该化合物的平面结构。通过对NOESY光谱数据的分析可以确定3-OH和CH3-11均处于b-构型(图2)。通过对黑麦草内酯(2)碳氢数据的全归属,确定了C-6和C-8位的化学位移分别为C183.1和171.7,更正了文献中对这2个碳信号归属的错误[28]。
化合物3:白色无定形粉末,1H-NMR (600 MHz,CDCl3): 4.35 (1H, t,= 7.8 Hz, H-4), 2.59 (1H, dd,= 10.2, 4.2 Hz, H-2a), 2.56 (1H, m, H-2b), 2.28 (1H, m, H-7a), 2.17 (1H, m, H-7b), 2.16 (1H, m, H-3a),2.01 (1H, td,= 13.2, 5.4 Hz, H-3b), 1.90 (2H, t,= 5.4 Hz, H-10), 1.59 (1H, m, H-11a), 1.59 (3H, s, 16-CH3), 1.54 (1H, m, H-11b), 1.52 (1H, m, H-6a), 1.47 (1H, m, H-6b), 1.41 (2H, m, H-12), 1.35 (3H, s, 17-CH3), 1.00 (3H, s, 14-CH3), 0.98 (3H, s, 15-CH3);13C-NMR (150 MHz, CDCl3): 177.3 (C-1), 136.2 (C-8), 127.6 (C-9), 85.6 (C-4), 73.1 (C-5), 39.8 (C-12), 36.9 (C-6), 35.0 (C-13), 32.7 (C-10), 29.0 (C-2), 28.7 (C-14), 28.6 (C-15), 23.3 (C-17), 22.0 (C-7), 21.8 (C-3), 19.7 (C-16), 19.4 (C-11)。以上波谱数据与文献报道基本一致[29],故鉴定化合物3为cavernosine。
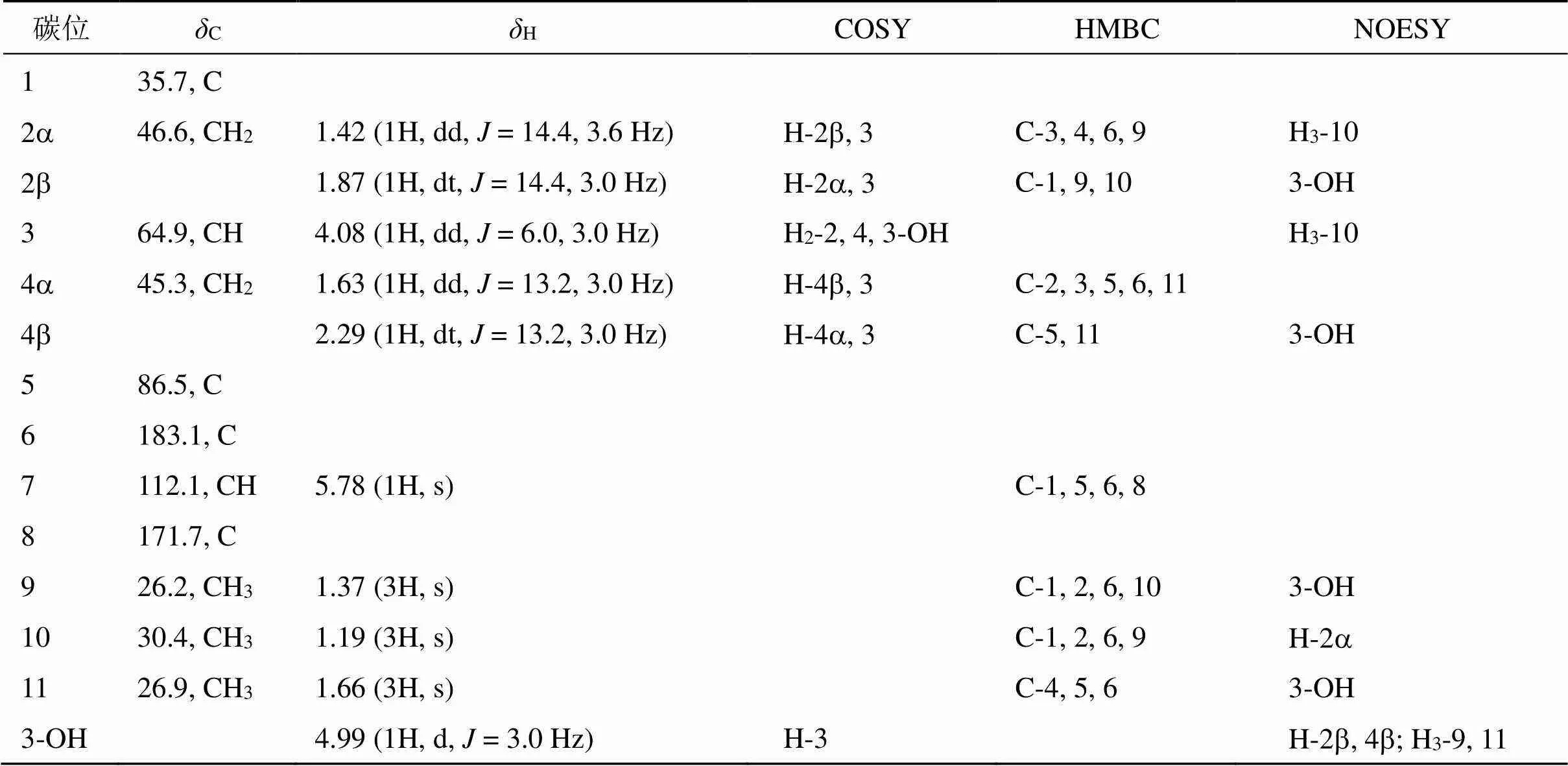
表2 化合物2的氢谱、碳谱和二维谱数据(600/150 MHz, CDCl3)
化合物4:白色无定形粉末,1H-NMR (600 MHz, CDCl3): 5.35 (1H, s, H-3), 5.16 (1H, t,= 6.6 Hz, H-14), 4.79 (1H, s, H-18a), 4.76 (1H, s, H-18b), 4.20 (1H, dd,= 7.8, 3.0 Hz, H-6), 2.69 (1H, ddd,= 12.0, 4.8, 2.4 Hz, H-7a), 2.61 (1H, q,= 9.0 Hz, H-1), 2.51 (1H, m, H-2a), 2.38 (1H, t,= 9.0 Hz, H-5), 2.22 (1H, dd,= 15.6, 7.2 Hz, H-2b), 2.14 (1H, d,= 10.8 Hz, H-7b), 2.12 (1H, d,= 10.8 Hz, H-13a), 2.03 (1H, m, H-13b), 1.82 (3H, s, 17-CH3), 1.78 (1H, dt,= 14.4, 4.8 Hz, H-8a), 1.74 (2H, t,= 10.8 Hz, H-12), 1.71 (1H, m, H-8b), 1.69 (3H, s, 16-CH3), 1.66 (1H, td,= 8.4, 3.0 Hz, H-7), 1.62 (3H, s, 20-CH3), 1.24 (3H, s, 19-CH3);13C-NMR (150 MHz, CDCl3): 152.0 (C-10), 140.8 (C-4), 132.0 (C-15), 124.4 (C-14), 124.3 (C-3), 107.6 (C-18), 76.3 (C-11), 74.4 (C-6), 60.4 (C-5), 48.7 (C-7), 46.1 (C-1), 40.9 (C-12), 40.6 (C-9), 33.8 (C-2), 25.7 (C-16), 25.4 (C-19), 23.3 (C-13), 21.6 (C-8), 17.5 (C-20), 15.8 (C-17)。以上波谱数据与文献报道基本一致[30],故鉴定化合物4为dictyol E。
利益冲突 所有作者均声明不存在利益冲突
[1] 薛松, 赵权宇, 张卫, 等. 中国海绵天然产物的研究 [J]. 天然产物研究与开发, 2003, 15(4): 359-363.
[2] 代树文, 徐彬, 田园, 等. 南海海绵sp.中倍半萜类次生代谢产物 [J]. 中山大学学报: 自然科学版, 2017, 56(4): 91-96.
[3] 邱彦, 邓志威, 裴月湖, 等. 中国南海海绵中二倍半萜类化学成分 [J]. 中国天然药物, 2003, 1(3): 137-141.
[4] Ciaglia E, Malfitano A, Laezza C,. Immuno-modulatory and anti-inflammatory effects of dihydrogracilin A, a terpene derived from the marine sponge[J]., 2017, 18(8): 1643.
[5] 田祥云, 何山, 丁立建.属海绵化学成分及生物活性研究新进展 [J]. 天然产物研究与开发, 2018, 30(7): 1274-1279.
[6] 宋淑梅, 郑亚旭, 佟长青, 等. 澳大利亚厚皮海绵化学成分分离鉴定及其抗肿瘤活性研究 [J]. 大连海洋大学学报, 2016, 31(4): 426-430.
[7] Wang D D, Jiang W, Kim C K,. Neopetrothiazide: an intriguing pentacyclic thiazide alkaloid from the spongesp [J]., 2021, 23(9): 3278-3281.
[8] Prebble D W, Holland D C, Robertson L P,. Citronamine A, an antiplasmodial isoquinoline alkaloid from the Australian marine sponge[J]., 2020, 22(24): 9574-9578.
[9] Hedner E, Sjögren M, Hodzic S,. Antifouling activity of a dibrominated cyclopeptide from the marine sponge[J]., 2008, 71(3): 330-333.
[10] Paterson I, Dalby S M, Roberts J C,. Leiodermatolide, a potent antimitotic macrolide from the marine spongesp [J]., 2011, 50(14): 3219-3223.
[11] Erickson K L, Beutler J A, Cardellina II J H,. Salicylihalamides A and B, novel cytotoxic macrolides from the marine spongesp [J]., 1997, 62(23): 8188-8192.
[12] Nishimura S, Matsunaga S, Yoshida M,. 13-Deoxytedanolide, a marine sponge-derived antitumor macrolide, binds to the 60S large ribosomal subunit [J]., 2005, 13(2): 449-454.
[13] 孙见凡, 李云秋, 杨斌, 等. 软海绵属海绵sp. 甾体类化学成分研究 [J]. 热带海洋学报, 2013, 32(1): 55-59.
[14] 刘东, 林文翰, 邓志威, 等. 中国南海海绵sp.中的甾体化合物 [J]. 沈阳药科大学学报, 2010, 27(3): 191-194.
[15] 梁秋, 廖小建, 李浩华, 等. 海绵sp. 中的两个甾体化合物 [J]. 光谱实验室, 2009, 26(4): 990-992.
[16] Wang K Y, Li P L, Sun J F,. Four new polyhydroxylated steroids from the South Sea spongesp [J]., 2020, 18(11): 844-849.
[17] Hertiani T, Edrada-Ebel R, Ortlepp S,. From anti-fouling to biofilm inhibition: New cytotoxic secondary metabolites from two Indonesiansponges [J]., 2010, 18(3): 1297-1311.
[18] 王增蕾, 熊巍, 林厚文, 等. 南海细薄星芒海绵抗肿瘤活性成分研究 (II) [J]. 中国海洋药物, 2006, 25(4): 11-16.
[19] Shubina L K, Makarieva T N, von Amsberg G,. Monanchoxymycalin C with anticancer properties, new analogue of crambescidin 800 from the marine sponge[J]., 2019, 33(10): 1415-1422.
[20] Chang, Whittaker N F, Bewley C A. Crambescidin 826 and dehydrocrambine A: New polycyclic guanidine alkaloids from the marine spongesp. that inhibit HIV-1 fusion [J]., 2003, 66(11): 1490-1494.
[21] Shin H J, Rashid M A, Cartner L K,. Stellettapeptins A and B, HIV-inhibitory cyclic depsipeptides from the marine spongesp [J]., 2015, 56(28): 4215-4219.
[22] Nakao Y, Takada K, Matsunaga S,. Calyceramides A-C: Neuraminidase inhibitory sulfated ceramides from the marine sponge[J]., 2001, 57(15): 3013-3017.
[23] Sun S, Canning C B, Bhargava K,. Polybrominated diphenyl ethers with potent and broad spectrum antimicrobial activity from the marine sponge[J]., 2015, 25(10): 2181-2183.
[24] Tsukamoto S, Yamashita T, Matsunaga S,. Stellettazole A: An antibacterial guanidinoimidazole alkaloid from a marine spongesp [J]., 1999, 40(4): 737-738.
[25] Zhang X, Xu H Y, Huang A M,. Antibacterial meroterpenoids from the South China sea spongesp [J]., 2016, 64(7): 1036-1042.
[26] De Marino S, Festa C, D'Auria M V,. Coscinolactams A and B: New nitrogen-containing sesterterpenoids from the marine spongeexerting anti-inflammatory properties [J]., 2009, 65(15): 2905-2909.
[27] Festa C, De Marino S, Sepe V,. Perthamides C and D, two new potent anti-inflammatory cyclopeptides from a Solomon Lithistid sponge[J]., 2009, 65(50): 10424-10429.
[28] Valdes L J III. Loliolide from[J]., 1986, 49(1): 171.
[29] Zhang X W, Li P L, Qin G F,. Isolation and absolute configurations of diversiform C17, C21 and C25 terpenoids from the marine spongesp [J]., 2018, 17(1): 14.
[30] Ovenden S P, Nielson J L, Liptrot C H,. Update of spectroscopic data for 4-hydroxydictyolactone and dictyol E isolated from a-sp. assemblage [J]., 2012, 17(3): 2929-2938.
Meroterpenoid constituents from marine sponge
SHANG Ru-yi1, XU Ting-ting2, LIN Hou-wen1, JIAO Wei-hua1
1. Research Center for Marine Drugs, State Key Laboratory of Oncogenes and Related Genes, Department of Pharmacy, Ren Ji Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200127, China 2. School of Traditional Chinese Materia Medica, Shenyang Pharmaceutical University, Shenyang 110016, China
To study the chemical constituents of meroterpenoids from the sponge.Silica gel column chromatography, reverse phase ODS medium pressure column chromatography and semi-preparative high performance liquid chromatography were used for separation and purification. The obtained compounds were identified by HRMS, NMR and other spectral methods, and the absolute configuration was determined by comparison of the experimental and calculated ECD spectra.Four meroterpenoids were isolated from the 95% ethanol extract of the sponge, which were identified as fragiloid (1), loliolide (2), cavernosine (3), and dictyol E (4).Compound 1 is a new compound. The NMR data of compound 2 has been fully assigned for the first time, and the mistake in the assignment of its carbon signal has been corrected.
Montagu; meroterpenoid; fragiloid; loliolide; marine natural product
R284.1
A
0253 - 2670(2021)17 - 5192 - 06
10.7501/j.issn.0253-2670.2021.17.009
2021-06-18
国家自然科学基金资助项目(82022068);国家自然科学基金资助项目(41576130)
尚如意,硕士研究生,从事海洋天然产物研究。Tel: (021)68383339 E-mail: florashang@foxmail.com
林厚文,沈阳药科大学1995级博士药物化学专业校友。教授,博士生导师,国家杰出青年基金获得者、教育部长江学者,研究方向为海洋药物。E-mail: franklin67@126.com Tel: (021)68383346
焦伟华,沈阳药科大学68期药学专业校友。副研究员,博士生导师,国家优青,上海市青年科技启明星,上海交通大学晨星青年学者,研究方向为海洋药源分子的结构与功能。E-mail: weihuajiao@hotmail.com Tel: (021)68383339
[责任编辑 王文倩]
