以人参为基源的创新药物研究与开发——人参皂苷综合技术开发方案
2021-09-06李平亚刘金平王翠竹
李平亚,冯 浩,刘金平,王翠竹,李 卓*
以人参为基源的创新药物研究与开发——人参皂苷综合技术开发方案
李平亚1,冯 浩2,刘金平1,王翠竹1,李 卓1*
1. 吉林大学药学院,吉林 长春 130021 2. 吉林大学基础医学院,吉林 长春 130021
人参e作为“百草之王”,药用历史悠久,随着科学研究的不断深入,人参的药学物质基础更加明确,药理活性更加清晰,作用机制不断阐明。以人参为基源的创新药物研究与开发步入了快车道,尤其是人参皂苷综合开发技术方案的提出,为人参皂苷创新药物的开发提供了新的思路,必将产生系列治疗心脑血管疾病、治疗神经系统疾病、提高免疫功能及抗肿瘤等方面的创新药物,提升人参产业的高科技含量,促进大健康产业的高质量发展。
人参;人参皂苷;达玛烷型;齐墩果酸型;奥克梯隆型;创新药物;研究与开发
人参eC. A. Meyer为五加科人参属植物,因其极高的药用价值备受中西医推崇。早在《神农本草经》中就有记载:“人参主补五脏,安精神,定魂魄,止惊悸,除邪气,明目,开心益智,久服轻身延年”。2012年我国正式批准人参为新资源食品,从而人参作为药食两用天然资源,迎来了产业发展的新时代,扩大了人参的应用范围,延长了人参的产业链。人参富含人参皂苷类、人参多糖类、人参多肽类、甾醇类、蛋白质、氨基酸、黄酮类、核苷酸类、有机酸类、维生素类及无机元素营养成分及功能因子,是人参作为“百草之王”的物质基础。自20世纪50年代以来,人参的科学研究取得了长足的发展,围绕人参种植及新品质培养、药理药化及毒理、入血成分及作用机制、结构修饰及创新药物开发等方面取得了丰硕成果,其中《中国人参》《人参皂苷NMR标准图谱》[1]、《人参营养成分及功能因子》[2]及[3]等专著代表了人参不同研究领域的科技结晶。
人参皂苷是人参的主要营养成分及功能因子。目前人参属植物中分离出的人参皂苷约有300种[4],而从人参不同部位发现的人参皂苷(元)及结构修饰人参皂苷(元)200余种,在食品、保健品及药品中应用广泛,尤其在创新药物开发领域具有良好的临床应用前景。近年来围绕人参皂苷创新药物开发开展的大量研究取得了许多重大科研进展。
1 人参皂苷的结构和药理作用
人参皂苷属于三萜类皂苷,根据母核的不同分为达玛烷型、齐墩果酸型和奥克梯隆型人参皂苷(图1)。其中达玛烷型人参皂苷母核为四环三萜,又依据C-6位是否有取代基分为人参二醇组皂苷和人参三醇组皂苷。齐墩果酸型人参皂苷属于五环三萜皂苷,是以齐墩果酸为母核的人参皂苷。而奥科梯隆型人参皂苷是达玛烷型人参皂苷侧链含有含氧五元环的三萜皂苷,是西洋参特有的人参皂苷类型。
人参皂苷的药理作用主要表现在保护心脏[5]、抗肿瘤[6]、缓解糖尿病及并发症[7]、保护神经系统[8]等方面(表1),这些疾病都具有成因复杂的特点。其中氧化应激反应以及炎症反应广泛存在于发病部位,是共性的机制。而人参皂苷的抗氧化与抗炎活性已被大量的实验数据所证实[9-11]。多种人参皂苷也可通过抑制心肌细胞凋亡[12-15]、维持线粒体的功能以及减轻钙超载[16-17]等方面保护心脏、缓解冠心病。人参皂苷对包括胃癌、肺癌、肝癌等10种肿瘤具有显著的抑制作用。人参皂苷通过抑制肿瘤细胞增殖[18-23]、诱导肿瘤细胞凋亡[24-30]、增强人体对于肿瘤细胞的免疫反应[31-33]以及抑制肿瘤细胞的侵袭与转移[34-41]等机制达到抗肿瘤的目的。且人参皂苷与其他药物联合应用可增强其抗肿瘤效果[42-43]。人参皂苷对于阿尔茨海默病、帕金森等由神经细胞病变导致的疾病也具有显著的缓解作用[44-54]。另外,多种人参皂苷能够从不同机制缓解多种糖尿病并发症,其中涉及心脏、神经等多个系统[55-60]。
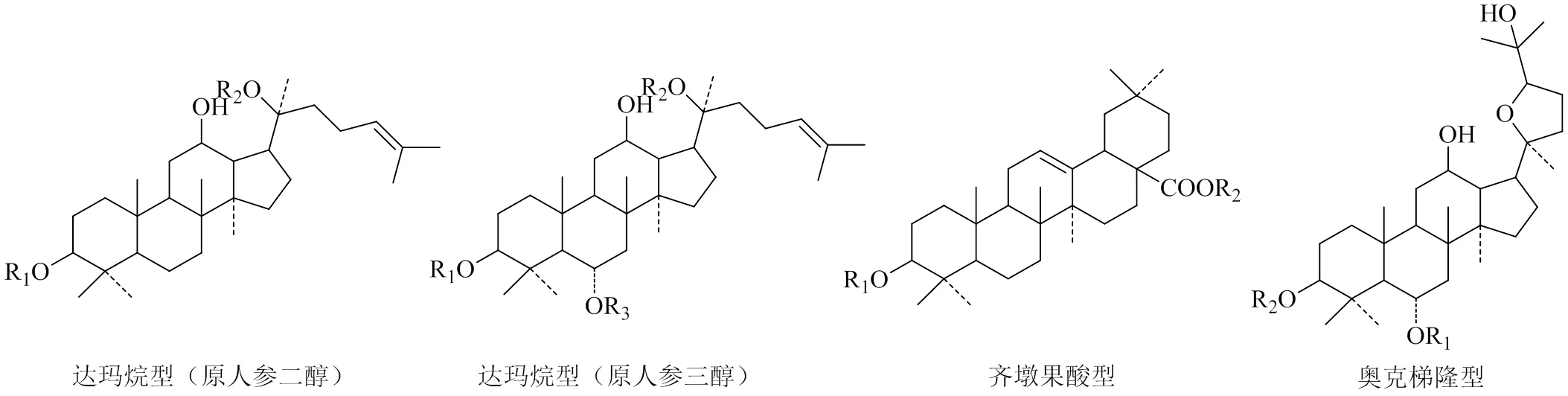
图1 人参皂苷的不同母核结构
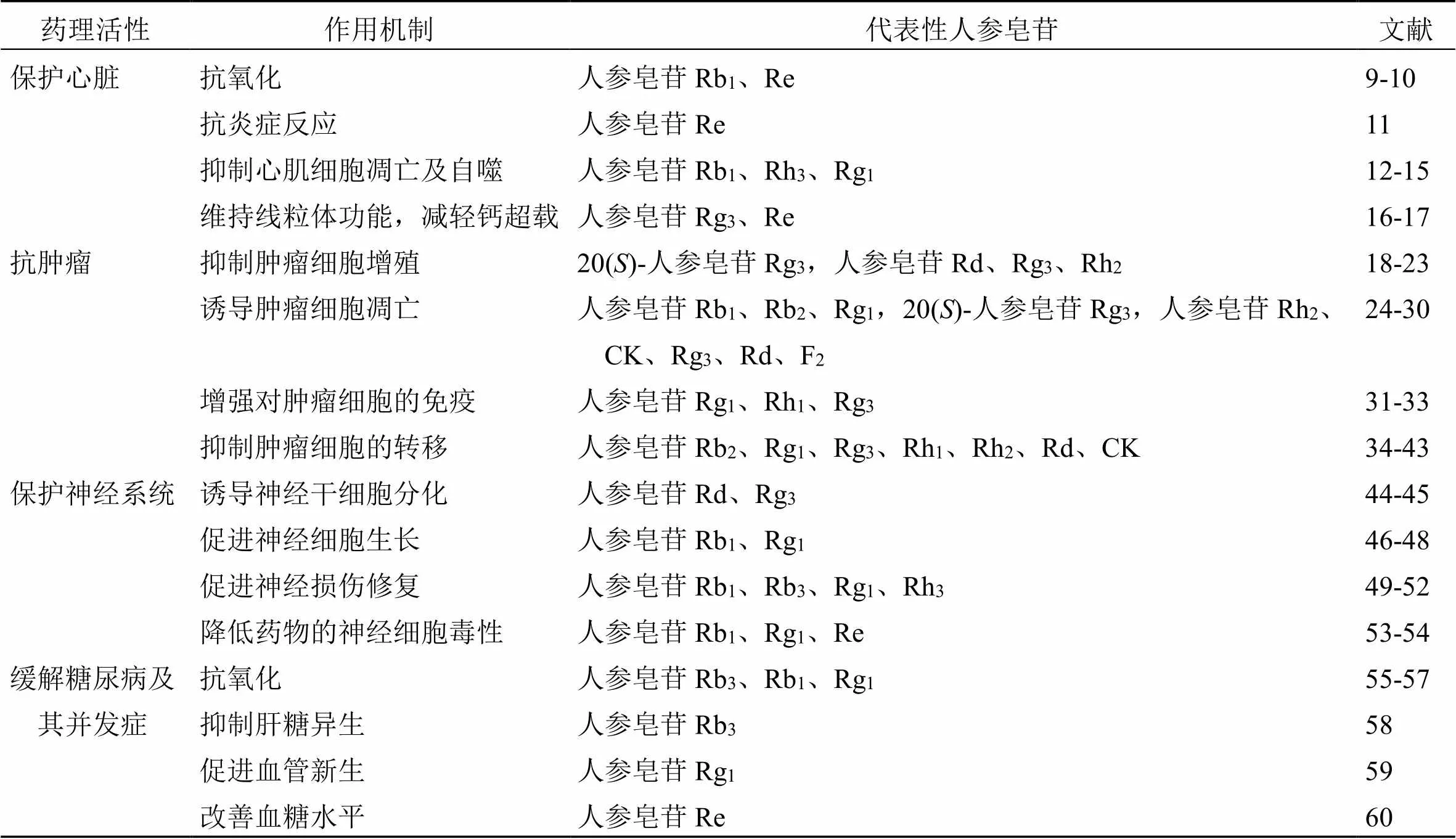
表1 人参皂苷的主要药理作用及其机制
1981—2019年,天然产物及其半合成衍生物占所有批准药物的23%,而半合成衍生物构成了其中的主要部分(19%)[61]。天然产物因其新颖的结构、显著多样的生物活性以及独特的作用机制,长期以来被认为是研制新药的资源宝库[62]。从天然产物中寻找新药或先导化合物的研究已是国内外研发新药的活跃领域[63]。近年来围绕人参皂苷创新药物开发开展了大量研究,并取得了许多重大科研进展。
2 人参皂苷的创新药物开发
2.1 已上市药物
目前以人参为基源的创新药物研究与开发取得了许多重大成果(表2)。其中以人参果总皂苷为主要有效成分的振源胶囊已经应用于临床多年,具有治疗冠心病及糖尿病双重功能,临床疗效较好,取得了良好的经济效益和社会效益[64];以人参茎叶总皂苷为主要有效成分的人参茎叶总皂苷胶囊健脾益气,用于气虚引起的心悸、气短、疲乏无力、纳呆,也用于冠心病、更年期综合征、隐性糖尿病及肿瘤的辅助用药[65];以西洋参茎叶总皂苷为主要有效成分的心悦胶囊益气养心、和血,用于冠心病心绞痛气阴两虚证者[66]。
以人参皂苷Rg3单体为原料的参一胶囊,具有培元固本、补益气血的功效,可配合化疗用药,提高机体免疫功能、改善肿瘤患者的气虚症状,有助于提高原发性肺癌、肝癌的疗效[67],开启了人参皂苷单体创新药物开发的先河,迎来了人参皂苷创新药物开发的新时代。

表2 已在中国获批上市的含有人参皂苷的药物
*多个生产单位&不同生产单位生产的同一商品名药物的规格不同
*multiple production units &different production units produce different specifications of the same brand name drugs
2.2 临床研究药物
目前成功开发并开展临床研究的有广东泰禾生物药业有限公司和中山大学中山医学院科技开发中心研制的人参皂苷Rd原料药及其人参皂苷Rd注射液(1.1类化药,治疗急性脑梗死),吉林大学与北京鑫利恒科技发展有限公司开发的20()-人参皂苷Rg3原料药及20()-人参皂苷Rg3眼膏(1.1类化药,抗病毒)、20()-人参皂苷Rg3注射液(1.1类化药,抗癌)、人参皂苷Re原料药、人参皂苷Re片(1.2类化药,促智),浙江亚克药业有限公司与海南亚洲制药研发的20()-原人参二醇(1类中药,抗癌),吉林大学与吉林华康药业股份有限公司开发的伪人参皂苷GQ原料药及伪人参皂苷GQ注射液(1.1类化药,抗心肌缺血)等创新药物,均获得了国家食品药品监督管理局临床研究批件,其他在国家药品监督管理局-药物临床试验登记与信息公示平台备案的药物见表3。这些创新药物的上市,将极大程度地解决制约人参产业发展的重大问题和科学瓶颈,造福人类。
3 人参皂苷结构修饰关键技术及开发创新药物技术方案
单体人参皂苷含量较大的有人参皂苷Re、Rd、Rb1、Rg1等,可以通过提取分离得到工业化生产的量。其余人参皂苷(元)量少,只有通过结构修饰技术,才能达到工业化生产及产业化目的,如稀有人参皂苷Rg3、Rh2等。另外,虽然很多天然存在的人参皂苷本身具有一定的药理活性,但因成药性的不足而很少能直接应用于临床,结构修饰在一定程度上可弥补天然产物成药性的不足[68]。人参皂苷的结构修饰,实现了稀有人参皂苷产业化。通过人参皂苷结构定向修饰技术,解决了单体人参皂苷含量低,无法开发的难题。本课题组利用化学合成手段,实现了稀有20()-人参皂苷Rg3、Rh2和20()-原人参二醇(PPD)、拟人参皂苷GQ的产业化。其中20()-人参皂苷Rg3眼膏(1类化药,抗病毒)完成了III期临床研究,临床批件号2004L04263,拟人参皂苷GQ注射液(1类化药,抗心肌缺血),开展了II期临床研究,临床批件号2010L2645。

表3 进入临床试验的人参皂苷类药物
3.1 人参皂苷结构修饰的关键技术
针对单体人参皂苷含量低,难产业化,及生物活性有待提高等重大问题,在“十一五”科技支撑计划、吉林省“双十工程”科技攻关等项目的支持下,开展了人参皂苷定向结构修饰的研究,在人参皂苷的结构修饰、活性筛选及人参皂苷产业化等研究领域取得了丰硕成果。
3.1.1 创新突破人参皂苷结构修饰关键技术,实现20()-人参皂苷Rg3、Rh2及PPD等稀有人参皂苷(元)产业化 众所周知,人参皂苷是人参的主要有效成分,其中20()-人参皂苷Rg3、Rh2及PPD具有很强的抗癌活性,但是自然界中它们含量均十分低,如人参中含人参皂苷Rg3仅0.000 003%,难以实现工业化生产,是制约其开发抗癌药物的主要瓶颈之一。目前有酸水解人参总皂苷制备人参皂苷Rg3(参一胶囊)的报道[69],但其获得的是20(/)-人参皂苷Rg3一对对映体,只有50%产物可利用。
本课题组通过首创的手性结构修饰技术,将含有相同20()-人参皂苷Rg3结构单元的人参皂苷Rb族、Rc、Rd等二醇组皂苷,在强碱、高温条件下水解,保留相同的R1基团,去掉不同基团R2,高效转化为稀有人参皂苷(元),分别获得了稀有20()-人参皂苷Rg3、Rh2及PPD单一组分,质量分数达到98%以上,达到了千克级水平,突破了产业化关键技术,其核心技术是保持人参皂苷C-20位构型不变。其具体技术路线见图2。
3.1.2 首次开展达玛烷型人参皂苷向奥克梯隆型人参皂苷转化,实现拟人参皂苷F11、GQ及DQ的产业化 本课题组[70]通过人参皂苷侧链定向氧化环合技术发明,将达玛烷型人参皂苷侧链双键进行氧化,得到环氧化合物,进而与C-20位-OH进行亲和取代反应形成含氧五元环,创新的实现人参皂苷转化成西洋参特有的奥克梯隆型皂苷,并获得了系列新伪人参皂苷,包括20()-拟人参皂苷F11、伪人参皂苷GQ、伪人参皂苷元DQ,生物活性显著增强,其核心技术是保持奥克梯隆型人参皂苷的C-20及C-24位构型不变。产品转化率达到90%以上,产品质量分数达98%以上。其反应机制见图3。

图2 人参二醇组皂苷制备稀有人参皂苷Rg3、Rh2及PPD

图3 达玛烷型人参皂苷转化为奥克梯隆型人参皂苷的反应机制
3.2 首次提出了单体人参皂苷创新药物综合开发的技术方案
本课题组首次提出了单体人参皂苷创新药物综合开发的技术方案。通过人参皂苷结构修饰关键技术,解决单体人参皂苷含量低及生物活性弱的产业化难题;针对人参的不同功效确定创新药物的适应症,采取不同的给药途径,结合临床需求开发单体人参皂苷;核心目标是依据含量高低不同、生物活性差异,有序进行单体人参皂苷创新药物的综合开发。
人参皂苷创新药物综合开发技术方案见图4。
4 结语
随着人参皂苷类成分的不断挖掘及其衍生物的不断合成,以及现代药理学的发展,人参皂苷在抗癌、抗炎、抗肥胖、调节代谢紊乱、改善记忆力以及保护心血管等方面取得了可喜的成果,尤其在抗肿瘤方面已取得了较好的临床治疗效果[71-72]。随着人参皂苷的综合开发技术方案的实施,对于人参皂苷的研究将更具有系统性、深入性,有助于进一步厘清人参皂苷的构效关系,为进一步设计具有新颖结构及更显著药效活性的人参皂苷及其衍生物提供理论支持,为开发出更多临床目标明确、临床疗效确切、剂型选择科学的创新药物提供了科学思路。相信随着人参皂苷系统化的研究,未来一定会涌现出一批治疗心脑血管、促智及抗肿瘤的创新药物,造福人类大健康产业的同时,弘扬中医药精髓,传承精华,守正创新,实现以历史视野、发展眼光,创新发展我国中医药是势在必行的历史使命和责任,让人参这一瑰宝在未来中药现代化过程中发挥出“百草之王”的功能与药效。

图4 人参皂苷创新药物综合开发技术方案
利益冲突 所有作者均声明不存在利益冲突
[1] 李平亚. 人参皂苷NMR标准图谱[M]. 北京: 化学工业出版社, 2012: 1-100.
[2] 李平亚. 人参营养成分及功能因子[M]. 北京: 化学工业出版社, 2017: 5-120.
[3] Li P Y, Liu J P.[M]. Singapore: Springer Singapore, 2020: 1-197.
[4] Yang W Z, Hu Y, Wu W Y,. Saponins in the genusL. (Araliaceae): A systematic review of their chemical diversity [J]., 2014, 106: 7-24.
[5] 尤京超, 田宏彦. 人参皂苷活性对光新兵作用的研究进展 [J]. 食品安全质量检测学报, 2021, 12(9): 3585-3591.
[6] 罗林明, 石雅宁, 姜懿纳, 等. 人参抗肿瘤作用的有效成分及其机制研究进展 [J]. 中草药, 2017, 48(3): 582-596.
[7] 方伟. 人参皂苷干预糖尿病及其并发症研究进展 [J]. 实用中医药杂志, 2019, 35(5): 630-632.
[8] 万茜淋, 吴新民, 刘淑莹, 等. 人参皂苷参与调控神经系统功能的研究进展 [J]. 中药药理与临床, 2020, 36(6): 230-235.
[9] Fan J S, Liu D N, He C Y,. Inhibiting adhesion events bysaponins and ginsenoside Rb1protecting arteries via activation of Nrf2 and suppression of p38-VCAM-1 signal pathway [J]., 2016, 192: 423-430.
[10] Lee G H, Lee W J, Hur J,. Ginsenoside Re mitigates 6-hydroxydopamine-induced oxidative stress through upregulation of GPX4 [J]., 2020, 25(1): E188.
[11] Lee I A, Hyam S R, Jang S E,. Ginsenoside Re ameliorates inflammation by inhibiting the binding of lipopolysaccharide to TLR4 on macrophages [J]., 2012, 60(38): 9595-9602.
[12] 冷雪, 贾连群, 王莹, 等. 人参皂苷素Rb1预处理对异丙肾上腺素诱导大鼠急性心肌缺血心肌凋亡相关蛋白表达的影响 [J]. 辽宁中医杂志, 2017, 44(1): 184-186.
[13] 王俊东, 崔勇, 王建国, 等. 人参皂苷Rh3预处理对大鼠心肌缺血再灌注损伤的保护作用研究 [J]. 中华中医药学刊, 2017, 35(11): 2783-2786.
[14] Deng H Y, Lai W G. Protective effect of notoginsenoside Rb1on acute myocardial ischemia in rats model [J]., 2013, 19(10): 265-268.
[15] Zhang Z L, Fan Y, Liu M L. Ginsenoside Rg1inhibits autophagy in H9c2 cardiomyocytes exposed to hypoxia/ reoxygenation [J]., 2012, 365(1/2): 243-250.
[16] Sun M W, Huang C L, Wang C,. Ginsenoside Rg3improves cardiac mitochondrial population quality: Mimetic exercise training [J]., 2013, 441(1): 169-174.
[17] Liu M C, Bai X Y, Yu S T,. Ginsenoside Re inhibits ROS/ASK-1 dependent mitochondrial apoptosis pathway and activation of Nrf2-antioxidant response in beta-amyloid-challenged SH-SY5Y cells [J]., 2019, 24(15): E2687.
[18] He B C, Gao J L, Luo X J,. Ginsenoside Rg3inhibits colorectal tumor growth through the down-regulation of Wnt/ß-catenin signaling [J]., 2011, 38(2): 437-445.
[19] Lee S Y, Kim G T, Roh S H,. Proteomic analysis of the anti-cancer effect of 20-ginsenoside Rg3in human colon cancer cell lines [J]., 2009, 73(4): 811-816.
[20] Lee S Y, Kim G T, Roh S H,. Proteome changes related to the anti-cancer activity of HT29 cells by the treatment of ginsenoside Rd [J]., 2009, 64(4): 242-247.
[21] Shan X, Fu Y S, Aziz F,. Ginsenoside Rg3inhibits melanoma cell proliferation through down-regulation of histone deacetylase 3 (HDAC3) and increase of p53 acetylation [J]., 2014, 9(12): e115401.
[22] Liu Z H, Li J, Xia J,. Ginsenoside 20()-Rh2as potent natural histone deacetylase inhibitors suppressing the growth of human leukemia cells [J]., 2015, 242: 227-234.
[23] You Z M, Zhao L, Xia J,. Down-regulation of phosphoglucose isomerase/autocrine motility factor enhances gensenoside Rh2pharmacological action on leukemia KG1α cells [J]., 2014, 15(3): 1099-1104.
[24] Lee D G, Jang S I, Kim Y R,. Anti-proliferative effects of ginsenosides extracted from mountain ginseng on lung cancer [J]., 2016, 22(5): 344-352.
[25] Wang J H, Nao J F, Zhang M,. 20()-ginsenoside Rg3promotes apoptosis in human ovarian cancer HO-8910 cells through PI3K/Akt and XIAP pathways [J]., 2014, 35(12): 11985-11994.
[26] Tang X P, Tang G D, Fang C Y,. Effects of ginsenoside Rh2on growth and migration of pancreatic cancer cells [J]., 2013, 19(10): 1582-1592.
[27] Park S, Lee H J, Jeong S J,. Inhibition of JAK1/STAT3 signaling mediates compound K-induced apoptosis in human multiple myeloma U266 cells [J]., 2011, 49(6): 1367-1372.
[28] Jian J, Hu Z F, Huang Y. Effect of ginsenoside Rg3on Pim-3 and Bad proteins in human pancreatic cancer cell line PANC-1 [J]., 2009, 28(5): 461-465.
[29] Kim B J. Involvement of melastatin type transient receptor potential 7 channels in ginsenoside Rd-induced apoptosis in gastric and breast cancer cells [J]., 2013, 37(2): 201-209.
[30] Mao Q, Zhang P H, Wang Q,. Ginsenoside F2induces apoptosis in humor gastric carcinoma cells through reactive oxygen species-mitochondria pathway and modulation of ASK-1/JNK signaling cascadeand[J]., 2014, 21(4): 515-522.
[31] Wang Y, Hao Y, Lou J L,. Effect of ginsenoside Rg1and Rh1on the anti-tumor activity of dendritic cell [J]., 2004, 20(10): 18-23.
[32] Wu R H, Ru Q, Chen L,. Stereospecificity of ginsenoside Rg3in the promotion of cellular immunity in hepatoma H22-bearing mice [J]., 2014, 79(7): H1430-H1435.
[33] Son K J, Choi K R, Lee S J,. Immunogenic cell death induced by ginsenoside Rg3: Significance in dendritic cell-based anti-tumor immunotherapy [J]., 2016, 16(1): 75-84.
[34] Fujimoto J, Sakaguchi H, Aoki I,. Inhibitory effect of ginsenoside-Rb2on invasiveness of uterine endometrial cancer cells to the basement membrane [J]., 2001, 22(5): 339-341.
[35] Li L, Wang Y W, Qi B Q,. Suppression of PMA-induced tumor cell invasion and migration by ginsenoside Rg1via the inhibition of NF-κB-dependent MMP-9 expression [J]., 2014, 32(5): 1779-1786.
[36] Lee S G, Kang Y J, Nam J O. Anti-metastasis effects of ginsenoside Rg3in B16F10 cells [J]., 2015, 25(12): 1997-2006.
[37] Guo J Q, Zheng Q H, Chen H,. Ginsenoside Rg3inhibition of vasculogenic mimicry in pancreatic cancer through downregulation of VE‑cadherin/EphA2/MMP9/ MMP2 expression [J]., 2014, 45(3): 1065-1072.
[38] Jung J S, Ahn J H, Le T K,. Protopanaxatriol ginsenoside Rh1inhibits the expression of matrix metalloproteinases and theinvasion/migration of human astroglioma cells [J]., 2013, 63(2): 80-86.
[39] Kim S Y, Kim D H, Han S J,. Repression of matrix metalloproteinase gene expression by ginsenoside Rh2in human astroglioma cells [J]., 2007, 74(11): 1642-1651.
[40] Yoon J H, Choi Y J, Cha S W,. Anti-metastatic effects of ginsenoside Rd via inactivation of MAPK signaling and induction of focal adhesion formation [J]., 2012, 19(3/4): 284-292.
[41] Kim H, Roh H S, Kim J E,. Compound K attenuates stromal cell-derived growth factor 1 (SDF-1)-induced migration of C6 glioma cells [J]., 2016, 10(3): 259-264.
[42] Zhang K Q, Li Y W. Effects of ginsenoside compound K combined with cisplatin on the proliferation, apoptosis and epithelial mesenchymal transition in MCF-7 cells of human breast cancer [J]., 2016, 54(4): 561-568.
[43] Zhang Y, Liu Q Z, Xing S P,. Inhibiting effect of Endostar combined with ginsenoside Rg3on breast cancer tumor growth in tumor-bearing mice [J]., 2016, 9(2): 180-183.
[44] Shi Q, Hao Q, Bouissac J,. Ginsenoside-Rd fromenhances astrocyte differentiation from neural stem cells [J]., 2005, 76(9): 983-995.
[45] 张凤兰, 杨璐军, 胡炜彦, 等. 人参皂苷Rg3对体外培养小鼠神经干细胞分化的影响 [J]. 中国组织工程研究, 2018, 22(13): 2098-2103.
[46] Liu M, Zhang J T. Protective effects of ginsenoside Rb1and Rg1on cultured hippocampal neurons [J]., 1995, 30(9): 674-678.
[47] Rudakewich M, Ba F, Benishin C G. Neurotrophic and neuroprotective actions of ginsenosides Rb1and Rg1[J]., 2001, 67(6): 533-537.
[48] 邓明, 谢萍, 马永刚, 等. 人参皂苷Rb1对周围神经损伤后大鼠背根神经节神经生长因子及其受体酪氨酸激酶A表达的影响 [J]. 实用预防医学, 2019, 26(4): 412-415.
[49] Lim J H, Wen T C, Matsuda S,. Protection of ischemic hippocampal neurons by ginsenoside Rb1, a main ingredient of ginseng root [J]., 1997, 28(3): 191-200.
[50] Tohda C, Matsumoto N, Zou K,. Axonal and dendritic extension by protopanaxadiol-type saponins from ginseng drugs in SK-N-SH cells [J]., 2002, 90(3): 254-262.
[51] 严洁萍, 沈浓儿, 叶强, 等. mTOR/Akt/FoxO3信号通路在人参皂苷Rg_1抗PC-12细胞OGD损伤的作用 [J]. 中国中药杂志, 2015, 40(8): 1554-1559.
[52] Tang C Z, Li K R, Yu Q,. Activation of Nrf2 by ginsenoside Rh3protects retinal pigment epithelium cells and retinal ganglion cells from UV [J]., 2018, 117: 238-246.
[53] Kim H S, Hong Y T, Jang C G. Effects of the ginsenosides Rg1and Rb1on morphine-induced hyperactivity and reinforcement in mice [J]., 1998, 50(5): 555-560.
[54] Dang D K, Shin E J, Kim D J,. Ginsenoside Re protects methamphetamine-induced dopaminergic neurotoxicity in mice via upregulation of dynorphin-mediated κ-opioid receptor and downregulation of substance P-mediated neurokinin 1 receptor [J]., 2018, 15(1): 52.
[55] 孟凡丽, 苏晓田, 郑毅男. 人参皂苷Rb3对糖尿病模型小鼠的降血糖和抗氧化作用 [J]. 华南农业大学学报, 2013, 34(4): 553-557.
[56] 薛冰, 梁琳琅, 张颖, 等. 人参皂苷Rb1减少间歇性高糖诱导雪旺细胞氧化应激 [J]. 辽宁中医药大学学报, 2017, 19(2): 10-12.
[57] 冯劼. 人参皂苷Rg1对四氧嘧啶致小鼠糖尿病降糖作用的研究 [J]. 中华中医药学刊, 2010, 28(11): 2427-2429.
[58] 孟凡丽. 人参皂苷Rb3对肝糖异生AMPK的影响研究 [J]. 新农业, 2017(9): 17-20.
[59] 杨乃全. 人参皂苷Rg1促进糖尿病小鼠缺血肢体血管新生的研究 [D]. 南京: 南京医科大学, 2013.
[60] 高钧, 卢守四, 张蕾, 等. 人参皂苷Re促进胰高血糖素样肽-1分泌的研究 [J]. 中国药物与临床, 2011, 11(12): 1383-1385.
[61] Newman D J, Cragg G M. Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019 [J]., 2020, 83(3): 770-803.
[62] 陈士林, 孙奕, 万会花, 等. 中药与天然药物2015—2020年研究亮点评述 [J]. 药学学报, 2020, 55(12): 2751-2776.
[63] Atanasov A G, Zotchev S B, Dirsch V M,. Natural products in drug discovery: Advances and opportunities [J]., 2021, 20(3): 200-216.
[64] 高洁, 官宝怡, 马晓娟. 振源胶囊的心血管保护作用及临床应用的研究进展 [J]. 医学综述, 2020, 26(5): 991-996.
[65] 李长新, 亓校鹏. 高效液相色谱法测定人参茎叶总皂苷胶囊中人参皂苷Re的含量 [J]. 黑龙江医药, 2005, 18(4): 244-245.
[66] 冯俊波, 孙蕾, 王朝雨. 心悦胶囊治疗缺血性心肌病的疗效观察 [J]. 中国现代药物应用, 2018, 12(14): 121-122.
[67] 张燕, 廖大忠, 刘成凤, 等. 基于吉西他滨联合顺铂化疗方案分析参一胶囊对晚期非小细胞肺癌患者的疗效 [J]. 中国中医基础医学杂志, 2020, 26(11): 1649-1653.
[68] 徐悦, 程杰飞. 基于天然产物衍生优化的小分子药物研发 [J]. 科学通报, 2017, 62(9): 908-919.
[69] 2013年度国家技术发明奖获奖项目一类单体中药新药: 参一胶囊创制的关键技术及应用[EB/OL]. (2014-01-11) [2021-06-29]. http://scitech.people.com.cn/n/2014/ 0110/c1007-24082710.html.
[70] 刘金平, 赵春芳, 李平亚, 等. 伪人参皂苷GQ对异丙肾上腺素致大鼠急性心肌缺血的改善作用 [J]. 吉林大学学报: 医学版, 2006, 32(1): 64-67.
[71] 魏朝辉, 张文军, 赵艳明, 等. 人参皂苷佐治晚期胃癌效果观察 [J]. 临床合理用药杂志, 2015, 8(16): 70-71.
[72] 赵燕. 人参皂苷Rg3对鼻咽癌Th1/Th2细胞因子表达情况及临床治疗效果分析 [J]. 陕西中医, 2018, 39(1): 101-103.
Research and development of novel drugs based one——comprehensive technology development program of ginsenoside
LI Ping-ya1, FENG Hao2, LIU Jin-ping1, WANG Cui-zhu1, LI Zhuo1
1. School of Pharmacy, Jilin University, Changchun 130021, China 2. School of Basic Medicine, Jilin University, Changchun 130021, China
ehas a long history of being recognized as “the king of herbal medicines”. With the advancement of scientific research, pharmaceutical substance basis ofeis more clear, pharmacological activities are clearer, and mechanisms of action continue to be elucidated. The development and research of innovative drug based onehas stepped into a fast lane, especially the introduction of comprehensive exploitation technical solutions of ginsenosides further shed light on the new directions of ginsenoside drug design, which will lead to novel drugs production for treating cardiovascular and cerebrovascular diseases, curing neurological disorders, enhancing immune functions and anticancer activities, enhance the high-tech contents of ginseng industry and facilitate the development of big health industry in a high-quality manner.
eC. A. Meyer; ginsenoside; dammarane-type; oleanolic acid-type; ocotillol type; innovative drugs; research and development
R282.710.5
A
0253 - 2670(2021)17 - 5350 - 08
10.7501/j.issn.0253-2670.2021.17.027
2021-06-29
国家“十一五”科技支撑计划(2007BAI38B04);国家科技部重大创新药物专项(2011ZX09401-305-26);吉林省重大科技专项(20200504006YY)。
李平亚,沈阳药科大学1994级博士药物化学专业校友,吉林大学唐敖庆教授、人参创新药物国家地方联合工程研究中心主任,吉林省高级专家,主编《人参皂苷NMR标准图谱》《人参营养成分及功能因子》等4部专著,荣获科学中国人(2014)、中国产学研合作创新与促进奖创新成果奖二等奖(2018)、吉林省科学技术进步一等奖2项,主要从事天然药物化学成分及生物活性的研究。Tel: 13804350648 E-mail: lipy@jlu.edu.cn
李 卓。Tel/Fax: (0431)85619803 E-mail: lizh0205@jlu.edu.cn
[责任编辑 崔艳丽]
