LncRNA XIST通过海绵吸附miR-133a调控甲状腺癌细胞的增殖和凋亡*
2021-09-06张娜易茂林
张娜, 易茂林
(黄冈市中心医院 乳甲外科, 湖北 黄冈 438000)
甲状腺癌是最常见的内分泌恶性肿瘤之一,其发病率和死亡率正逐年攀升[1]。尽管甲状腺癌患者的治疗方法有所发展,但甲状腺癌容易发生远处转移,导致患者预后生存差[2]。甲状腺癌的发生和发展是一个复杂的过程,深入了解和揭示甲状腺癌的发病机制,对于有效的诊断和治疗是必不可少的。长链非编码RNA (long noncoding RNA,LncRNA) 是长度大于200 nt的RNA分子,其不编码蛋白质,但在肿瘤基因表达水平的调控中具有重要的作用,是目前肿瘤学领域研究的热点[3-4]。多项研究表明LncRNA参与调节肿瘤细胞的增殖、分化、转移和凋亡等生物学活性[5-7]。X染色体失活基因(X inactivate-specific transcript,XISTX染色体失活基因)是LncRNA成员之一,研究报道XIST在非小细胞肺癌、乳腺癌、卵巢癌、肝癌和胃癌等恶性肿瘤中表达异常[8-12],但目前极少报道其在甲状腺癌中的表达情况和调控机制。microRNAs是一种非编码RNA,大小约22 nt[13]。据报道,miR-133a在宫颈癌、胃癌、肺癌、结直肠癌等恶性肿瘤中均表达下调[14-17]。近期,一种新的转录后调控的观点被提出,认为lncRNAs与miRNAs相互作用,作为竞争的内源性RNAs(ceRNAs)发挥作用,目前尚无研究报道XIST和miR-133a之间是否存在竞争性结合机制。本研究通过培养甲状腺癌细胞进行相应处理,探究XIST和miR-133a在甲状腺癌细胞中的表达情况和对甲状腺癌增殖、凋亡的影响机制。
1 材料与方法
1.1 材料
1.1.1样本 收集2015年3月—2017年4月行切除术的49例甲状腺癌患者癌组织和癌旁组织样本,其中男29例、女20例,41~62岁、平均51.8岁。手术前,所有癌症患者均未接受化疗或放疗,所有患者均签署知情同意书。
1.1.2细胞培养 甲状腺上皮细胞系Nthy-ori 3-1和甲状腺癌细胞系TPC-1、FTC-133、SW579、WRO均购自ATCC库,细胞在含10%胎牛血清(FBS,Gibco,NY,USA)的DMEM培养基中培养。在5% CO2,37 ℃的恒温加湿培养箱中生长。
1.2 方法
1.2.1细胞分组 将TPC-1和FTC-133细胞分为对照组(Control组)、DMSO处理组(DMSO组)、XIST过表达阴性对照组(oe-NC组)、XIST过表达组(oe-XIST组)、XIST沉默阴性对照组(si-NC组)、si-XIST组(XIST沉默组)、XIST过表达阴性对照与miR-133a过表达阴性对照共转(oe-NC+NC mimic组)、XIST过表达与miR-133a过表达阴性对照共转组(oe-XIST+NC mimic组)、XIST过表达阴性对照与miR-133a过表达共转组(oe-NC+miR-133a mimic组)及XIST过表达与miR-133a过表达共转组(oe-XIST+miR-133a mimic组)。
1.2.2细胞转染 对数期TPC-1和FTC-133细胞经胰酶消化后,于转染前24 h再悬浮制备细胞悬液,然后以1×106细胞/孔的密度接种于6孔板中,孵育18~24 h,使每孔细胞融合率达到80%~90%。转染前3 h,用不含血清和抗生素的新鲜培养基代替原培养基。采用Lipofectamine 2000(Life Technologies)进行细胞转染,转染细胞培养48 h后进行进一步实验。
1.2.3MTT法检测细胞增殖 为探究LncRNA XIST对甲状腺癌细胞增殖的影响,分别培养TPC-1和FTC-133细胞,并对细胞进行XIST过表达和沉默处理,并通过MTT法检测各组细胞的增殖情况。按照Promega试剂盒的说明操作,用含10%FBS的培养基制备5×104细胞/mL的单细胞悬浮液。将悬浮液加入96孔板(200 μL/孔)中培养3~5 d。转染后,继续培养0、24、48和72 h,然后加入20 μL MTT(5 g/L)。MTT孵育4 h后去除上清液,加入200 μL二甲基亚砜溶解,用酶标仪测定490 nm处的OD值,确定细胞增殖情况。
1.2.4流式细胞术检测细胞凋亡 细胞转染后48 h,流式细胞术检测各组细胞凋亡情况。按照PI-Annexin V凋亡检测试剂盒(BD Bioscience,NJ,USA)的说明测定细胞凋亡。FACS Calibur流式细胞仪(BD Bioscience,NJ,USA)检测细胞凋亡。采用FACS-Diva软件BD Bioscience,NJ,USA)对数据进行分析。
1.2.5qRT-PCR检测LncRNA XIST和miR-133a的表达 培养甲状腺上皮细胞系Nthy-ori 3-1和甲状腺癌细胞系TPC-1、FTC-133、SW579、WRO,并通过qRT-PCR检测各细胞中LncRNA XIST和miR-133a的表达情况。用TRIzol试剂(NE0260,北京雷根生物技术有限公司,北京,中国)提取甲状腺癌细胞总RNA。利用PrimeScriptⅡ第一链cDNA合成试剂盒(TaKaRa,东京,日本)进行RNA逆转录后,通过SYBR Premix Ex Taq(TaKaRa)对获得的cDNA进行qRT-PCR。U6是检测miR-133a的内参,GAPDH是检测XIST的内参。用2 ΔCT法计算相对表达。引物由山根生物技术公司(中国上海)合成,引物序列见表1。

表1 引物序列Tab.1 Primer sequence
1.3 统计学方法
2 结果
2.1 LncRNA XIST和miR-133a的表达
LncRNAXIST和miR-133a的表达结果显示,与癌旁组织比较,甲状腺癌组织中LncRNAXIST表达降低,miR-133a表达升高,差异有统计学意义(P<0.05);与甲状腺上皮细胞系Nthy-ori 3-1比较,TPC-1、FTC-133、SW579、WRO细胞中LncRNAXIST表达升高,miR-133a表达降低 ,差异有统计学意义(P<0.05)。见图1。

注:(1)与癌旁组织比较,P<0.05;(2)与甲状腺上皮细胞Nthy-ori 3-1组比较,P<0.05。图1 甲状腺癌组织和细胞中LncRNA XIST和miR-133a的表达Fig.1 LncRNA XIST and miR-133a expression in thyroid carcinoma tissues and cells
2.2 XIST对甲状腺癌细胞增殖的影响
结果显示,在TPC-1和FTC-133细胞中,0、24、48、72 h 各时点,Control组、DMSO组、oe-NC组和si-NC组细胞增殖能力比较,差异无统计学意义 (P>0.05)。与oe-NC组比较,oe-XIST组TPC-1和FTC-133细胞在48 h和72 h时增殖能力均增强,差异有统计学意义(P<0.05);与si-NC组比较,si-XIST组TPC-1和FTC-133细胞在48 h和72 h时增殖能力均降低,差异有统计学意义(P<0.05)。见图2。

注:A为TPC-1细胞0、24、48、72 h时细胞增殖情况统计分析,B为FTC-133细胞0、24、48、72 h时细胞增殖情况统计分析;(1)与oe-NC组比较,P<0.05;(2)与si-NC组比较,P<0.05。图2 XIST对甲状腺癌TPC-1和FTC-133细胞增殖的影响Fig.2 Effects of XIST on the proliferation of thyroid carcinoma TPC-1 and FTC-133 cells
2.3 XIST对甲状腺癌细胞凋亡的影响
在甲状腺癌TPC-1和FTC-133细胞中,Control组、DMSO组、oe-NC组和si-NC组细胞凋亡比例比较,差异无统计学意义(P>0.05)。与oe-NC组比较,oe-XIST组TPC-1和FTC-133细胞凋亡比例降低,差异有统计学意义(P<0.05);与si-NC组比较,si-XIST组TPC-1和FTC-133细胞凋亡比例升高,差异有统计学意义(P<0.05)。见图3。

注:A为TPC-1细胞经处理后的细胞凋亡率,B为FTC-133细胞经处理后的细胞凋亡率;(1)与oe-NC组比较,P<0.05;(2)与si-NC组比较,P<0.05。图3 XIST对甲状腺细胞凋亡的影响Fig.3 Flow cytometry detection on apoptosis of each group
2.4 miR-133a对LncRNA XIST的影响
在甲状腺癌TPC-1和FTC-133细胞中,与oe-NC+NC mimic比较,oe-XIST+NC mimic组细胞中XIST表达升高,oe-NC+miR-133a mimic组细胞中miR-133a表达升高,oe-XIST+miR-133a mimic组细胞中XIST和miR-133a表达升高,差异有统计学意义(P<0.05)。与oe-XIST+NC mimic比较,oe-XIST+miR-133a mimic组细胞miR-133a表达升高,差异有统计学意义(P<0.05)。见图4。

注:A为TPC-1细胞中LncRNA XIST和miR-133a的基因表达,B为FTC-133细胞中LncRNA XIST和miR-133a的基因表达;(1)与oe-NC+NC mimic组比较,P<0.05;(2)与oe-XIST+NC mimic组比较,P<0.05。图4 miR-133a对LncRNA XIST的影响Fig.4 Effect of miR-133a on LncRNA XIST
2.5 XIST通过吸附miR-133a,影响甲状腺癌细胞增殖
与oe-NC+NC mimic比较,oe-XIST+NC mimic组TPC-1和FTC-133细胞48 h和72 h时增殖能力增强, oe-NC+miR-133a mimic组TPC-1和FTC-133细胞48 h和72 h时增殖能力降低,差异有统计学意义(P<0.05);与oe-XIST+NC mimic比较,oe-XIST+miR-133a mimic组TPC-1和FTC-133细胞增殖48 h和72 h时能力降低,差异有统计学意义(P<0.05)。见图5。
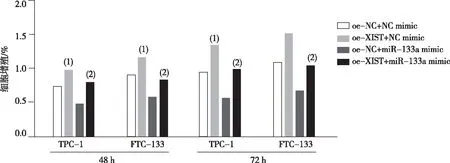
注:(1)与oe-NC+NC mimic组比较,P<0.05;(2)与oe-XIST+NC mimic组比较,P<0.05。图5 XIST对甲状腺癌TPC-1和FTC-133细胞在48、72 h时点细胞增殖的影响Fig.5 Effect of XIST on carcinoma cell proliferation
2.6 XIST通过吸附miR-133a对甲状腺癌细胞凋亡的影响
与oe-NC+NC mimic比较,oe-XIST+NC mimic组TPC-1和FTC-133细胞凋亡比例降低,oe-NC+miR-133a mimic组细胞凋亡比例升高(P<0.05);与oe-XIST+NC mimic比较,oe-XIST+miR-133a mimic组TPC-1和FTC-133细胞凋亡比例升高,差异有统计学意义(P<0.05)。见图6。

注:A为TPC-1细胞,B为FTC-133细胞;(1)与oe-NC+NC mimic组比较,P<0.05;(2)与oe-XIST+NC mimic组比较,P<0.05。图6 XIST通过吸附miR-133a后甲状腺癌各组细胞凋亡情况Fig.6 Apoptosis of each group after XIST absorption of miR-133a
3 讨论
甲状腺癌的临床治疗策略,包括放射性碘治疗、甲状腺切除术和促甲状腺激素抑制治疗,但其疗效并不理想,患者5年生存率并不令人满意[18]。深入研究甲状腺癌的发病机制具有重要意义,可为甲状腺癌的诊断和治疗提供更有效的策略。LncRNA不编码蛋白质,但在染色质重塑、结构支架和转录基因调控等过程中具有非常重要的作用[19-21]。LncRNA XIST是研究较多的LncRNAs成员之一,XIST在多种恶性肿瘤中异常表达,并被视作肿瘤的预后标志物之一[22-24]。本研究通过培养甲状腺上皮细胞系和甲状腺癌细胞系,并检测各细胞系中XIST的表达情况,结果显示,XIST在甲状腺癌细胞系的表达均异常上调;且过表达XIST会导致甲状腺癌细胞增殖能力增强,凋亡比例显著降低;而下调XIST的表达,可显著抑制甲状腺癌细胞增殖,并促进细胞凋亡,此结果与Liu等[25]研究结果一致,此结果提示XIST的表达变化可调控甲状腺癌细胞增殖和凋亡。
近年来,多项研究发现XIST可能通过吸附microRNA,进而发挥基因表达调控作用[26]。Zhu等[27]研究报道XIST可通过竞争性结合miR-200a,加速宫颈癌的发展。Zong等[28]研究报道XIST可通过吸附miR-125b-5p,促进乳腺癌的进展。Zhang等[29]研究报道XIST通过吸附miR-200c-3p,促进乳腺癌细胞对阿霉素的耐药。本研究通过检测发现XIST可吸附miR-133a,这与Wei等报道一致[30]。进一步对细胞进行XIST和miR-133a共转染处理,并检测细胞的增殖和凋亡变化情况。结果显示,过表达miR-133a抑制甲状腺癌细胞增殖,并促进细胞凋亡;且过表达miR-133a可改善XIST对甲状腺癌细胞增殖能力的促进作用和细胞凋亡的抑制作用,此结果提示XIST通过吸附miR-133a,进而促进甲状腺癌细胞增殖,抑制甲状腺癌细胞凋亡。
综上所述, XIST过表达促进甲状腺癌细胞增殖,抑制甲状腺癌细胞凋亡。XIST对甲状腺癌细胞增殖和凋亡情况的调控可通过吸附miR-133a实现。本研究通过细胞实验,检测到XIST在甲状腺癌中的表达情况,并进一步完善XIST对甲状腺癌细胞增殖和凋亡影响的机制,为甲状腺癌的发展提供了新的思路,并为临床上治疗甲状腺提供新的理论依据。但目前本研究尚未进行更深入的机制探究,进一步探究miR-133a可能的下游靶标,且研究范畴仍局限于体外细胞实验,下一步本研究将进一步通过体内实验,验证XIST/miR-133a在甲状腺癌中的调控机制。
