miR-130a通过调控PTEN对缺血性脑卒中神经功能的影响*
2021-09-06姚丽娜张鹏举
姚丽娜, 张鹏举
(保定市第二中心医院, 河北 保定 071000)
缺血性脑卒中的主要病因是颈动脉和(或)椎动脉提供血液的动脉狭窄或闭塞,大脑供血不足所致的脑缺血性损伤[1]。脑缺血性损伤是一个复杂的病理生理过程,涉及能量衰竭、酸中毒、钙超载、兴奋性氨基酸毒性、线粒体损伤、氧化应激及炎症反应等 ,最终导致细胞坏死或凋亡[2-4]。对急性脑缺血最有效的治疗方法是在适当的时间窗口内进行溶栓再灌注[5-7]。miRNA参与调节各种病理生理过程,这些过程与细胞凋亡、增殖和个体发育密切相关[8],miR-130a的表达在缺血再灌注后增加,并且与患者的治疗效果和预后密切相关[9]。磷酸酶张力蛋白同源物基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)作为具有磷酸酶活性的癌症抑制基因,在脑损伤中的作用逐渐受到关注[10]。PTEN可负性调控Akt/PKB信号通道,参与由脑缺血再灌注诱导的应激反应[11]。目前关于miR-130a对脑缺血和PTEN/PI3K/Akt信号通路影响的研究较少,本研究旨在探究miR-130a通过PTEN/PI3K/Akt信号通路对神经元功能是否有保护作用。
1 材料和方法
1.1 材料
1.1.1实验动物 雄性Sprague-Dawley(SD)大鼠60只、体质量250~280 g,在温度(23±2)℃、湿度(45±5)%、无特定病原体的环境中,规律昼夜节律适应性喂养1周。
1.1.2药物与试剂 10%水合氯醛(上海碧云天公司),miR-130a模拟物(Genechem公司,上海),阴性对照载体(Genechem公司,上海),Lipofectamine 2000试剂(Invitrogen公司,美国),TRIzol试剂(Invitrogen公司,美国),RNA提取试剂盒(南京诺唯赞生物科技股份有限公司),pGL3报道载体(Promega公司,美国),肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),白介素-6(interleukin-6,IL-6)和白介素-10(interleukin-10,IL-10)ELISA试剂盒(上海碧云天公司),TUNEL试剂盒(上海碧云天公司),放射免疫沉淀测定(RIPA)裂解缓冲液(北京TDY Biotech公司),小鼠抗大鼠p-Akt单克隆抗体(Invitrogen公司,美国),小鼠抗大鼠p-GSK3β单克隆抗体(Invitrogen公司,美国),小鼠抗大鼠p-c-Raf单克隆抗体(Invitrogen公司,美国),小鼠抗大鼠GAPDH单克隆抗体(Invitrogen公司,美国),山羊抗兔二抗(上海碧云天公司)。
1.1.3主要仪器 双重荧光素酶报告系统(Promega公司,美国),Gen5酶标仪(BioTek,美国)。
1.2 方法及观察指标
1.2.1动物分组 60只大鼠随机分为对照组(正常饲养,假手术处理,n=20)、模型组(缺血性脑卒中模型,n=20)和模拟转转染组(将miR-130a模拟转染注射到大鼠的侧脑室,n=20),实验获河北省动物伦理学委员会的批准(审批号2019322)。
1.2.2模型制备 对照组仅切开皮肤不做进一步处理即缝合皮肤。模型组和模拟转染组大鼠,10%水合氯醛以300~350 mg/kg腹腔注射麻醉,颈正中纵向切口、分离皮下组织,用动脉夹钳夹颈总动脉、在颈外动脉上做一个小切口、插入缝合线至颈内动脉以阻断大脑中动脉的血液供应。放开颈总动脉夹后,将大鼠饲养在单独的笼子中直至复苏,并观察饮水状态和伤口。对照组未插入缝合线,其余操作与模型组同。在放开劲总动脉夹之前,保留缝合线的情况下对颈外动脉的切口进行缝合,并予以青霉素抗感染治疗。
1.2.3神经学受损功能评分 于手术后第1、10和15天时,采用改良的神经损伤严重程度评分量表(mNSS)评估各组大鼠的神经缺陷程度。mNSS标准分数从0分(正常)~21分(最大缺陷分数),得分越高提示神经功能受损程度越高。
1.2.4细胞转染方法 mNSS测试后处死大鼠,采用PCR检测miR-130a和PTEN mRNA转录水平,分离手术侧脑组织,加入质量/体积比为100 g/L的TRIzol试剂(Invitrogen公司,美国)。应用反转录聚合酶链反应(RT-PCR)检测miR-130a和PTEN基因的表达情况,miR-130a上游引物miR-130a-F为5′-ACACTCCAGCTGGGGCTCTTTTCACATTGT-3′,下游引物miR-130a-R为5′- CTCAACTGGTGTCGTGGAGTCGGCAATT CAGTTGAGAGTAGCAC-3′。PTEN上游引物PTEN-F为5′-GTGCAGATAATGACAAG-3′,下游引物PTEN-R为5′-GATTTGACGGCTCCTCT-3′。PCR扩增时64 ℃退火,延伸40 s,循环30次;并以GAPDH作为内参照,上游引物GAPDH-F为5′-GGAGCGAGATCCCTCCAAAAT-3′,下游引物GAPDH-R为5′-GTGCAGATAATGACAAG-3′;PCR扩增时62 ℃退火,延伸10 s,循环30次。结束后取反应液5 μL进行浓度为1%的琼脂糖凝胶电泳,凝胶成像系统检测PCR产物。模型组和模拟转染组大鼠的脑皮质细胞实施质粒转染。具有miR-130a模拟物,阴性对照载体获自Genechem公司(上海),以适当的密度接种后,使用Lipofectamine 2000试剂(Invitrogen公司,美国)转染细胞。细胞培养至密度为70%左右,采用0.25%胰酶消化细胞,完全培养基1 mL重悬细胞并计数。将细胞分为对照组、miR-130a抑制物阴性对照组和miR-130a抑制物组,分别接种于6孔板,每组3个复孔,置于5% CO2、37 ℃培养箱内培养24 h。miR-130a抑制物阴性对照组和miR-130a抑制物组采用脂质体2 000以100 pmol/LmiR-130a抑制物阴性对照或miR-130a抑制物转染细胞,于5% CO2、37 ℃培养箱内培养6 h后,更换完全培养基继续培养48 h,实时荧光定量PCR技术验证转染效率(计算方法:转染时质粒携带荧光标记,计算流式细胞仪检测后的荧光细胞比例),进行后续实验。
1.2.5萤光素酶法测定野生型-PTEN和突变型-PTEN表达的荧光素酶活性 将野生和突变的PTEN的3′UTR(PTEN3′UTR-WT或3′UTR-MUT)分别插入pGL3报道载体(Promega公司,美国)的下游,将带有miR-130a模拟物/抑制剂和PTEN-pGL3报告基因的载体共转染到脑组织中。转染后2 d,使用双重荧光素酶报告系统(Promega公司,美国)在Gen5酶标仪(BioTek,美国)上评估野生型-PTEN和突变型-PTEN表达的荧光素酶活性。
1.2.6TNF-α、IL-6和IL-10表达的测定 分离手术侧脑组织,使用ELISA试剂盒测量脑组织中TNF-α、IL-6和IL-10表达。
1.2.7TUNEL染色确定细胞凋亡水平 分离手术侧脑组织,制成石蜡切片。通过TUNEL染色检测脑组织的神经元凋亡水平:去石蜡,切片用3%过氧化氢处理10 min,磷酸盐缓冲液(PBS)冲洗3次,滴加蛋白酶K溶液,37 ℃孵育10 min;PBS冲洗3次,滴加TdT和DIG-d-UTP溶液,4 ℃孵育2 h;将切片用PBS冲洗3次后,在室温下用40 μL封闭缓冲液密封30 min,滴加抗体(1 ∶100),37 ℃的湿箱中孵育30 min;将切片用PBS冲洗3次后,滴加SABC-FITC二抗(1 ∶100),37 ℃孵育30 min,PBS冲洗3次;共聚焦荧光显微镜下观察并拍照,记录缺血半球中TUNEL阳性细胞数。
1.2.8蛋白质印迹法(Western blot)检测p-AKT、p-GSK3β和p-c-Raf蛋白的表达 分离手术侧脑组织,称重后加入放射免疫沉淀测定(RIPA)裂解缓冲液(北京TDY Biotech公司),质量/体积比为100 g/L以及1%的磷酸酶抑制剂和1%的蛋白酶抑制剂,匀浆、10 000 g和4 ℃下离心10 min,对总蛋白进行定量。制备十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶,在80 V下添加等体积的蛋白质样品进行电泳,湿法转膜;用新鲜制备的5%脱脂奶粉将蛋白条带密封1 h,与p-Akt(1 ∶1 000)、p-GSK3β(1 ∶1 000)、p-c-Raf(1 ∶1 000)和GAPDH(1 ∶1 000)在4 ℃过夜;用含Tween-20(TBST)的Tris缓冲盐水洗涤3次(5 min/次),与辣根过氧化物酶标记的山羊抗兔二抗(1 ∶5 000,上海碧云天公司)、室温下放置1 h,TBST洗涤3次(5 min/次),TBST洗膜5 min×3次,加人显影液,显影并拍照扫描后用Image J软件计算各条带的灰度值,并以目的蛋白条带灰度值与内参GAPDH灰度值比值表示目的蛋白相对表达量。
1.3 统计学方法
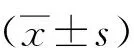
2 结果
2.1 mNSS评分
与对照组比较,模型组在第1、10、25时的mNSS评分均升高,差异有统计学意义(P<0.05);与模型组比较,模拟转染组大鼠在手术后第10、25天时mNSS评分均降低,差异有统计学意义(P<0.05);与术后第1天比较,模拟转染组大鼠在手术后第10、25天时mNSS评分均降低,差异有统计学意义(P<0.05)。提示随着手术时间的推延,miR-130a模拟物可降低模型组大鼠mNSS评分,miR-130a的表达可降低大鼠神经细胞的功能损伤程度。见表1。

表1 各组大鼠mNSS评分Tab.1 mNSS scores of rats in each group
2.2 miR-130a和PTEN mRNA表达
与对照组比较,模型组大鼠手术侧脑组织的miR-130amRNA表达降低,PTENmRNA表达升高,差异有统计学意义(P<0.05);与模型组比较,模拟转染组大鼠手术侧脑组织miR-130amRNA表达升高,PTENmRNA表达降低,差异有统计学意义(P<0.05)。见表2。

表2 手术侧脑组织miR-130a和PTEN mRNA表达Tab.2 Expression of miR-130a and PTEN mRNA in cerebral tissue of surgery side
2.3 野生型-PTEN和突变型-PTEN表达的荧光素酶活性
与对照组比较,模拟转染组脑组织的野生型-PTEN表达降低,突变型-PTEN表达也降低,差异有统计学意义(P<0.05)。见表3。

表3 两组大鼠野生型-PTEN和突变型-PTEN表达的荧光素酶活性Tab.3 Luciferase activity of wild-type-PTEN and mutant -PTEN
2.4 TNF-α、IL-6和IL-10表达
与对照组比较,模型组大鼠手术侧半球脑组织IL-10含量降低,IL-6和TNF-α含量升高,差异有统计学意义(P<0.05);与模型组比较,模拟转染组IIL-10含量升高,IIL-6和TNF-α含量降低,差异有统计学意义(P<0.05)。见表4。

表4 各组大鼠手术侧脑组织TNF-α、IL-6和IL-10表达Tab.4 Expression of TNF-α, IL-6, and IL-10 in brain tissue of rats in each group
2.5 脑细胞的凋亡
与对照组比较,模型组大鼠手术侧脑组织切片 TUNEL阳性细胞数量升高,差异有统计学意义(P<0.05);与模型组比较,模拟转染组TUNEL阳性细胞数量减少,差异有统计学意义(P<0.05)。见图1、表5。

对照组 模型组 模拟转染组图1 各组大鼠手术侧脑组织细胞凋亡水平(TUNEL染色)Fig.1 Apoptosis level of each group (TUNEL staining)

表5 TUNEL阳性细胞数Tab.5 Number of TUNEL positive cells
2.6 p-AKT、p-GSK3β和p-c-Raf蛋白表达
与对照组比较,模型组大鼠手术侧脑组织匀浆中 p-AKT(Ser473)、p-GSK3β(S9)、p-c-Raf(Ser338)蛋白表达降低,差异有统计学意义(P<0.05);与模型组比较,模拟转染组p-AKT、p-GSK3β、p-c-Raf蛋白表达升高,差异有统计学意义(P<0.05),提示miR-130a促进了PI3K/AKT途径的发生。见表6、图2。

表6 各组大鼠手术侧脑组织p-AKT、p-GSK3β和p-c-Raf蛋白表达Tab.6 Expression of p-AKT, p-GSK3β ,and p-c-Raf proteins in brain tissues of rats in each group

图2 各组大鼠手术侧脑组织p-AKT、p-GSK3β和p-c-Raf蛋白的表达Fig.2 Expression of p-AKT, P-GSK3β, and p-c-Raf
3 讨论
缺血性脑卒中是导致死亡的严重疾病,缺血性脑卒中血肿的数量和患者的并发症是影响预后的重要因素,可用于评估患者的预后[12-14]。根据世界卫生组织的流行病学调查,中风导致的死亡人数在所有主要疾病中排名第二,中风的特征是急性发作,高死亡率和许多并发症[15]。中国已逐渐步入人口老龄化阶段,中风已成为第一大死亡原因。中风具有较高的死亡率和致残率,脑梗死后随着空间的占用而迅速发生水肿,导致颅内高压和脑疝,并导致死亡[16]。miRNA是一组在体内起调节作用的非编码RNA,其广泛存在于许多真核生物中,与个体发育,能量代谢,细胞增殖和凋亡密切相关。miR-21和miR-181b等miRNA参与脑水肿的形成,其是影响中风患者预后的重要因素[17]。miR-130a是一种抗血管生成的转录因子。miR-130a在具有短暂缺血性脑卒中的糖尿病大鼠中也起着重要的调节作用[18]。本研究发现,模型组缺血性脑卒中组织中miR-130a的表达降低,行为实验结果表明模型组存在严重的神经损伤。干预脑组织中miR-130a的表达后,神经功能得以有效恢复,这说明miR-130a的高表达可能与缺血性脑卒中大鼠脑损伤密切相关。PTEN是具有磷酸酶活性的癌症抑制基因,与细胞侵袭,迁移和凋亡有关[19]。PI3K是PTEN的最重要底物,是细胞增殖的重要信使,PTEN可特异性作用于PI3K来调节Akt的磷酸化。p-Akt可直接或间接调节凋亡蛋白的活性,从而干扰细胞增殖并阻止细胞周期,并最终导致凋亡[20]。PTEN磷酸化后,将导致结构不稳定,磷酸酶活性将丧失。本研究发现,脑卒中会升高脑组织中PTEN的磷酸化水平,从而抑制PI3K/Akt并导致大鼠神经元损伤。本研究中模型组脑组织神经元凋亡水平升高,促炎因子IL-6和TNF-α水平升高,而抗炎因子IL-10水平降低。
本研究发现,在模型miR-130a均下调,且miR-130a通过PTEN/PI3K/AKT信号通路保护了脑I/R损伤,为急性脑I/R损伤的诊断和治疗提供了新思路。miR-130a与多种疾病有关,包括肿瘤和脑缺血性损伤。miR-130a在食管鳞状细胞癌的肿瘤生物学中起着至关重要的作用。miR-130a在胃癌中被上调并促进血管生成和细胞生长。缺血性卒中患者血浆中miR-130a水平的降低与疾病风险呈负相关。miR-130a在脑缺血损伤中的表达降低。据报道,抑制PTEN增加了PI3K/AKT轴的激活。PTEN可作为miR-21的靶标,可参与针对心肌损伤的保护作用。PTEN作为miR-130a的靶标,并推翻了miR-130a在脑I/R损伤中的神经保护作用。除此之外,miR-130a过表达通过抑制PTEN增强了PI3K/AKT轴的激活。
综上所述,miR-130a还可通过激活PI3K/AKT轴和抑制PTEN来防止缺血性卒中引起的神经功能缺损。
