异化铁还原菌介导的硝酸盐还原亚铁氧化过程
2021-09-06张相杰陈国俊李涵李芳柏刘同旭
张相杰,陈国俊,李涵,李芳柏,刘同旭
(1.华南农业大学 资源环境学院,广州 510650;2.广东省科学院 生态环境与土壤研究所;华南土壤污染控制与修复国家地方联合工程研究中心;广东省农业环境综合治理重点实验室,广州 510650)
铁是地壳中第四丰富的元素,也是生物圈中最普遍存在的氧化还原活性金属[1]。铁长期以来被认为是生命所必须的,铁氧化菌(FeOB)与铁还原菌(FeRB)驱动了铁的生物地球化学循环。铁循环过程控制着土壤有机物矿化、甲烷排放、重金属的吸附固定、反硝化等环境过程,是连接土壤养分循环与污染物转化的纽带,是推动物质循环与能量代谢的重要引擎[2-6]。氮是核苷酸和氨基酸的基本组成元素,是构成生命的基本元素,从根本上影响着大多数生态系统的结构和功能[7]。硝酸盐作为氮循环网络的关键节点,在自然界氮循环过程中起着至关重要的作用。在农业生产中,氮素的输入至关重要,而微生物的反硝化作用会导致氮素的大量流失[8]。微生物通过反硝化过程、异化硝酸盐还原成铵、厌氧氨氧化竞争性还原硝酸盐[9]。硝酸盐还原的产物N2O作为重要的温室气体,超过60%的排放来自农业土壤,而土壤中超过2/3的N2O排放可归因于细菌和真菌生物与非生物反硝化过程共同作用的结果[10-11]。因此,微生物驱动的硝酸盐还原过程对元素地球化学循环、农业生产、温室气体排放等方面具有重要意义。

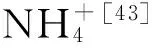
笔者选取发酵型和呼吸型两种铁还原菌作为模式菌株,研究其驱动NRFO过程。设置不同铁还原微生物驱动NRFO过程的对照实验,对反应物和生成物反应动力学进行分析,对不同处理组的次生矿物进行对比,研究目的包括:探究不同类型铁还原菌、硝酸盐还原菌的NRFO过程动力学和矿物学差异,揭示铁还原菌驱动的NRFO过程的反应机制和影响因素。该研究可拓展NRFO过程的微生物范畴,揭示厌氧环境微生物驱动的NRFO过程中的微生物功能与贡献。
1 实验
1.1 实验材料
实验采用的微生物为发酵型兼性厌氧铁还原菌KlebsiellapneumoniaeL17[46]、呼吸型兼性厌氧铁还原菌ShewanellaoneidensisMR-1[47],来自海洋微生物菌种保藏管理中心(Marine Culture Collection of China, MCCC);呼吸型兼性厌氧铁还原菌Shewanellaputrefaciensstrain CN32[48],来自广东省微生物菌种保藏中心(Guangdong Microbial Culture Collection Center, GDMCC)。好氧培养基成分为NaCl 5 g/L、牛肉浸膏5 g/L、蛋白胨10 g/L,pH值调至7.0,并对培养基进行高温高压灭菌处理。将-80 ℃冰箱中保存的微生物(1 mL)取出解冻后,在超净工作台倒入好氧培养基中,在恒温震荡培养箱中活化培养14 h(30 ℃,180 r/min),然后放置在超净工作台,取1 mL菌液转接到好氧培养基中,在恒温震荡培养箱中继续培养14 h(30 ℃,180 r/min)。对100 mL西林瓶、纯水用100% N2充气30 min排氧,并高温高压灭菌,然后在厌氧工作站中配制亚铁母液(FeSO41 mol/L),用橡胶塞压紧并用铝盖进一步密封,平衡24 h后,用0.22 μm滤头过滤并进行避光保存。配制葡萄糖母液(1 mol/L)、乳酸盐母液(1 mol/L),并用0.22 μm滤头过滤,然后用100% N2充气30 min排氧。微量元素储备液SL14和维生素储备液V10的具体配方参考文献[49],用0.22 μm滤头过滤之后,再用100% N2充气30 min排氧。配制30 mmol/L的哌嗪-1,4-二乙磺酸(PIPES)作为洗菌和实验体系的缓冲液(pH=7.0)。
1.2 实验方案及测试方法
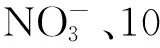

表1 不同铁还原菌、不同亚铁浓度的处理组
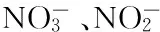
2 实验结果与讨论
2.1 硝酸盐还原动力学
不同亚铁浓度条件下,3种异化铁还原菌的硝酸盐还原动力学曲线见图1,3种异化铁还原菌的硝酸盐还原准一级速率常数见表2。结果表明,不加亚铁情况下,L17和CN32体系的硝酸盐在1.6 d时被完全还原,硝酸盐还原的准一级速率常数分别为1.772、1.672/d(表2),说明L17和CN32的硝酸还原能力接近。MR-1体系与L17和CN32不同,在0~16 h硝酸盐迅速还原,在16~64 h硝酸盐还原速率变慢,在第3天,硝酸盐被完全还原。硝酸盐还原准一级速率常数0.674/d,显著低于L17和CN32。分别在体系中添加1、5 mmol/L亚铁,结果显示,硝酸盐的还原均受到显著抑制。亚铁为1 mmol/L条件下,微生物硝酸盐还原速率明显高于高浓度亚铁条件,反应在第7天已达到稳定,L17菌在第7天将硝酸盐完全还原;CN32体系的硝酸盐在第4天基本被还原;说明低浓度亚铁抑制了L17、CN-32硝酸盐还原速率,但硝酸盐最终能被完全还原。在MR-1体系,初始阶段硝酸盐还原速率较快,之后迅速达到平衡,硝酸盐被还原30%,说明低浓度亚铁显著的抑制了MR-1硝酸盐还原过程。综上所述,在低浓度亚铁条件下,微生物硝酸盐还原速率为CN32(0.563/d)>L17(0.179/d)>MR-1(0.034/d)。在高浓度5 mmol/L亚铁条件下,L17处理组仅仅有0.7 mmol/L硝酸盐被还原,CN32处理组在反应12 d后,1 mmol/L硝酸盐被还原,MR-1处理组在反应12 d后,1.6 mmol/L硝酸盐被还原,其准一级速率常数分别为0.010/d、0.014/d、0.010/d,显著低于1 mmol/L亚铁处理以及不加亚铁的处理。3种菌在高浓度亚铁条件下,反应前期少量的硝酸盐被还原,之后硝酸盐还原过程停滞,表明了高浓度亚铁对微生物硝酸盐还原具有显著的抑制作用。综上所述,亚铁的添加抑制了微生物硝酸盐还原过程,而随着亚铁浓度的升高,对微生物还原硝酸盐的抑制作用增强,亚铁对不同类型铁还原微生物硝酸盐还原的抑制程度存在差异。

表2 硝酸盐还原亚铁氧化过程中亚铁氧化和硝酸盐还原的准一级速率常数
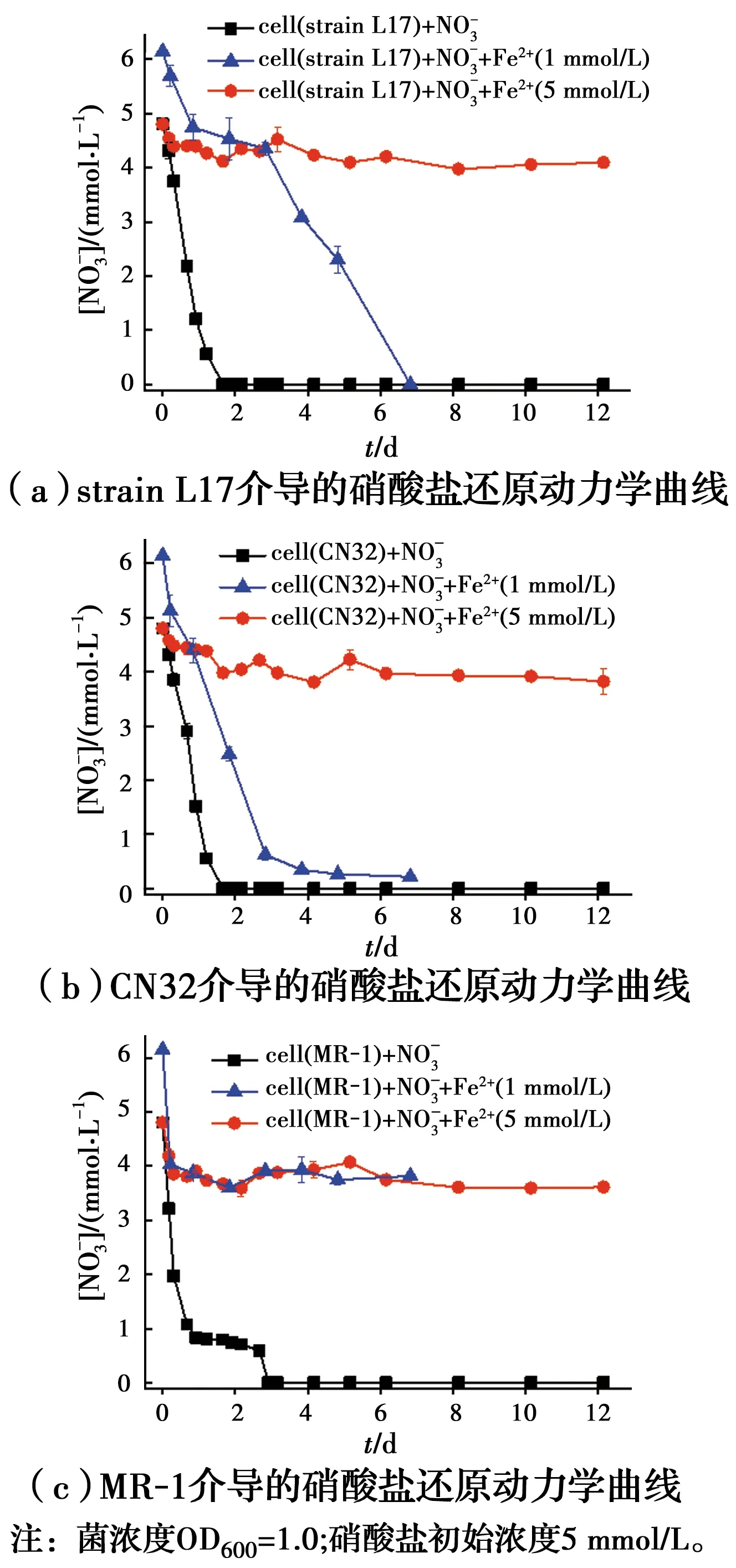
图1 异化铁还原菌的硝酸盐还原反应动力学曲线
2.2 亚硝酸盐和铵根生成动力学
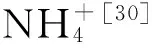
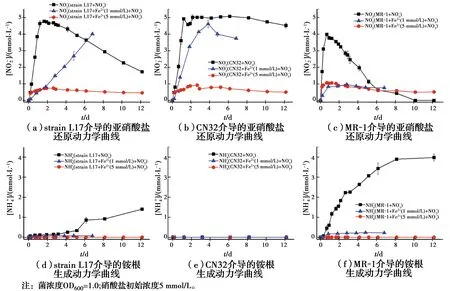
图2 不同亚铁浓度条件下异化铁还原菌的亚硝酸盐生成、铵根生成反应动力学曲线
2.3 亚铁氧化动力学
亚铁氧化动力学如图3所示。在未添加硝酸盐的条件下,L17、CN32和MR-1均不能生物氧化亚铁;而加入硝酸盐后,在1、5 mmol/L Fe2+的体系中均发生了氧化,在厌氧无催化剂存在的条件下,亚铁和硝酸盐不能直接发生化学反应[31, 51]。说明铁还原条件下的亚铁氧化是由硝酸盐还原导致的。对于1 mmol/L Fe2+,在L17体系中,亚铁在第4天接近完全氧化;CN32体系亚铁完全氧化耗时6 d;MR-1体系中,直到第7天亚铁仅氧化14.4%。其准一级速率常数分别为L17(0.066/d)、CN32(0.051/d)、MR-1(0.034/d)(表2)。在5 mmol/L Fe2+条件下,第12天L17、CN32、MR-1体系中分别有57.1%、51.4%、34.1%的亚铁发生氧化,其准一级速率常数分别为L17(0.066/d)、CN32(0.051/d)、MR-1(0.034/d)。上述结果表明,3种铁还原菌的亚铁氧化速率为L17>CN32>MR-1,亚铁氧化速率不同的原因是,不同微生物的硝酸盐还原速率的差异以及代谢途径的不同。在L17和CN32体系中,高浓度亚铁不完全氧化,但低浓度亚铁可以完全氧化;MR-1在不同的亚铁浓度下均表现为亚铁的不完全氧化。

图3 不同亚铁浓度条件下铁还原微生物的亚铁氧化动力学曲线
2.4 次生矿物表征
亚硝酸盐与亚铁化学反硝化作用生成的次生矿物分为3部分,一部分沉淀于细胞周围环境(绿色箭头所示),一部分粘附在细胞表面但结合并不紧密(蓝色箭头所示);一部分沉淀生成在细胞表面或者外膜,形成细胞结壳(红色箭头所示)。如图4所示。

图4 高浓度亚铁条件下硝酸盐还原亚铁氧化过程生成矿物的SEM结果(菌浓度OD600=1.0;硝酸盐初始浓度5 mmol/L)
在Fe2+浓度为5 mmol/L的条件下,次生矿物大量附着在细胞表面,3种微生物均发生了明显的细胞结壳,导致在高浓度亚铁条件下硝酸盐还原速率远远低于低浓度亚铁浓度。在Fe2+浓度为1 mmol/L条件下,如图5所示。

图5 低浓度亚铁条件下硝酸盐还原亚铁氧化过程生成矿物的SEM结果(菌浓度OD600=1.0;硝酸盐初始浓度5 mmol/L)
L17和CN32亚铁氧化生成铁氧化物并沉淀在细胞表面,会阻碍硝酸盐进入细胞周质进行还原。然而,大部分微生物没有结壳,所以,在反应后期,硝酸盐仍然能被完全还原;而且L17细胞表面沉淀的次生矿物明显多于CN32,导致L17硝酸盐还原速率明显低于CN32。低浓度亚铁条件下,MR-1处理组亚铁几乎没有被氧化,所以,未收集到次生矿物,这可能是因为亚铁的添加导致了细胞活性降低,从而抑制了硝酸盐还原过程。同时,对次生矿物类型进行了XRD表征,如图6所示,结果表明,在高浓度亚铁条件下,3种铁还原微生物处理组生成的结晶态矿物主要为针铁矿。亚铁与亚硝酸盐化学反应生成的铁氧化物主要为针铁矿和纤铁矿[50]。在低浓度亚铁条件下,生成的铁氧化物除了针铁矿之外,还生成了结晶度较差的水铁矿,说明亚铁氧化成矿的结晶度与亚铁浓度正相关。
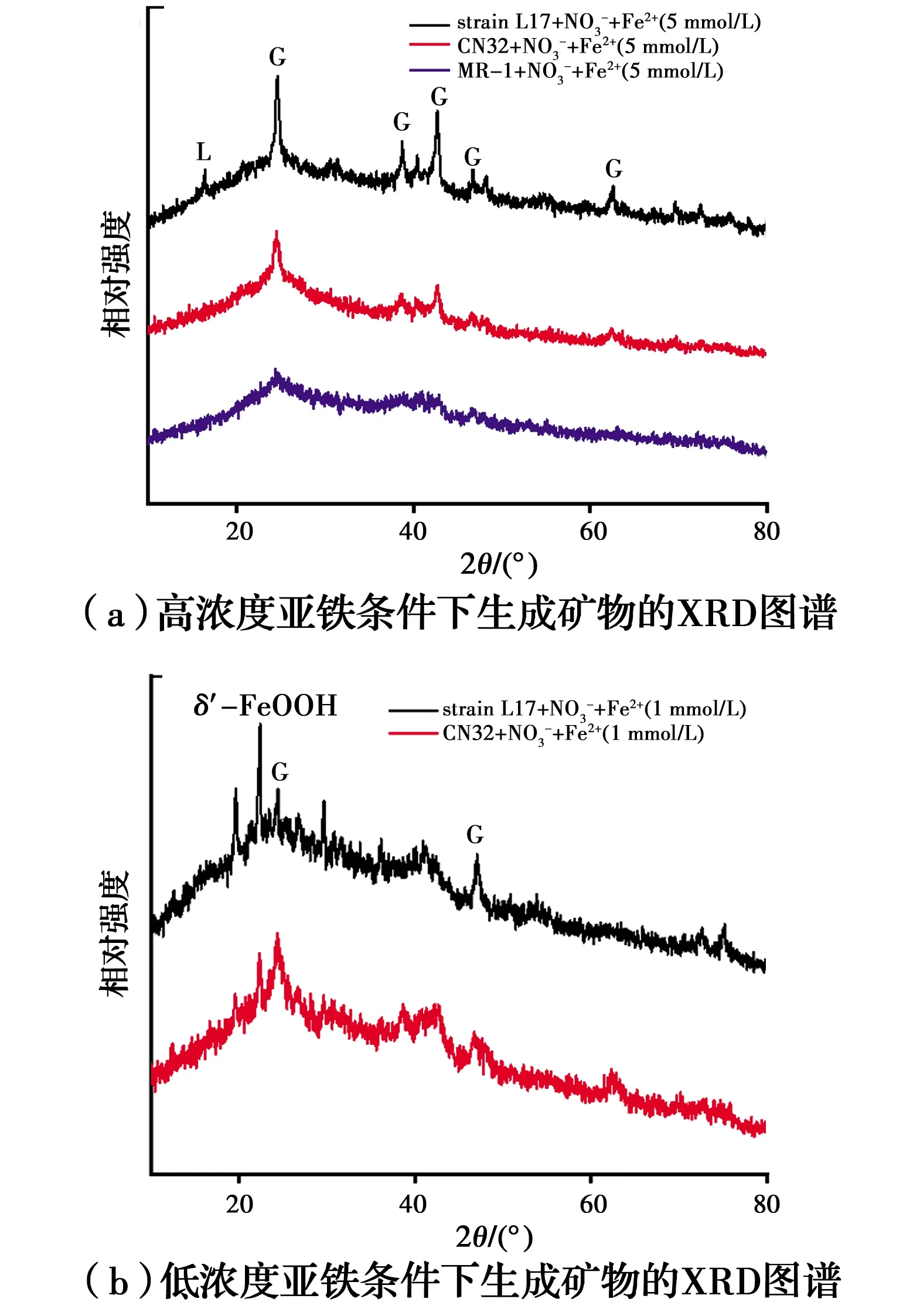
图6 不同亚铁浓度下硝酸盐还原亚铁氧化生成矿物的XRD图谱(菌浓度OD600=1.0;硝酸盐初始浓度5 mmol/L)
综上所述,亚铁氧化成矿并附着在细胞表面,能影响微生物硝酸盐还原。随着亚铁浓度的提高,细胞结壳逐渐增加,次生矿物结晶度提高,阻碍硝酸盐进入细胞周质进行还原,导致了硝酸盐还原速率明显降低甚至完全停滞,从而抑制了微生物的代谢活动[52]。
2.5 反应机制与环境意义

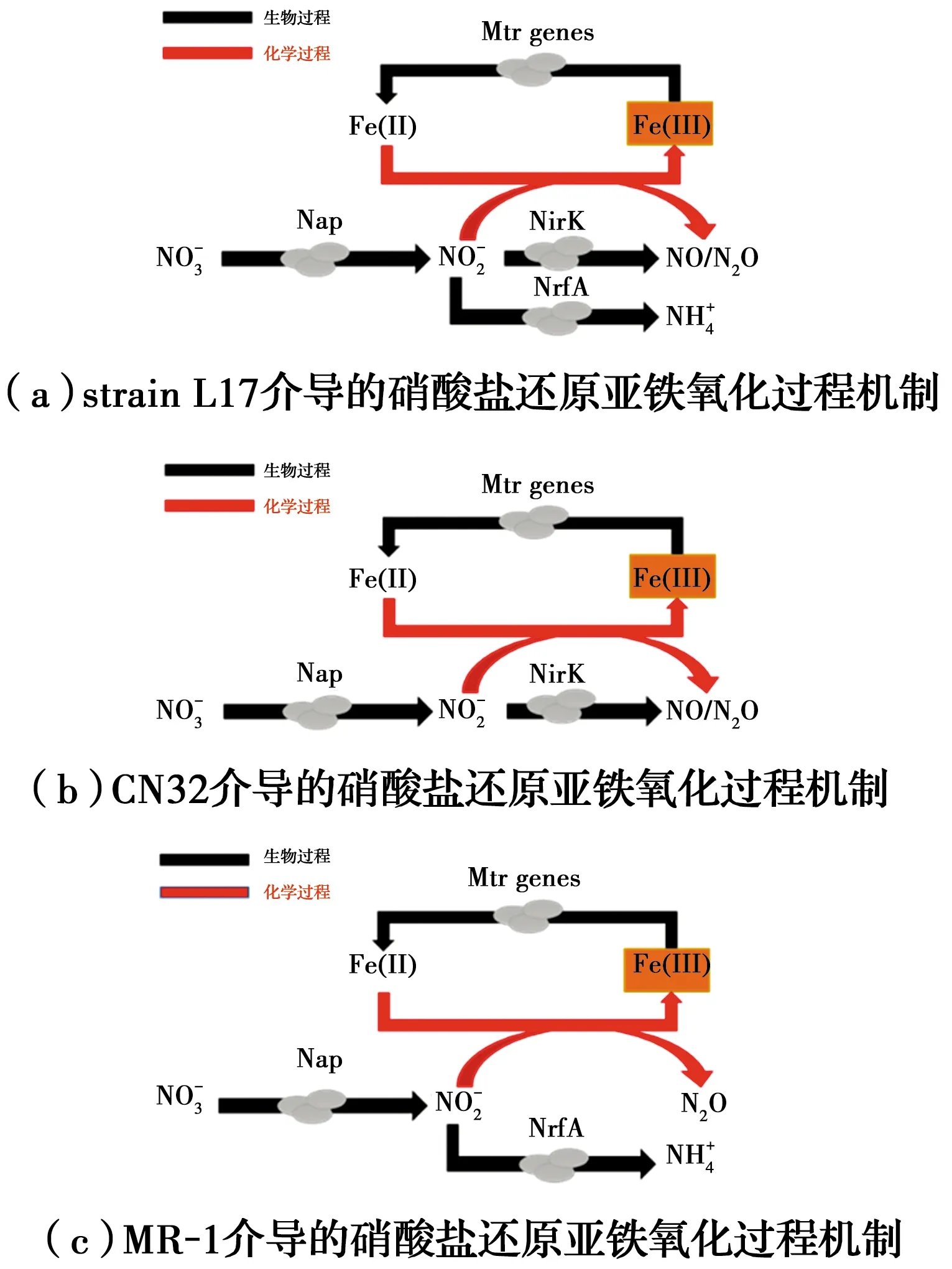
图7 异化铁还原菌介导的硝酸盐还原亚铁氧化过程机制
铁还原菌还原铁主要通过3种途径:铁还原菌与铁氧化物直接接触;细胞分泌胞外螯合物提高铁矿物溶解性,促进铁还原过程;细胞分泌或者利用周围环境的电子穿梭体,通过胞外电子传递过程进行铁还原[57]。铁还原菌介导的Fe-N循环已有报道,铁氧化物作为电子受体被微生物还原为亚铁,亚铁被亚硝酸盐化学氧化,生成的铁氧化物仍然能够作为铁还原菌的电子受体被还原,实现铁的氧化还原循环。对于亚硝酸盐来说,一方面被亚铁化学还原,另一方面能够作为微生物的电子受体,被生物还原[58-59]。说明铁还原菌介导的铁氧化还原循环和硝酸盐的持续还原理论上可行。但研究当中没有发现明显的铁还原过程,其主要原因可能是:1)细胞结壳一方面限制微生物的运动、生长和营养物的摄入,导致微生物铁还原相关酶活性的降低,阻碍铁还原菌胞外电子传递。另一方面微生物不能有效地利用细胞表面铁氧化物作为电子受体[36, 60]。2)硝酸盐还原过程抑制了铁还原过程。目前的研究表明,细胞色素CymA能够参与多种电子受体的还原过程,微生物更倾向于利用硝酸盐作为电子受体,所以硝酸盐还原CymA的电子传递过程可能导致铁还原速率的减慢,表现为硝酸盐和铁的竞争性还原[44, 61]。3)由于较高浓度亚硝酸盐的存在,导致铁还原生成亚铁发生再氧化。4)体系残留的亚铁吸附在铁氧化物表面,导致铁活性的降低,微生物无法进行生物铁还原过程。
研究表明,厌氧环境中多种微生物群落参与NRFO过程[62]。本研究强调了在厌氧富铁环境中非模式菌驱动的NRFO过程,表明在厌氧环境中NRFO过程并不是单一微生物驱动的,非亚铁氧化功能菌也能够驱动NRFO过程。在低氮肥施加水稻土和厌氧沉积物中,微生物硝酸盐异化还原为铵(DNRA)在硝酸盐代谢途径中占有主导地位[63-64]。铁还原菌DNRA生成铵根,然后被植物或者其他微生物吸收利用,有利于厌氧环境氮沉积和再循环。厌氧富铁环境中亚铁显著抑制微生物DNRA过程,亚铁竞争性还原亚硝酸盐导致微生物产铵的大量减少,生成的NO和N2O释放到大气中,造成厌氧环境中氮损耗[39]。细胞结壳阻碍硝酸盐等电子受体进入细胞还原,导致硝酸盐的不完全还原,同时限制微生物的运动、生长、营养物质摄入[60]。该研究表明,细胞结壳抑制了异化铁还原菌介导的NRFO过程,细胞结壳对不同铁还原菌的抑制机制不同。本工作丰富了硝酸盐还原亚铁氧化的研究思路,加深了对微生物驱动的NRFO反应机制的理解。
3 结论
铁还原菌能够通过硝酸盐还原的中间产物亚硝酸盐与亚铁的化学反硝化作用实现亚铁氧化过程。亚铁抑制了微生物硝酸盐还原、亚硝酸盐和铵根的生成。低浓度亚铁条件下,亚铁降低了L17和CN32硝酸盐还原速率,而亚铁完全抑制了MR-1硝酸盐还原,其抑制顺序为MR-1>L17>CN32。亚铁严重抑制了硝酸盐异化还原成铵过程。在高浓度亚铁条件下,亚铁氧化成矿明显抑制了微生物硝酸盐还原过程。在低浓度亚铁条件下,对于L17和CN32来说,亚铁氧化生成的铁氧化物抑制了微生物的硝酸盐还原,但大部分微生物没有完全结壳,所以,硝酸盐最终能被完全还原,且CN32硝酸盐还原速率明显高于L17。亚铁毒害作用抑制了L17硝酸盐还原过程,也是影响MR-1硝酸盐还原的主要原因。随着亚铁浓度的升高,微生物细胞结壳程度越高,细胞的完全结壳是硝酸盐还原停滞的主要原因。本研究拓展了硝酸盐还原亚铁氧化过程的微生物类型,加深了对微生物介导的硝酸盐还原亚铁氧化的理解,对研究微生物介导的铁-氮循环过程具有重要的意义。
