脓毒症并发急性肾损伤患者血清MCP-1、MFG-E8、sCD14-ST的表达及临床意义
2021-09-05高君兰朱丹丹于健
高君兰,朱丹丹,于健
大连医科大学附属第二医院重症医学科,辽宁 大连116027
脓毒症主要是指由可疑或明确感染导致的一组全身炎症反应综合征,是重症监护室(Intensive Care Unit,ICU)较为常见的危急重症之一,可能引发多器官功能障碍,严重威胁患者的生命健康安全[1]。相关研究报道显示,脓毒症晚期患者主要病理表现以组织血流灌注降低、微循环血流量减少以及尿量减少等为主,从而可能导致急性肾损伤(acute kidney injury,AKI)的发生风险升高[2]。而AKI的发生会促进脓毒症患者的病情恶化,从而增加患者的死亡率,已受到国内外广泛关注。由此可见,充分掌握脓毒症患者并发AKI的危险因素显得尤为重要,可为临床针对性干预措施的制定、实施提供参考依据,以期改善患者预后。随着近年来相关研究的日益深入,有学者发现单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)作为机体遗传易感基因之一,可能参与了脓毒症的发生以及临床转归过程,有望成为诊断脓毒症并发AKI的可靠生物学指标[3]。此外,乳脂球表皮生长因子8(milk fat globule-epidermal growth factor-factor 8,MFG-E8)主要介导了凋亡细胞的清除,其吞噬作用可有效预防死亡细胞可能引起的免疫损伤[4]。此外,可溶性白细胞分化抗原14亚型(soluble CD14-subtype,sCD14-ST)主要是脂多糖结合蛋白复合物受体-sCD14的一个片段,可能发挥细菌感染吞噬作用[5]。鉴于此,本文通过研究脓毒症患者血清MCP-1、MFG-E8、sCD14-ST的表达水平及临床意义,旨在为临床脓毒症并发AKI的诊治提供新的靶点与思路。
1 资料与方法
1.1 一般资料 将2018年1月至2020年10月大连医科大学附属第二医院重症医学科收治的120例脓毒症患者纳入研究,其中男性74例,女性46例;年龄32~79岁,平均(54.63±14.30)岁;高血压病史60例,糖尿病史64例,肺部感染81例;急性生理与慢性健康状况评估Ⅱ(acute physiology and chronic health evaluation,APACHEⅡ)评分为11~19分,平均(16.07±0.45)分。入选标准:(1)所有入选对象均和《2012国际严重脓毒症及脓毒性休克诊疗指南》[6]中所制定的相关诊断标准相符,合并AKI的患者符合诊断标准[7]:48 h内肾功能急剧下降,肌酐上升>基线值的50%,或尿量减少超过6 h;(2)年龄均在20岁以上;(3)无临床病历资料的缺失。排除标准:(1)免疫功能障碍或(和)长期接受免疫抑制剂治疗者;(2)合并恶性肿瘤者;(3)神志异常或合并神经系统疾病者。将其按照是否并发AKI分组AKI组57例和非AKI组63例。本研究经医院伦理委员会批准。
1.2 研究方法(1)基线资料采集:通过医院自制的基线资料调查表完成,主要内容包括年龄、性别、高血压病史、糖尿病史、肺部感染以及APACHEⅡ评分。其中APACHEⅡ评分标准如下[8]:主要内容包括年龄评分(6分);急性生理学评分:①体温;②心率;③血压;④氧分压;⑤动脉血PH;⑥呼吸频率;⑦血清肌酐;⑧血清钾;⑨血清钠;⑩红细胞压积以及白细胞计数等生理指标,共44分;慢性健康状况评分:有无慢性严重器官系统功能不全或免疫损害(5分),总分55分。(2)实验室生化指标检测:主要指标有氧合指数、动脉血乳酸、尿素氮(blood urea nitrogen,BUN)以及血肌酐(serum creatinine,Scr)。(3)血 清MCP-1、MFG-E8、sCD14-ST水平检测:分别采集所有受试者清晨空腹静脉血3 mL,以3 000 r/min作为离心条件,开展时长为10 min的离心处理,获取血清通过酶联免疫吸附法进行上述指标水平的检测,操作务必遵循试剂盒(均购自深圳晶美生物科技有限公司)说明书完成。
1.3 观察指标 比较两组患者的血清MCP-1、MFG-E8、sCD14-ST水平,分析脓毒症并发AKI的影响因素及血清MCP-1、MFG-E8、sCD14-ST诊断脓毒症并发AKI的效能。
1.4 统计学方法 应用SPSS22.0软件进行数据统计分析,计量数据经正态性检-验及方差齐性检验,符合正态分布,以均数±标准差(±s)表示,组间比较采用t检验。计数资料比较采用χ2检验。采用多因素Logistic回归分析明确脓毒症并发AKI的影响因素,并以ROC曲线分析血清MCP-1、MFG-E8、sCD14-ST诊断脓毒症并发AKI的效能。检验水准为α=0.05。以P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者的血清MCP-1、sCD14-ST、MFG-E8水平比较AKI组患者的血清MCP-1、sCD14-ST水平明显高于非AKI组,而MFG-E8水平明显低于非AKI组,差异均有统计学意义(P<0.05),见表1。
表1 两组患者的血清MCP-1、MFG-E8、sCD14-ST水平比较(±s)
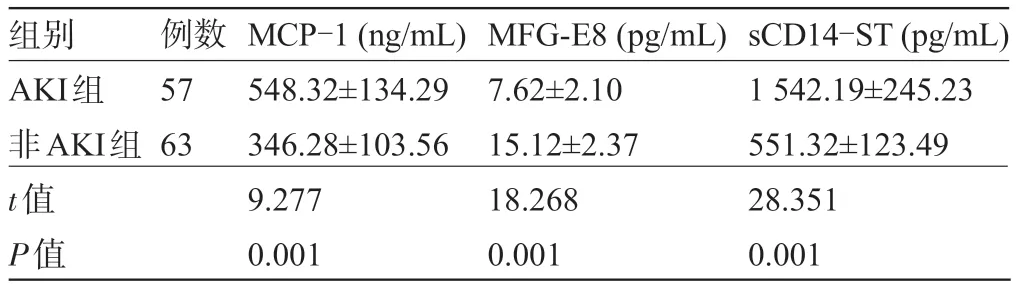
表1 两组患者的血清MCP-1、MFG-E8、sCD14-ST水平比较(±s)
注:1 mmHg=0.133 kPa。
组别 例数MCP-1(ng/mL)MFG-E8(pg/mL)sCD14-ST(pg/mL)AKI组57548.32±134.297.62±2.101 542.19±245.23非AKI组63346.28±103.5615.12±2.37551.32±123.49 t值9.27718.26828.351 P值0.0010.0010.001
2.2 影响脓毒症患者并发AKI的因素AKI组患者的高血压病史、肺部感染人数占比明显高于非AKI组,且APACHEⅡ评分和动脉血乳酸、BUN、Scr水平明显高于非AKI组,而氧合指数明显低于非AKI组,差异均有统计学意义(P<0.05),但两组患者的年龄、性别、糖尿病史比较差异均无统计学意义(P>0.05),见表2。
表2 影响脓毒症患者并发AKI的因素[±s,例(%)]

表2 影响脓毒症患者并发AKI的因素[±s,例(%)]
因素AKI组(n=57)非AKI组(n=63)χ2/t值P值年龄(岁)54.22±14.2955.01±14.350.3020.763性别(男/女)35/2239/240.0030.955高血压病史40(70.18)20(31.75)17.6780.001糖尿病史30(52.63)34(53.97)0.0210.883肺部感染46(80.70)35(55.56)8.6260.003 APACHEⅡ评分(分)18.73±0.3913.66±0.7446.2310.001氧合指数(mmHg)192.34±9.25251.38±12.3429.4080.001动脉血乳酸(mmol/L)2.47±0.120.67±0.1089.5590.001 BUN(mmol/L)18.12±1.027.56±0.9459.0190.001 Scr(μmol/L)276.32±73.45106.23±30.4516.8550.001
2.3 影响脓毒症患者并发AKI的多因素Logistic回归分析 以脓毒症并发AKI为因变量,赋值如下:并发AKI=1,未并发AKI=0。以表2中有统计学意义的因素,如高血压病史、肺部感染、APACHEⅡ评分、氧合指数、动脉血乳酸、BUN、Scr、MCP-1、MFG-E8、sCD14-ST水平为自变量,赋值如下:高血压病史=1,无高血压病史=0;肺部感染=1,无肺部感染=0;其余自变量均为原值输入。经多因素Logistic回归分析发现,高血压病史、肺部感染、APACHEⅡ评分、动脉血乳酸以及血清MCP-1、sCD14-ST水平均是脓毒症并发AKI的独立危险因素(P<0.05),而血清MFG-E8水平是脓毒症并发AKI的保护性因素(P<0.05),见表3。

表3 脓毒症并发AKI的多因素Logistic回归分析
2.4 血清MCP-1、MFG-E8、sCD14-ST诊断脓毒症并发AKI的效能 经ROC曲线分析结果显示,血清MCP-1、MFG-E8、sCD14-ST联合检测诊断脓毒症并发AKI的曲线下面积、灵敏度、特异度、约登指数均高于上述三项指标单独诊断,差异均有统计学意义(P<0.05),见表4和图1。

表4 血清MCP-1、MFG-E8、sCD14-ST诊断脓毒症并发AKI效能的ROC曲线分析

图1 各指标单独及联合诊断脓毒症并发AKI效能的ROC曲线
3 讨论
随着近年来人口老龄化问题的日益凸显以及侵入性医疗手段的应用日益广泛,脓毒症的发病率正呈逐年攀升趋势,其中AKI是脓毒症患者常见并发症之一,关于其具体发病机制尚未完全阐明,可能与内皮细胞功能异常、炎症细胞肾浸润以及肾小管细胞坏死等密切相关[9-10]。另有研究报道认为,脓毒症并发AKI可能和内毒素刺激一氧化氮合成密切相关[11]。众所周知,脓毒症并发AKI会延长患者的住院时间,增加患者家庭以及社会的经济负担,并会导致患者死亡率升高。由此可见,早期诊断脓毒症合并AKI以及明确相关危险因素显得尤为重要,亦是目前临床广大医务工作者共同关注的热点。MCP-1是内皮活化、单核细胞趋化及白细胞功能调控的重要分子,参与了炎症反应[12];MFG-E8是一种抗炎因子,介导了炎症、损伤性疾病的发生发展过程;sCD14-ST是潜在的生物标志物,于细菌感染以及脓毒症、多脏器衰竭等疾病发生、发展中具有重要作用[13]。随着近年来相关研究的日益深入,越来越多的学者发现脓毒症合并AKI患者存在MCP-1、MFG-E8、sCD14-ST异常表达,且与脓毒症合并AKI患者的病情危重程度密切相关。因此,上述三项指标可能具备作为预测脓毒症合并AKI标志物的潜质。
本研究发现,血清MCP-1、sCD14-ST在脓毒症并发AKI患者中均存在明显高表达,而MFG-E8存在明显低表达。考虑原因可能在于MCP-1主要是由单核细胞以及肾小管上皮细胞分泌而来的强效化学激活合成物,可刺激多种炎症因子以及NF-κB的活性,进一步调控脓毒症并发AKI的发生、发展[14]。MFG-E8参与了凋亡细胞清除过程,其吞噬作用可预防死亡细胞所引发的免疫损伤,从而维持机体免疫稳态,修复损伤组织,进一步减轻炎症反应[15]。当机体出现细菌或其他病原微生物感染时,细胞噬菌过程中有溶酶体酶的参与,而溶酶体膜会促使细胞膜上的sCD14大量释放入血,继而导致患者血清sCD14-ST水平显著升高[16]。此外,本研究表明,高血压病史、肺部感染、APACHEⅡ评分、动脉血乳酸以及血清MCP-1、sCD14-ST水平均是脓毒症并发AKI的独立危险因素,而血清MFG-E8水平是脓毒症并发AKI的保护因素。分析原因,高血压患者长期处于高血压状态,肾小球囊内高滤过、高灌注明显,从而可能导致肾实质缺血,增加了AKI发生风险。肺部感染的发生会导致肾脏血液灌注减少,继而引起肾小球滤过率的降低以及急性肾缺血,从而导致肾小管上皮细胞的变性、坏死,同时会激活肾素-血管紧张素系统,刺激肾小动脉收缩,加剧肾缺血,引发急性肾小管坏死,诱发AKI。APACHEⅡ评分越好往往反映了患者预后不良,且肾脏生理功能显著降低,可能促使肾脏相应结构的改变,增厚肾基底膜,从而促使肾小管上皮细胞发生萎缩、变性等,最终提高了AKI发生概率。乳酸是主要源自细胞无氧酵解,AKI患者普遍微循环功能降低,从而抑制了细胞组织的氧供以及营养物质,导致细胞无氧酵解增多,造成乳酸堆积[17]。血清MCP-1、sCD14-ST水平的升高以及MFG-E8水平的降低往往预示着机体炎症反应以及免疫损伤的加剧,感染程度的增加,患者普遍病情较重,并发AKI的风险随之升高。sCD14-ST可通过单核细胞以及巨噬细胞等直接释放入血,可识别多种细菌产物,激活炎症反应,进一步刺激AKI的发生。MCP-1作为一种强效化学激活合成物,可诱导炎症因子以及NF-κB的活性,进一步刺激AKI的发生。MFG-E8通过介导凋亡细胞的清除途径,维持机体免疫稳态,发挥修复损伤组织以及减轻炎症反应的作用,进一步抑制AKI的发生[18]。另外,血清MCP-1、MFG-E8、sCD14-ST联合检测诊断脓毒症并发AKI的效能较佳,提示了在今后的临床实际工作中可能通过联合检测上述三项血清学指标水平,继而为脓毒症并发AKI的诊断提供可靠依据。究其原因可能是联合检测时具有一定的协同互补作用。
综上所述,血清MCP-1、MFG-E8、sCD14-ST与脓毒症并发AKI密切相关,即随着血清MCP-1、sCD14-ST水平的升高以及MFG-E8水平的降低,脓毒症并发AKI风险增加,可能作为临床诊断的可靠生物学指标。
