基于钙敏感受体分子表达水平探讨大鼠脂肪组织胰岛素抵抗发病机制
2021-09-04阚玉娜谢佳明简白羽马立威陈哲王文豹刘吉成黑龙江中医药大学哈尔滨50040齐齐哈尔医学院黑龙江齐齐哈尔6006
阚玉娜,谢佳明,简白羽,马立威,陈哲,王文豹,刘吉成*(.黑龙江中医药大学,哈尔滨50040;.齐齐哈尔医学院,黑龙江 齐齐哈尔 6006)
糖尿病(DM)是一种常见的代谢性疾病,其特征是血糖水平异常升高,这可能会导致多系统并发症,包括糖尿病性酮症酸中毒,肾衰竭,心血管损害甚至死亡。2015年,全世界约有4.15亿人患有糖尿病,到2040年,预计将超过6.4亿[1],90%为2 型糖尿病(T2DM)[2]。胰岛素抵抗(IR)是T2DM 的主要原因,是指其靶细胞对胰岛素敏感性降低或丧失,导致葡萄糖耐受性降低,动脉高血压,以及葡萄糖和脂质代谢紊乱,最终导致多种并发症,例如非酒精性脂肪肝疾病、心血管疾病和代谢紊乱[3-4]。因此,改善IR已成为治疗T2DM 的主要策略。IR 是推动T2DM发生的重要机制,在生理条件下,胰岛素刺激葡萄糖进入肝脏,骨骼肌和脂肪组织维持葡萄糖稳态,IR 时胰岛素无法激活葡萄糖转运,促进脂质吸收,并抑制脂肪分解。
磷脂酰肌醇3 激酶/蛋白激酶B(PI3K/AKT)信号通路是胰岛素信号转导的主要途径,主要调节葡萄糖转运、β细胞存活、胰岛素基因转录等过程,该通路障碍都会导致IR[5]。胰岛素与胰岛素受体(InsR)结合时,胰岛素受体底物(IRS)酪氨酸磷酸化后被激活,随后激活PI3K/AKT 信号通路,参与胰岛素的代谢调节[6]。
钙敏感受体(CaSR)是不可或缺的膜蛋白,属于G 蛋白偶联受体C 家族。CaSR 可在脂肪组织中表达[7],CaSR 激动剂使AKT 活性显著增强,其抑制剂可抑制AKT 活性[8]。当CaSR 被激活时,可以使PI3K/Akt 信号通路激活,提示CaSR 与PI3K/Akt 信号通路密切相关[9]。
1 材料
1.1 实验动物
Wistar 雄性大鼠48 只,体质量(200±20)g[黑龙江中医药大学动物实验中心,合格证号编号:SCXK(鲁-2009-0007)]。分笼饲养,房间温度(22±2)℃,相对湿度(50±5)%,空气新鲜,通风良好,按时更换垫料,不限制摄食和饮水。
1.2 试药
胆固醇、果糖、蔗糖和谷氨酸钠(上海惠世生化试剂有限公司);丙硫氧嘧啶(美国Sigma 公司);Tween 80(天津市进丰化工有限公司);丙二醇(天津市化学试剂六厂);葡萄糖(天津基准化学试剂有限公司);75%乙醇(山东利尔康医疗科技股份有限公司);苦味酸(西陇化工股份有限公司);甲醛(天津永晟精细化工有限公司);二甲苯、无水乙醇、盐酸(北京化工厂);氨水(西陇科学股份有限公司);低熔石蜡、高熔石蜡(上海华永石蜡有限公司);ELISA 试剂盒(南京生物试剂公司);Trizol Reagen(Invitrogen 公司);AccuPower RocketScript RT PreMix、AccuPower GreenStar qPCR PreMix 试剂盒(Bioneer 公司);蛋白裂解液(碧云天生物有限公司);蛋白预染Marker(美国Thermo 公司);CaSR、β-actin 抗体(美国Abcam 公司);AKT、p-AKT(S473)、p-AKT(T308)抗体(美国CST 公司)。
1.3 仪器
梯度PCR 仪(Bio-RAD S1000)、Real-time PCR 仪(Bio-RAD CFX96)、电泳仪(Bio-RAD)、半干转膜仪(Bio-RAD)、Bio-RAD 凝胶成像系统(Universal Hood Ⅱ);微量台式低温离心机(Thermo 有限公司);紫外分光光度计(日本岛津有限公司)。
2 方法
2.1 分组与建模
脂肪乳的制备:猪油(20%)、胆固醇(5%)、蔗糖(5%)、果糖(5%)、丙硫氧嘧啶(1%)、谷氨酸钠(1%)、食用盐(6%)、Tween 80(20%)和丙二醇(30%)配成脂肪乳。
雄性Wistar 大鼠48 只,随机分为模型组和空白组,每组24 只,于第2、4、6、8 周分别处死6 只。模型组大鼠灌胃脂肪乳(10 mL·kg-1),1 次·d-1,空白组灌胃等量蒸馏水。
2.2 观测指标与标本采集
2.2.1 大鼠一般情况观察 观察大鼠行为表现,测量体质量。
2.2.2 空腹血糖(FBG) 各组大鼠末次灌胃脂肪乳后禁食,不禁水,12 h 后经尾静脉取血,用血糖仪测定大鼠FBG。
2.2.3 空腹胰岛素(FINS) 将动物麻醉后,腹主动脉取血4 mL, 静置30 min,4℃、3500 r·min-1离心15 min 后,取上清液1 mL,-20℃保存,按酶联免疫试剂盒说明书方法进行检测。根据FBG 和FINS 的值,计算胰岛素敏感指数(ISI):ISI =ln[1/(FBG×INS)]。
2.2.4 免疫组化检测脂肪组织CaSR 表达 将经多聚甲醛固定液浸泡的大鼠脂肪组织标本,切成2 mm×3 mm×4 mm 大小的组织块,用0.1 mmol·L-1PBS 漂洗后,使用不同浓度乙醇脱水,包埋,蜡块在室温下自然冷却凝固;修块后用石蜡切片机切片,与标本垂直方向连续切片,厚5 μm,间断集片,将组织切片粘贴于经过10%多聚赖氨酸处理过的载玻片上。贴片,60℃烘烤60 min,在切片组织上滴加按1∶1000 比例配制的CaSR 抗体,4℃过夜,检测。
2.2.5 实时荧光定量PCR(RT-q-PCR)检测脂肪组织CaSR mRNA 的表达量 取冰冻组织在研钵中用液氮研磨成为粉末状小颗粒,并将研磨好的组织转入l.5 mL 离心管中,全程冰上操作,按照Trizol 试剂盒提取脂肪组织中总RNA,按逆转录试剂盒合成cDNA,引物由哈尔滨赛拓生物有限公司设计合成,按照实时荧光定量PCR 试剂盒说明书在荧光定量PCR 仪上测定。
2.2.6 蛋白印迹法(Western blot)检测脂肪组织CaSR 蛋白表达水平及蛋白激酶(AKT)活性 取冻存的脂肪组织在研钵中用液氮研磨成粉末状小颗粒,加入蛋白裂解液提取蛋白;电泳分离;将蛋白转移到PVDF 膜上,封闭1 h,用TBST 清洗3 次,每次5 min,加入相应的一抗(1∶1000)4℃过夜;加入稀释好的二抗(1∶1000),室温轻摇1 h,TBST 洗膜3 次(5 min/次),采用化学发光显影观察结果。
2.3 统计方法
采用SPSS 17.0 软件进行数据处理和分析,所有实验数据均以平均数±标准差(±s)表示,P<0.05 为差异有统计学意义。
3 结果
3.1 一般情况
空白组大鼠皮毛有光泽,活动敏捷,摄食量及摄水量均无明显变化,体质量增加,差异无统计学意义;模型组大鼠皮毛无光泽,精神萎靡,灵敏性下降,行动缓慢、摄水量及尿量增加,第6 周和8 周时,与空白组比较,模型组大鼠体质量增加(P<0.05),见图1A。
3.2 各组大鼠FBG、FINS、ISI
由图1B、C 可见,模型组大鼠FBG 水平随着灌胃脂肪乳时间增加而增加,其中第4、6、8周时,与相应空白组比较,差异具有统计学意义(P<0.05,P<0.01);FINS 表达水平随着造模时间延长而增加,到第8 周时,与空白组比较,差异具有统计学意义(P<0.01);由图1D 可见,与空白组比较,模型组大鼠ISI 在第6周、第8 周时与空白组比较差异具有统计学意义(P<0.05,P<0.01)。
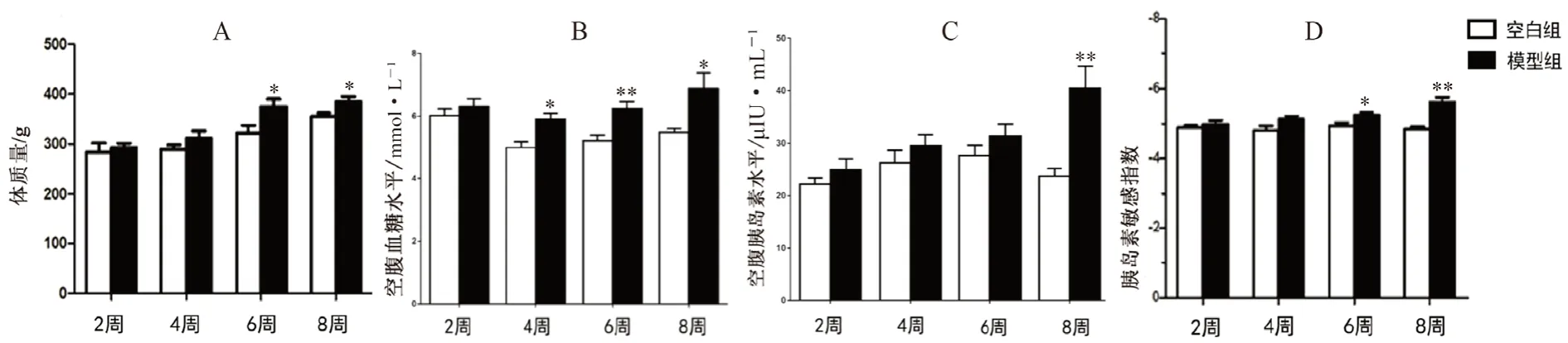
图1 大鼠体质量(A)、空腹血糖(B)、空腹胰岛素(C)、胰岛素敏感指数(D)的变化Fig 1 Change of body mass (A) and expression level of fasting blood glucose(B) ,fasting insulin(C) ,and insulin sensitivity index(D)in rats
3.3 脂肪组织中CaSR 免疫组化检测
第2 周时,空白组与模型组大鼠脂肪组织中均可见CaSR 表达(棕色),与空白组比较,模型组脂肪组织内CaSR 表达水平下降,见图2。
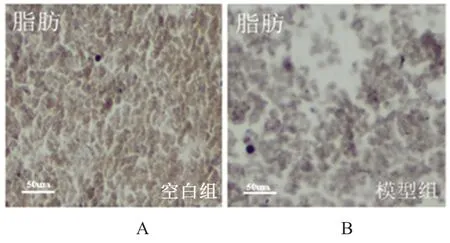
图2 第2 周时空白组(A)与模型组(B)大鼠脂肪组织中CaSR的表达水平Fig 2 Expression level of CaSR in adipose tissue of the control group(A)and the model group(B)at the second week
3.4 CaSR 在脂肪组织中mRNA 的表达
如图3所示,在脂肪组织中,与空白组比较,模型组CaSR mRNA 表达水平下调,且随着脂肪乳灌胃时间的增加而呈下降趋势,在第6 周、第8 周两组之间差异具有统计学意义(P<0.05)。
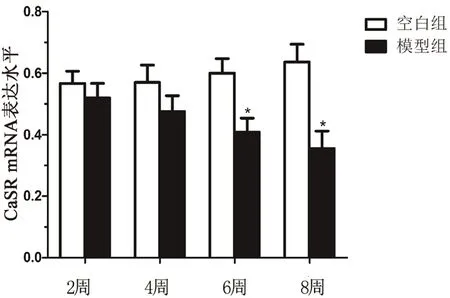
图3 脂肪组织CaSR mRNA 的表达Fig 3 Expression level of CaSR mRNA in adipose tissue
3.5 大鼠脂肪组织中CaSR 的蛋白表达水平
如图4A 所示,在脂肪组织中,各模型组CaSR 蛋白表达随着脂肪乳灌胃时间的增加而呈下降趋势,与第2 周时比较,第8 周时CaSR 蛋白表达显著降低(P<0.05)。
3.6 大鼠脂肪组织中AKT 活性
如图4B 所示,在脂肪组织中,各模型组AKT活性随着灌胃脂肪乳时间的增加而呈下降趋势,与第2 周时模型组比较,第8 周时的磷酸化AKT(T308)差异具有统计学意义(P<0.05);与第2 周时比较,第6 周、第8 周的模型组磷酸化AKT(S473)的差异具有统计学意义(P<0.05,P<0.01)。
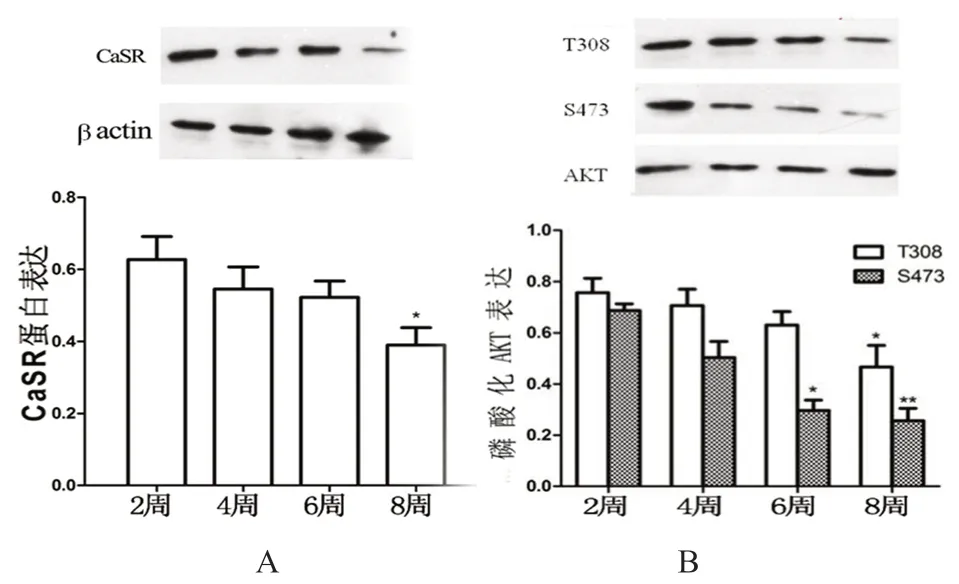
图4 模型组大鼠脂肪组织CaSR 蛋白的表达(A)及AKT 活性(B)Fig 4 Expression level of CaSR protein (A)and AKT activity (B)in adipose tissue of the model group
4 讨论
本研究为模拟高脂饮食对人类健康的影响,采用分周给予大鼠脂肪乳,与空白组比较,第8周时模型组大鼠体质量、FINS、FBG 和ISI 存在显著差异,提示第8 周时大鼠产生IR。
Li 等[10]研究表明,AKT 的活性被NPS2390(CaSR 抑制剂)抑制,而GdCl3(CaSR 激动剂)能增强AKT 活性,同时发现CaSR 的生理效应与PI3K/AKT 信号通路密切相关。研究表明,高脂饮食诱导的大鼠肝脏和肌肉中,可能通过抑制CaSR,降低PI3K/AKT 信号通路中AKT 活性,导致IR[11]。刘笑男等[12]研究表明,CaSR 可在脂肪细胞中表达,GdCl3可增加AKT 活性,当调节CaSR 分子表达水平时,可增强AKT 活性,改善IR。研究提示,IR 时CaSR 可能参与PI3K/AKT信号通路。
IR 是指身体目标器官或组织对胰岛素的敏感性丧失和胰岛素无法促进葡萄糖吸收,脂肪量增加通常会引起胰岛素抵抗,这是与肥胖有关的代谢性疾病(如代谢综合征和T2DM)的关键因素[13]。CaSR 在人脂肪细胞中激活,可使促炎细胞因子白介素6(IL-6),趋化因子C-C 基序配体2(CCL2),白介素1β(IL-1β)和肿瘤坏死因子α(TNF-α)的表达升高[14]。此外,CaSR 活化可刺激脂肪细胞的增殖和促炎性细胞因子表达,促使内脏脂肪生成增加[15-16]。在本研究中,采用免疫组化法检测IR 大鼠脂肪组织中CaSR 表达水平显著降低;采用RT-qPCR 检测到高脂饮食诱导IR大鼠的脂肪组织中CaSR mRNA 表达显著降低;Western blot 结果表明,给予脂肪乳2、4、6、8 周后CaSR 蛋白表达量显著降低;在高脂饮食诱导大鼠IR 过程中,CaSR 从基因到蛋白水平均呈现降低趋势,且与血糖及胰岛素水平呈负相关,推测CaSR 可能在IR 发生发展过程中发挥重要作用。
PI3K/AKT 信号通路在细胞生存过程中发挥重要作用,如葡萄糖稳态、脂质代谢、蛋白质合成、细胞增殖和生长等。AKT 主要表达在骨骼肌,脂肪和肝脏等胰岛素敏感组织中[17-18]。AKT通过两个关键的磷酸化过程激活,磷酸肌醇依赖性蛋白激酶1(PDK1)将激酶结构域中的苏氨酸308(T308)磷酸化,启动激活过程,随后通过mTOR 复合物2(mTORC2)在羧基末端调节域中的丝氨酸473(S473)进行磷酸化,完全激活AKT[19-21]。AKT 还参与细胞周期调节及葡萄糖转运中胰岛素的调节。在高脂饮食喂养第2、4、6 和8 周后,模型组中磷酸化AKT(T308和S473)显著降低,提示高脂饮食诱导的IR 中PI3K/AKT 信号通路受到抑制。
5 结论
本研究证明了CaSR 在大鼠脂肪组织中的表达,脂肪乳诱导的IR 大鼠中,CaSR 分子表达水平被抑制,可能导致PI3K/AKT 信号通路中AKT活性被抑制,提示CaSR 可能经由PI3K/AKT 信号通路,参与高脂饮食可诱导大鼠IR 发展过程。因此,CaSR 可作为IR 治疗新的靶点,为研究IR发生发展的潜在分子机制提供新的方向。
