大蒜体细胞胚发生过程中内源激素含量及相关基因表达的变化特征
2021-09-04李梦倩蒋芳玲
张 蒙,刘 敏,李梦倩,李 萍,周 蓉,蒋芳玲,吴 震
(南京农业大学 园艺学院,农业部华东地区园艺作物生物学与种质创制重点实验室,南京 210095)
大蒜(AlliumsativumL.)为药食兼用的一、二年生草本植物,是中国在国际市场上有较强竞争力的出口蔬菜之一,具有重要的经济和药用价值[1]。由于育性退化,大蒜主要靠鳞茎进行无性繁殖,导致病毒积累和种性退化严重,影响了其遗传改良和种质创新[2-3]。利用常规组织培养技术进行脱毒快繁,有助于恢复大蒜种性,但仍存在繁殖系数低、玻璃化严重、变异率高、生根困难、试管苗质量差和老化严重等问题[4]。
体细胞胚发生是植物界的普遍现象,是植物细胞全能性的重要体现,为植物离体快繁开创了新的途径[5-6]。体细胞胚发生途径具有发生速度快、繁殖系数高、遗传稳定性强和再生个体整齐性好等优点[7-8]。虽然大蒜体细胞胚发生早有报道,但主要集中在培养条件的优化、形态解剖特征观察及生理生化分析等方面[9-11]。激素是影响大蒜体细胞胚发生的重要调控物质,但体细胞胚发生不同阶段不同种类激素的变化特征还缺少系统研究,相关分子调控特点尚未见报道,阻碍了大蒜体细胞胚发生体系的完善,影响了该体系优势的发挥和规模化生产。因此,明确大蒜体细胞胚发生过程中的内源激素变化及相关基因表达特征,不仅有助于进一步明确大蒜体细胞胚发生的机理,更为大蒜种质资源创新、基因遗传转化和人工种子的制备奠定基础,还可为解决大蒜种性退化和新品种选育开辟途径。
植物体细胞胚发生受多种因素影响,是植物体内外不同因素综合作用的结果,其中植物生长调节剂(PGRs)起决定性作用[12-13]。研究表明,外源PGRs在植物体细胞胚发生过程中的不同阶段均有十分重要的调控作用[14-15],且外源PGRs必须通过内源激素才能发挥作用[16],而内源生长素、细胞分裂素(CTK)和脱落酸(ABA)水平的时空变化是调控体细胞胚发生的重要信号之一[17]。目前,关于玉米[18]、茶树[19]、栎树[20]、橡胶[21]等经济植物和姜黄[22]、半夏[23]、北五味子[24]、枇杷[25]等药用植物体细胞胚发生过程中内源激素的研究已有报道。相关研究结果因物种而异,高水平的内源IAA能够促进荔枝和龙眼胚性愈伤组织和球形胚的形成,但过高的内源IAA会抑制北五味子体细胞胚的形成[26-27]。也有研究表明,低水平的内源ABA有助于姜黄胚性愈伤组织的形成,而石刁柏中内源ABA水平在胚性愈伤组织阶段达到最高值[28]。关于内源激素对大蒜体细胞胚发生调控的研究尚无报道,目前多是参考前人和其他植物的研究结果来利用外源PGRs调控大蒜体细胞胚的发生。
体细胞胚发生是由激素代谢和信号转导介导的高度复杂的分子系统,特别是生长素、CTK和ABA及其激素依赖性基因的表达。为了揭示植物体细胞胚发生的机理,人们开始研究体细胞胚发生过程中关键基因和激素信号通路相关基因的作用。关于植物体细胞胚发生分子调控的研究主要集中在拟南芥[29]和烟草[30]等模式植物中,部分报道涉及大豆[31]、落叶松[32]、棉花[33]、百合[34]、龙眼[35]等,关于大蒜体细胞胚发生过程中的分子调控特点还未见报道。
本研究以大蒜品种‘二水早’为材料,选择体细胞胚发生过程中的外植体(花序轴,EX)、愈伤组织(CA)、早期胚性愈伤组织(PC)、后期胚性愈伤组织(LC)与球形胚(GE)5个阶段,分析不同阶段培养物的5种生长素及其类似物、4种CTK和ABA含量,以及不同阶段激素合成和信号转导相关基因相对表达量的变化特征,以期从内源激素变化的角度解析大蒜体细胞胚的发生机制,为建立大蒜体细胞胚高效发生体系提供理论基础。
1 材料和方法
1.1 植物材料
供试植物材料为大蒜品种‘二水早’,以花序轴为外植体。将花序轴接种在B5+ 3.0 mg·L-12,4-D + 0.5 mg·L-1KT + 0.7%琼脂 + 3%蔗糖,pH 5.8的培养基中,在(25±1) ℃下暗培养。根据前人研究结果[9-11],对大蒜体细胞胚发生过程中的形态变化进行观察,确定大蒜体细胞胚发生不同阶段研究材料,分别选取大蒜体细胞胚发生的外植体(花序轴)、愈伤组织、早期胚性愈伤组织、后期胚性愈伤组织和球形胚5个阶段的材料,经液氮固定后于-80 ℃保存,用于后续内源激素和相关基因表达量的检测。
1.2 内源激素及类似物含量的测定
采用高效液相色谱(Shim-pack UFLC SHIMADZU CBM30A,日本)和串联质谱(Applied Biosystems 6500 Quadrupole Trap,美国)法进行3类激素及类似物含量的测定,包括5种生长素及其类似物吲哚-3-乙酸(IAA)、吲哚-3-乙酸甲酯(ME-IAA)、吲哚-3-丁酸(IBA)、吲哚-3-甲醛(ICAld)和吲哚-3-甲酸(ICA),4种细胞分裂素异戊烯腺嘌呤(IP)、顺式玉米素(cZ)、反式玉米素(tZ)和二氢玉米素(DZ)以及脱落酸(ABA)。
1.2.1 样品提取取上述待测材料研磨至粉状,称取50 mg研磨后的样品,加入适量内标,用甲醇∶水∶甲酸=15∶4∶1(V∶V∶V)进行提取,提取液浓缩后用100 μL 80%甲醇-水溶液复溶,过0.22 μm PTFE滤膜,置于进样瓶中,用于后续分析[36]。
1.2.2 色谱质谱的采集条件色谱条件主要包括:(1)色谱柱:Waters公司的ACQUITY UPLC HSS T3 C18柱(1.8 μm, 2.1 mm* 100 mm)。(2)流动相:水相为超纯水(加入0.05%甲酸),有机相为乙腈(加入0.05%甲酸)。(3)洗脱梯度:0~1 min水/乙腈(95∶5,V/V),8~9 min水/乙腈(5∶95,V/V),9.1~12 min水/乙腈(95∶5,V/V)。(4)流速0.35 mL·min-1,柱温为40 ℃,进样量2 μL[37]。质谱条件主要包括:(1)离子源操作参数:电喷雾离子源(ESI)温度为500 ℃,质谱电压为4 500 V,帘气(CUR)设置为35 psi,碰撞诱导电离(CAD)参数设置为中等(medium)。(2)特征离子对的获得:在串联质谱仪中,根据优化的去簇电压(DP)和碰撞能(CE)进行扫描检测得到[38-39]。
1.2.3 激素的定性与定量利用植物激素标准品构建植物激素数据库,并基于植物激素数据库对质谱检测的数据进行定性分析,利用多反应检测模式(MRM)进行激素定量分析。获得不同样本的质谱分析数据后,对所有目标物的色谱峰进行积分,通过内标法获得目标激素的相对含量。
1.3 激素相关基因表达分析
使用Trizol试剂(Invitrogen,美国)提取总RNA后,取质量良好的1 μg RNA样品用于第一链的cDNA的合成。反转录使用5× All-In-One RT MasterMix 试剂盒(abm,中国镇江),混匀后在PCR 仪(Mastercycler®ep realplex,德国)上进行反转录的PCR反应,反应条件为:25 ℃ 10 min,42 ℃ 15 min,85 ℃ 5 min,得到的反转录产物cDNA置于-20 ℃保存备用。利用qRT-PCR检测大蒜体细胞胚发生过程中生长素、CTK和ABA合成和信号转导相关基因的表达量,引物序列见表1。
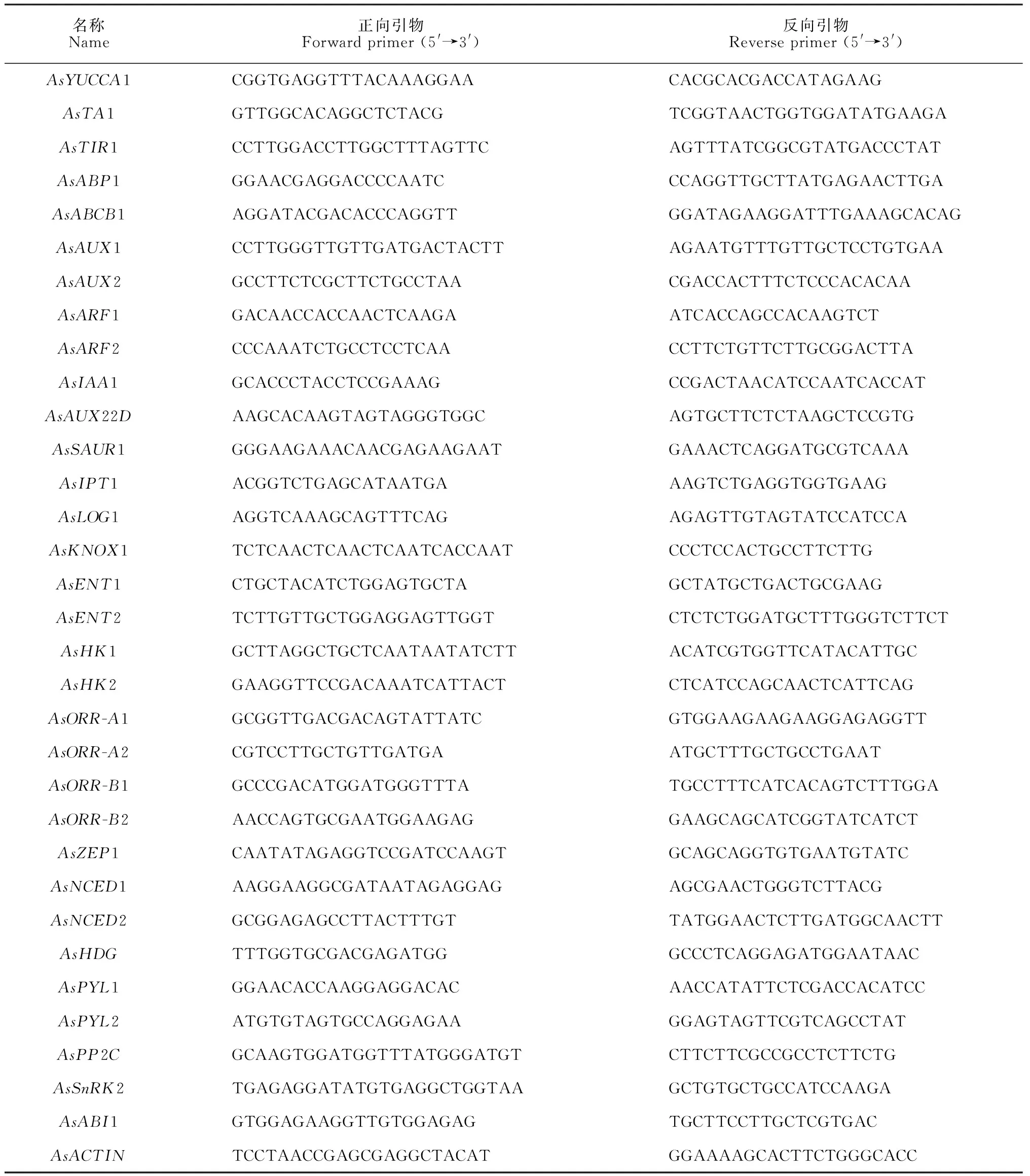
表1 大蒜激素相关基因的引物序列
按照TOROIVD qRT Master Mix试剂盒操作说明,在QuantStudio 3型实时荧光定量PCR系统(Applied Biosystems,美国)上进行扩增反应。总反应体系为10 μL:5 μL SYBR®Green qPCR Master Mix,0.4 μL上游引物,0.4 μL下游引物,cDNA 1 μL,3.2 μL ddH2O。反应程序为:95 ℃预变性60 s,95 ℃变性10 s,60 ℃退火30 s,进行40个循环。以AsACTIN为内参基因,运用2-ΔΔCt法计算各个基因的表达量,并计算其平均值和标准差。每个发育阶段取3个生物学重复,每个生物学重复进行3次技术性重复,以花序轴基因平均表达量为对照。
1.4 数据处理
试验数据采用Excel 2007和IBM SPSS Statistics 25.0软件进行统计与分析,用Duncan新复极差法检验不同发育阶段之间的差异显著性(P<0.05),使用 Graphpad prism 8.0软件绘图。
2 结果与分析
2.1 大蒜体细胞胚发生不同阶段内源激素及类似物含量的动态变化
2.1.1 内源生长素及其类似物含量动态变化大蒜体细胞胚发生的5个阶段均未检测到吲哚-3-甲酸(ICA),其余4种内源生长素及其类似物含量和总含量的动态变化见图1。随着大蒜体细胞胚的发生进程,内源生长素的总含量呈现先升高后降低的趋势,并在PC阶段达到最高值,在LC阶段次之,且两者显著高于EX阶段;总含量在GE阶段降至最低值,且GE和CA阶段均与EX阶段无显著差异(图1,A)。4种不同内源生长素及其类似物含量在各阶段的变化趋势与生长素总含量基本一致,但含量值存在差异。其中,内源吲哚-3-乙酸(IAA)含量在PC阶段达到最高值(21.73 ng·g-1),在LC阶段次之,且两者显著高于其余阶段;其余阶段间无显著差异,并在GE阶段降至最低值(1.54 ng·g-1)(图1,B);而内源吲哚-3-乙酸甲酯(ME-IAA)含量也在PC阶段最高(23.97 ng·g-1),分别约为EX、CA、LC和GE阶段的15、11、13和19倍,但这4个阶段之间差异不显著(图1,C);与EX阶段相比,吲哚-3-甲醛(ICAld)含量在CA和PC阶段显著升高,在PC阶段达到最大值(6.33 ng·g-1),随后显著下降,并稍低于EX阶段(图1,D);吲哚-3-丁酸(IBA)在EX和GE阶段中均未检测到,其含量在PC阶段达到最大值(0.91 ng·g-1),在LC阶段显著下降(图1,E)。可见,在大蒜体细胞胚发生过程中,4种内源生长素及其类似物均在早期胚性愈伤组织阶段达到最高值,在愈伤组织和早期胚性愈伤组织阶段有大量的内源ICAld和IBA的积累,而在球形胚阶段4种内源生长素及其类似物含量均降至最低值。由此推测,大蒜早期胚性愈伤组织的形成需要较多的内源生长素,且内源IAA和ME-IAA可能起主要作用;较高的内源ICAld和IBA有助于大蒜愈伤组织和早期胚性愈伤组织的形成,但过高水平的内源生长素不利于大蒜球形胚的形成。

EX.外植体(花序轴);CA.愈伤组织;PC.早期胚性愈伤组织;LC.后期胚性愈伤组织;GE.球形胚;不同小写字母表示发育时期间在0.05水平差异显著(P<0.05),下同图1 大蒜体细胞胚发生过程中内源生长素及其类似物含量的变化EX. Explant (inflorescence axis); CA. Callus; PC. Primary embryogenic callus; LC. Late embryonic callus; GE. Globular embryo; Different lowercase letters indicate significant difference among development stages at 0.05 level (P<0.05), the same as belowFig.1 Changes in the contents of auxin and its analogs during garlic somatic embryogenesis
2.1.2 内源细胞分裂素含量的动态变化在大蒜体细胞胚发生的5个阶段均未检测到的二氢玉米素(DZ),其余3种CTK含量和总含量在大蒜体细胞发生过程中的变化见图2。其中,在大蒜体细胞胚发生的5个阶段,总CTK和内源反式玉米素(tZ)、异戊烯腺嘌呤(IP)的含量均在EX阶段最高,并与其余阶段差异显著,然后从CA阶段降低至GE阶段,且4个阶段间均无显著差异;而顺式玉米素(cZ)在CA和PC阶段含量较高,在EX和LC阶段较低,在GE阶段降至最低。由此推测,反式玉米素和异戊烯腺嘌呤含量的降低可能有利于大蒜愈伤组织的形成,而较高水平的顺式玉米素则有利于大蒜愈伤组织和早期胚性愈伤组织的形成;总CTK含量的降低,可能是大蒜体细胞胚发生所必需的。

图2 大蒜体细胞胚发生过程中内源细胞分裂素含量的变化Fig.2 Changes in endogenous cytokinin content during garlic somatic embryogenesis
2.1.3 内源脱落酸含量动态变化图3,A显示,在大蒜体细胞胚发生的5个阶段,其内源ABA含量在EX阶段最高,达到了51.3 ng·g-1,是其他阶段的4~138倍;随着大蒜体细胞胚的形成,ABA含量在CA阶段显著降低,并持续到GE阶段,但这4个阶段之间无显著差异。由此推测,低水平的ABA可能有利于大蒜体细胞胚的发生。
2.1.4 3类内源激素含量动态变化比较及其比值分析大蒜体细胞胚发生过程中,比较3类内源激素含量发现,内源生长素及其类似物的含量普遍比3种CTK的含量高(图1-3,A)。在4种内源生长素及其类似物中,内源IAA和ME-IAA含量比内源ICAld和IBA含量高,内源IAA和ME-IAA最高值分别约为ICAld和IBA最高值的3~4和21~24倍;在同一时期生长素及其类似物含量的比较中发现,在EX、LC和GE阶段以IAA含量最高,在CA阶段以ICAld含量最高,在PC阶段以ME-IAA含量最高,IAA含量次之。在3种CTK中,tZ含量最高,约为cZ和IP含量的3~5倍;在同一时期3种CTK含量的比较中发现,tZ含量在EX、CA、LC和GE阶段最高,cZ含量在PC阶段最高。内源ABA含量在EX阶段高达51.3 ng·g-1,仅低于PC阶段的总生长素含量。
另外,比较3类内源激素含量变化趋势发现,内源生长素及其类似物的含量变化趋势与3种CTK和ABA含量的变化趋势不同,而tZ、IP和ABA含量的变化趋势基本一致。为了进一步探讨3类激素总含量的变化趋势与大蒜体细胞胚发生之间的关系,我们进行了各个阶段内源激素总含量的比值分析。结果发现,在大蒜体细胞胚发生过程中,ABA/AUXIN比值随着大蒜体细胞胚的形成显著降低,在PC和GE阶段比值较低;ABA/CTK比值在CA阶段显著下降,在PC阶段迅速回升,随后在GE阶段又显著下降;ABA/(AUXIN+CTK)比值在EX阶段最高,LC阶段次之,在GE阶段降至最低值(图3,B-D)。由此推测,较低的ABA/CTK和ABA/(AUXIN+CTK)比值有助于大蒜愈伤组织和球形胚的形成,较低的ABA/AUXIN和较高的ABA/CTK比值有助于大蒜早期胚性愈伤组织的形成,而较高ABA/(AUXIN+CTK)有助于大蒜后期胚性愈伤组织的形成,这3种激素之间含量的动态变化调控了大蒜体细胞胚的发生。

图3 大蒜体细胞胚发生过程中内源ABA含量和各激素之间比值的变化趋势Fig.3 Changes in endogenous ABA content and mass ratios of various hormones during garlic somatic embryogenesis
2.2 大蒜体细胞胚发生不同阶段内源激素相关基因表达的动态变化
2.2.1 生长素合成和信号转导相关基因的表达分析在大蒜体细胞胚发生过程中,IAA合成相关基因AsYUCCA1和AsTA1的表达量在PC阶段达到峰值,与内源IAA含量变化趋势基本一致(图4,A、B);生长素应答基因AsTIR1表达量在GE阶段达到最高值,生长素结合蛋白基因AsABP1表达量在CA阶段最高(图4,C、D);内源IAA运输相关基因AsABCB1、AsAUX1和AsAUX2表达量呈现出不同的趋势,生长素外运载体基因AsABCB1在PC阶段达到最高值,显著高于其他阶段,而生长素内运载体基因AsAUX1在LC阶段达到最高值,AsAUX2在GE阶段达到高值(图4,E-G);生长素信号转导相关基因AsARF1和AsARF2随着大蒜体细胞胚的发生逐渐升高,在PC阶段达到最高值,随后又显著降低(图4,H、I);AsIAA1基因表达量在大蒜体细胞胚发生的过程中呈先升高后降低的变化趋势,在LC阶段达到最高值(图4,J);AsAUX22D和AsSAUR1基因表达量在LC阶段升至最高值,且均在GE阶段维持高表达(图4,K、L)。

图4 大蒜体细胞胚发生过程中生长素合成和信号转导相关基因的相对表达量变化Fig.4 Changes in the relative expression of genes related to auxin synthesis and signal transduction during garlic somatic embryogenesis
2.2.2 细胞分裂素合成和信号转导相关基因的表达分析IP合成相关基因AsIPT1表达量在大蒜体细胞胚发生后4个阶段显著低于EX阶段,且这4个阶段之间无显著性差异,这与IP含量在大蒜体细胞胚发生过程中的变化趋势一致(图5,A)。基因AsKNOX1表达量在后4个阶段显著低于EX阶段,在PC和CA阶段表达量较高,随后显著降低(图5,B)。cZ合成相关基因AsLOG1的表达量在CA阶段最高,在PC阶段显著降低(图5,C)。细胞分裂素运输相关基因AsENT1和AsENT2在大蒜体细胞胚发生过程中变化趋势不同,AsENT1在体细胞胚发生各阶段的表达量无显著差异,而AsENT2随着体细胞胚的形成而先升高后降低,在PC阶段达到最高值(图5,D、E)。细胞分裂素受体基因AsHK1表达量在PC、LC和GE阶段显著高于EX和CA阶段;AsHK2在后4个阶段维持高水平表达,在LC阶段达到最高值,显著高于GE阶段(图5,F、G)。随着大蒜体细胞胚的发生,CTK信号转导相关基因AsORR-A1和AsORR-A2表达量均呈现先升高后降低的变化趋势,在PC阶段达到峰值,随后显著降低;AsORR-B1表达量从CA阶段显著升高,在PC阶段达到最高值,而AsORR-B2表达量在各阶段之间无显著差异(图5,H-K)。

图5 大蒜体细胞胚发生过程中细胞分裂素合成和信号转导相关基因的相对表达量变化Fig.5 Changes in relative expression levels of genes related to cytokine synthesis and signal transduction during garlic somatic embryogenesis
2.2.3 脱落酸合成和信号转导相关基因的表达分析随着大蒜体细胞胚的发生,ABA合成相关基因AsZEP1的表达量先升高后降低,在LC阶段达到最大值(图6,A)。ABA合成限速酶基因AsNCED1和AsNCED2在后4个阶段的表达量显著低于EX阶段,其中AsNCED1在LC阶段略有回升,而AsNCED2表达量从PC阶段降低至GE阶段(图6,B、C)。转录因子基因AsHDG表达量在PC阶段达到峰值,显著高于其他阶段(图6,D)。ABA受体基因AsPYL1表达量在GE阶段达到最高值,显著高于其他阶段,而AsPYL2的表达量也在GE阶段达到最大值,并显著高于EX和CA阶段(图6,E、F)。PYL下游基因AsPP2C表达量随着大蒜体细胞胚的发生呈先升高后降低的变化趋势,在PC阶段达到最高值,在GE阶段降到最低值(图6,G)。ABA信号转导相关基因AsSnRK2表达量在大蒜体细胞胚发生的各个阶段无显著差异(图6,H)。ABFs转录因子家族中的AsABI1基因表达量在LC阶段达到最高值,显著高于其他阶段(图6,I)。

图6 大蒜体细胞胚发生过程中脱落酸合成和信号转导相关基因的相对表达量变化Fig.6 Changes in the relative expression of genes related to abscisic acid synthesis and signal transduction during garlic somatic embryogenesis
3 讨 论
3.1 大蒜体细胞胚发生不同发育阶段主要内源激素含量的变化规律
植物体细胞胚发生过程中的内源激素含量因物种和检测方法不同而异。高效液相色谱法(HPLC)检测枇杷[25]胚性愈伤组织中的内源IAA含量可高达1 000 ng·g-1,用同样的方法检测茶树[19]体细胞胚发生过程中的内源IAA含量最高只有27 ng·g-1,而用LC-MS/MS方法检测胡椒中内源IAA含量更低,最高只有6.21 ng·g-1[40]。本试验使用LC-MS/MS检测发现大蒜体细胞胚内源IAA含量最高为21.73 ng·g-1。
不同植物的体细胞胚发生过程中内源生长素含量的变化趋势不同。在玉米[15]和姜黄[19]的体细胞胚发生过程中,内源IAA先上升后下降,在胚性愈伤组织时达到峰值,而北五味子[21]则在球形胚时期达到峰值。本研究中,大蒜体细胞胚形成过程中内源IAA含量先逐渐升高,在PC阶段达到最高值,随后降低,与玉米和姜黄体细胞胚中内源IAA含量的变化趋势基本一致。除内源IAA外,本研究还发现内源IBA、ME-IAA和ICAld含量均在大蒜体细胞胚形成的PC阶段达到最高值,在GE阶段降至最低值。
在红豆和碧桃中,非胚性愈伤组织的内源细胞分裂素tZ和cZ含量高于胚性愈伤组织[41-42]。本研究发现,tZ含量在EX阶段最高,随后显著降低,而内源cZ含量呈现先升后降的变化趋势,在CA和PC阶段较高,这与前人研究结果有所不同。吉训志等[40]发现IP含量在胚性愈伤组织与体细胞胚混合阶段显著高于其他阶段,但含量较低。而在本研究中,IP含量在EX阶段显著高于其他阶段,但总体含量也较低,这与前人研究结果有所不同,这可能是由于不同物种体细胞胚发生过程中起主要作用CTK类型不同导致的。
高含量内源ABA对棉花和苹果胚性愈伤组织的形成有促进作用[43-44],而龙眼和荔枝在胚性愈伤组织和球形胚形成的过程中,都伴随着内源ABA的增加,且在球形胚阶段达到最高值[23-24]。本研究则发现EX阶段内源ABA含量很高,但随着大蒜愈伤组织的形成,内源ABA含量显著降低,并在球形胚阶段降至最低值,这与前人研究结果不一致。有研究表明,在人参和红豆体细胞胚胎发育后期内源ABA显著升高,但在早期胚阶段达到最低值[41,45]。由此推测,因为本研究中的大蒜球形胚处于胚性早期,所以内源ABA含量无明显上升。
3.2 内源激素在大蒜体细胞胚发生中的调控作用
前人普遍认为生长素在植物体细胞胚发生过程中起着关键作用,外源生长素的添加是诱导体细胞胚不可或缺的一步,而内源IAA含量的上升可能是胚性细胞形成的一个重要标志[46-48]。本研究发现,生长素及其类似物含量均在PC阶段升至最高,在GE阶段降至最低,由此推测内源IAA、IBA、ME-IAA和ICAld含量的升高可能促进大蒜早期胚性愈伤组织的形成,但过高的内源生长素及其类似物可能会抑制大蒜球形胚的形成。有研究表明,CTK虽不是启动胚性必需的,但是在某些植物中这类物质对其胚状体的发生也起着关键的作用[49]。本研究发现,cZ含量在大蒜体细胞胚发生的CA和PC阶段有大量积累,而tZ和IP含量在愈伤组织形成时持续下降至球形胚阶段。由此推测,CTK不是大蒜胚性启动的必要物质,但是cZ含量的积累和tZ、IP含量的降低可能有助于促进大蒜愈伤组织的形成。有研究表明,高水平的内源ABA与胚性能力的启动有关,它可能通过参与碳水化合物的代谢调节植物体细胞胚胎的发育[50-51]。本研究发现,ABA在大蒜体细胞胚发生的GE阶段含量最低,并未出现ABA的积累,因此推测低水平的ABA有助于大蒜体细胞胚的发生,但对球形胚的发育作用,还有待深入研究。
3.3 激素相关基因参与体细胞胚发生调控的机理
有研究表明,内源性信号和基因的重编程启动了胚胎发生过程的信号链,从而共同调控了体细胞胚的发生[52]。本研究根据内源激素含量在大蒜体细胞胚发生各阶段的变化趋势,结合内源激素代谢和信号转导相关基因的表达,初步构建了大蒜体细胞胚发生过程中激素水平变化与相关基因表达之间的调控网络(图7)。
外源施加生长素类物质能够激活生长素合成相关基因YUC2和YUC4的表达,改变内源IAA含量,促进了体细胞胚的发生[53-54]。本研究中发现,AsYUCCA1和AsTA1基因相对表达量的变化与内源IAA含量的变化趋势基本一致,这说明AsYUCCA1和AsTA1正调节IAA的合成,这与前人研究结果一致。有研究表明,生长素抑制因子Aux/IAA抑制ARFs的表达,而ARFs激活或抑制下游基因的表达[55-56]。由此推测,低水平的内源IAA会减少AsIAA1和AsAUX22D的泛素化降解,抑制AsARF1、AsARF2的表达来调节AsSAUR1的表达,进而促进大蒜球形胚的形成(图7)。
本研究发现大蒜体细胞胚发生过程中AsIPT1和AsKNOX1表达量低于EX阶段,IP含量的降低可能是因为AsIPT1和AsKNOX1表达量降低导致的。除此之外,AsLOG1的表达也影响cZ含量的变化,而cZ可能通过激活AsENT2的表达来加速cZ的运输,进而促进大蒜愈伤组织和早期胚性愈伤组织的形成。植物体内CTK信号转导是一个“磷酸传递”的过程,结合本研究结果推测,cZ可能通过激活AsHK2来诱导B型AsORRs的表达,进而调节下游A型AsORRs和其他CTK反应,促进大蒜体细胞胚的形成(图7)。本研究还发现A型AsORR-A1和AsORR-A2表达量在LC和GE阶段显著下降,而B型AsORR-B1和AsORR-B2在LC和GE阶段仍维持高水平表达,可能是因为A型AsORRs对B型AsORRs存在负反馈调节导致的。
转录因子HDG可以直接或间接激活NCED3的表达,而NCED上调表达对ABA的合成具有积极的促进作用[57-58]。本研究中发现大蒜体细胞胚发生过程中AsNCED1和AsNCED2表达量低于EX阶段,这导致ABA含量显著降低,而AsHDG和AsNCED2表达量在PC阶段升高,这说明AsHDG可能参与调节AsNCED2的表达,与前人研究结果一致。本研究还发现AsPYL1基因表达量在GE阶段最高,与AsPP2C基因表达量变化趋势相反,所以推测AsHDG和AsNCED2影响内源ABA合成,而内源ABA影响了AsPYL1的表达;AsPYL1通过抑制AsPP2C基因的表达来促进AsABI1的表达,进而促进了大蒜球形胚的形成(图7)。另外,本研究发现AsSnRK2表达量在大蒜体细胞胚发生各个阶段无显著差异,可能存在其他调控途径,尚需要进一步进行研究。
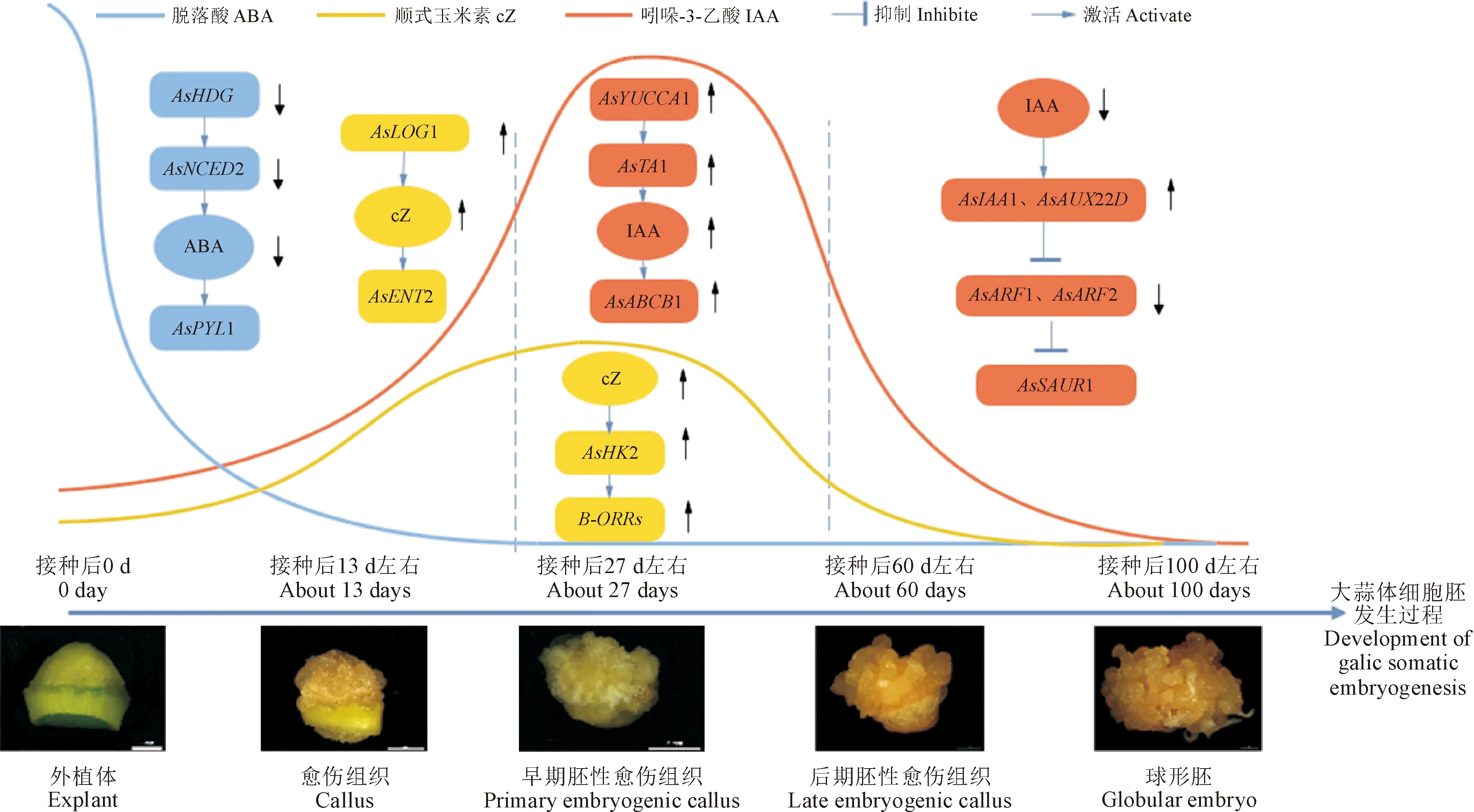
图中不同颜色的曲线表示不同内源激素含量的变化趋势;切角矩形框表示不同基因;椭圆框表示不同内源激素含量图7 大蒜体细胞胚发生过程中激素水平与相关基因变化的调控网络图The curves of different colors in the figure indicate the changing trend of the contents of different endogenous hormones;Tangential rectangular boxes indicate different genes; Oval boxes indicate different endogenous hormone contentsFig.7 Regulatory network diagram of hormone levels and related gene changes during garlic somatic embryogenesis development
4 结 论
大蒜体细胞胚的发生是个极其复杂的动态过程,内源生长素、CTK和ABA含量及相关基因表达的动态变化共同调控了大蒜体细胞胚的形成。在大蒜体细胞胚发生过程中,大蒜愈伤组织的形成可能需要ICAld、IBA和cZ的积累,高水平的生长素及其类似物和低水平的IP、tZ可能是大蒜早期胚性愈伤组织形成所必需的,而低水平的生长素及其类似物、CTK和ABA可能有利于大蒜球形胚的形成;激素合成相关基因调控内源激素含量的变化,内源激素含量的变化激活激素信号转导相关基因的表达,从而共同调控大蒜体细胞胚的发生。
