miR-130a靶向G3BP2促进乳腺癌侵袭
2021-09-04付长霞冯瑞军郑远航盛智梅孙雪梅邓梓坤张宝刚
付长霞 ,冯瑞军, 郑远航 ,盛智梅 ,孙雪梅 ,邓梓坤 , 张宝刚*
(山东省1潍坊市市直机关医院肿瘤科,潍坊261041;2潍坊医学院临床病理系,潍坊261042;3胜利油田中心医院,东营257034)
近年来,乳腺癌的发病率呈快速上升趋势,已经成为我国女性发病率和死亡率最高的恶性肿瘤[1]。因此,研究乳腺癌细胞的侵袭和转移相关的机制可以有针对性地抑制乳腺癌细胞的转移,对延长乳腺癌患者的生存期、提高患者生存质量具有重要意义[2]。目前,乳腺癌细胞的侵袭机制层出不穷,Wei等的研究证实GTP酶激活蛋白SH3功能区结合蛋白2(GTPase activating protein SH3 binding protein 2,G3BP2)作为上皮间质转化(epithelial-to-mesenchymal transition,EMT)相关转录因子TWST1的胞质锚定蛋白,能够通过结合TWST1抑制其入核发挥抑制EMT的作用,从而抑制乳腺癌的侵袭和转移。
微小RNAs(microRNAs,miRNAs)是真核生物体内大约包含22bp的非编码内源性RNAs,主要通过靶向结合癌基因或肿瘤抑制基因的3’端非翻译区(3’UTR),导致mRNA的降解或翻译抑制后下调基因表达来参与癌症的侵袭和转移[3]。为了明确G3BP2抑制乳腺癌产生EMT这一通路是否也受miRNAs调控,我们通过筛选找出靶向调节G3BP2的miR-130a,研究在不同细胞系中过表达或抑制miR-130a对G3BP2的影响,为乳腺癌的诊疗提供新的理论依据和方向。
材料与方法
1 材料
正常乳腺上皮细胞MCF-10A、乳腺癌细胞株MCF-7、MDA-MB-231、MDA-MB-435购 自 美 国ATCC 细胞库。细胞裂解液、胰蛋白酶、蛋白Marker、G3BP2质粒中量抽提试剂盒、反转录试剂盒Prime Script®以及SYBR®Prime Script®miRNA RT-PCR 试剂盒等均购自TaKara公司。miR-NC、miR-130a、miR-130a-inhibitor、miR-inhibitor-NC质粒由Invitrogen公司合成纯化。RPMI 1640培养基以及胎牛血清(FBS)购自美国 Hyclone公司。BCA 蛋白浓度测定试剂盒购自碧云天生物技术有限公司。ECL试剂购自Biosharp(白鲨生物科技公司)。抗G3BP2多克隆抗体购自(Sigma-Aldrich公司),小鼠抗 E-cadherin、vimentin、β-actin抗体购自北京中杉金桥生物技术有限公司,辣根过氧化物酶标记的羊抗兔或小鼠IgG二抗购自武汉三鹰生物技术有限公司。PVDF膜、Transwell 小室购自BD公司。Lipofectamine 2000脂质体购自Invitrogen公司。G3BP2 3’-UTR荧光素酶报告基因野生型载体pGL3-G3BP2 3’-UTR-WT及突变型载体pGL-G3BP2 3’-UTR-MUT由吉凯基因构建。荧光素酶活基因报告试剂盒(包括细胞裂解液、萤火虫荧光素酶底物反应液、海肾荧光素酶缓冲液、海肾荧光素酶底物)购自GenePharma(上海吉玛制药技术有限公司)。
2 细胞培养
MCF-10A、MCF-7、MDA-MB-231、MDAMB-435细胞培养于含10%胎牛血清、100 µg/mL青霉素和链霉素的RPMI1640培养基中。于 5% CO2,37℃ 细胞孵育箱中传代培养。待细胞生长处于对数期阶段时进行消化铺板,尽量铺匀,控制好细胞数量,6h后观察细胞生长密度,24h后进行瞬时转染。
3 荧光定量PCR
总RNA提取及逆转录具体步骤参照先前研究的实验操作[4]:用 TRIzol 试剂从细胞中提取总RNA,纯化后,通过反转录试剂盒获得 cDNA。cDNA逆转录产物应用设计好的引物在荧光定量PCR仪上进行扩增。反应体系总体积为20μl。反应条件设置如下:95℃ 3min,95℃30s,60℃ 30s,72℃ 1min,循环数为35。miR-130a正向引物序列:5’-ACACTCCAGCTGGGGCTCTTTTCACATTGT-3’,反 向 引物 序 列: 5’-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAGTAGCAC-3’;内参U6正向引物序列:CTCGCTTCGGCAGCAC,反向引物序列:ACGCTTCACGAATTTGC。 采 用 2-△△Ct法对荧光定量PCR检测的 miRNA进行相对定量。
4 miR-130a质粒构建与细胞转染
按照LipofectamineTM2000说明书,将质粒转染到乳腺癌细胞中,37℃、5% CO2培养6h后,改换成10% FBS培养基,37℃、5% CO2继续培养48h。细胞转染效率可以在荧光显微镜下观察,也可以通过qRT-PCR实验进一步验证转染效率。
5 蛋白印迹实验
蛋白印迹实验详见先前研究[4]:将转染成功后各组细胞孵育72h后,裂解提取总蛋白,BCA 法定量蛋白浓度, 12% SDS-PAGE电泳(每孔上样10mg蛋白)、转膜(PVDF膜),5% 脱脂奶粉封闭1 h,封闭结束后使用 TBST洗膜 5 min×3 次,随后将膜置于抗G3BP2(1:1000)、抗 E-cadherin 抗体(1:1000)、抗vimentin抗体(1:1000)和抗β-actin(1:1000)中4℃孵育过夜。次日,洗膜5 min×3 次后,置于辣根过氧化物酶标记的羊抗兔或鼠 IgG(1:2000)中室温孵育 2h。TBST 洗膜 5min×3次后在暗室内加ECL 试剂于PVDF 膜上,室温孵育1~2min后X光胶片压片、显影、定影,拍照后应用 Image Lab 进行定量分析。重复3次。β-actin蛋白作为内参,目的蛋白相对表达水平=目的蛋白光密度/内参蛋白光密度。
6 荧光素酶活性检测
运用Target-Scan 软件对miR-130a潜在的靶基因进行预测,筛选出G3BP2的3’端U T R区非保守位点的5’-GGAAUGUGAC-3’可能是miR-130a的靶向位点。将pGL3-G3BP2 3’-UTR-WT或pGL-G3BP2 3’-UTR-MUT分别与miR-130a过表达对照质粒或miR-130a质粒共转染MCF-7或MDA-MB-231细胞,5h后换液,在37℃、5% CO2的培养箱中培养48h后,收获细胞。使用双重荧光素酶报告基因检测试剂盒测量报告基因的活性,相对荧光素酶活性=萤火虫/海肾荧光值。
7 细胞Transwell实验
将Transwell小室提前铺好基质胶凝固,将各组细胞消化离心后制成细胞悬液,进行细胞计数(约4×105个/ml),取100μl加入小室上层。下室加入含20%胎牛血清的1640培养基550μl。培养36h,多聚甲醛固定、吉姆萨染色。在显微镜下随机选取6个高倍镜视野计数并拍照。实验重复3次取平均值。
8 统计学方法
所有实验数据运用 SPSS 16. 0分析。计量资料之间的比较采用独立样本t检验。多个独立样本之间的比较采用单因素方差分析。所有数据采用均数±标准差的形式表示。P<0.05被认为差异有统计学意义。
结 果
1 G3BP2在高侵袭性乳腺癌细胞系中低表达
应用Western blot对正常乳腺上皮细胞系MCF10A细胞、低级别低侵袭性的乳腺癌细胞系MCF-7细胞、高级别乳腺癌细胞系MDA-MB-231和MDAMB-435细胞中G3BP2水平检测表明:G3BP2在正常乳腺上皮细胞系MCF10A中高表达,而在乳腺癌细胞系中,在高侵袭性的细胞系MDA-MB-231和MDA-MB-435中表达较低,低侵袭性的细胞系MCF-7中表达较高(图1)。
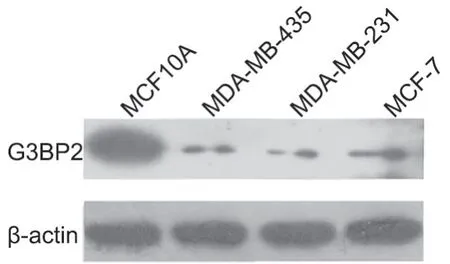
图1 乳腺癌细胞中 G3BP2水平的Western blot检测Fig.1 Western blot detection of G3BP2 in breast cancer cells
2 TargetScan预测G3BP2是miR-130a的靶基因
运用Target-Scan 软件(http://www.targetscan.org/)对miR-130a潜在的靶基因进行预测,筛选出G3BP2的3’端UTR区非保守位点的5’-GGAAUGUGAC-3’可能是miR-130a的靶向位点(图2)。

图2 miR-130a的靶基因预测。生物信息学数据库 TargetScan 预测G3BP2 是miR-130a 的靶基因Fig. 2 Prediction of target genes of miR-130a. Targetscan predicted that G3BP2 might be a target gene of miR-130a
3 miR-130a 在高侵袭性乳腺癌细胞中高表达
对4种细胞系中miR-130a表达水平的qRT-PCR检测显示,与正常乳腺上皮细胞MCF10A相比,乳腺癌细胞中miR-130a表达显著升高,且高侵袭能力乳腺癌细胞MDA-MB-231、MDA-MB-435均高于低侵袭能力的MCF-7乳腺癌细胞系。以上结果提示,miR-130a可能参与乳腺癌的侵袭(图3)。
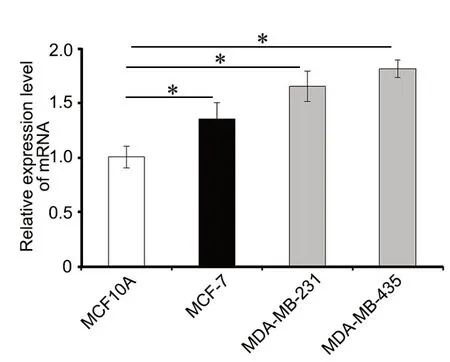
图3 qRT-PCR检测miR-130a在不同乳腺癌细胞中的表达。*P<0.01;n=3Fig. 3 qRT-PCR assay for the expression of miR-130a in different breast cancer cells. *P < 0.01; n=3
4 miR-130a抑制G3BP2表达
如上文所述,miR-130a在MCF-7中相对表达低,在MDA-MB-231中高表达,故在MCF-7细胞中转染miR-130a质粒,在MDA-MB-231细胞中转染miR-130a inhibitor 质粒来观察改变miR-130a 表达对乳腺癌细胞内靶蛋白 G3BP2 水平的影响。转染相应过表达miR-130a或抑制miR-130a表达质粒及其相应对照质粒72 h后,提取蛋白进行Western blot检测显示:miR-130a 过表达的MCF-7细胞G3BP2水平较转染miR-NC质粒的对照组MCF-7细胞显著降低(图4A),而转染miR-130a inhibitor质粒的MDA-MB-231细胞中G3BP2 水平显著高于转染miR-inhibitor-NC质粒的对照组MDA-MB-231细胞(图4B)。
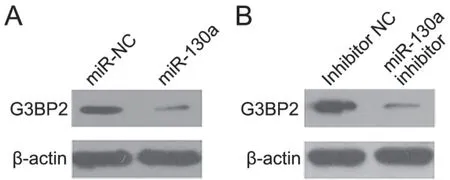
图4 改变miR-130a 对乳腺癌细胞内靶蛋白 G3BP2 水平影响的 Western blot 检测。A,过表达miR-130a对MCF-7细胞内G3BP2水平影响代表性Western blot检测;B,抑制miR-130a表达对 MDA-MB-231细胞G3BP2水平影响代表性Western blot检测Fig. 4 Western blot analysis for the effect of changing miR-130a expression on the expression of target protein G3BP2 in breast cancer cells. A, representative Western blot images of the effect of miR-130a overexpression on G3BP2 level in MCF-7 cells; B, representative Western blot images of the effect of miR-130a inhibition on G3BP2 level in the MDA-MB-231 cells
5 改变miR-130a水平不影响G3BP2 mRNA的表达
同上将MCF-7细胞中转染miR-NC或miR-130a质粒,MDA-MB-231细胞中转染miR-inhibitor-NC或miR-130a inhibitor,72 h后提取RNA进行G3BP2 mRNA表达水平的qRT-PCR检测,结果显示:miR-130a高表达后或抑制后,均不能引起G3BP2 mRNA水平改变(图5)。
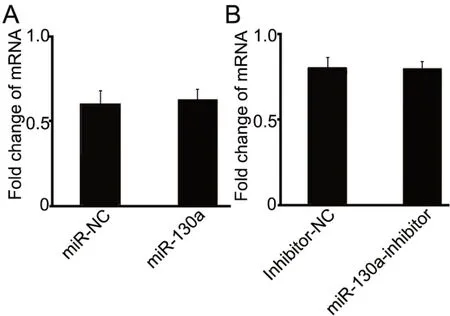
图5 qRT-PCR检测改变miR-130a表达对乳腺癌细胞内G3BP2 mRNA表达的影响。A,过表达miR-130a对MCF-7细胞内G3BP2 mRNA表达影响的统计学分析;B,抑制miR-130a表达对 MDAMB-231细胞G3BP2 mRNA水平影响的统计学分析Fig. 5 qRT-PCR analysis for the effect of changing miR-130a expression on the G3BP2 mRNA expression in breast cancer cells. A, statistical analysis for the effect of miR-130a overexpression on G3BP2 mRNA expression in MCF-7 cells; B, statistical analysis for the effect of miR-130a inhibition on G3BP2 mRNA expression in MDA-MB-231 cells
6 miR-130a靶向结合G3BP2的3’UTR区
应用双荧光素酶报告基因实验对miR-130a靶向结合G3BP2的分析显示:转染miR-130a质粒的MCF-7细胞的荧光素酶活性显著降低(图6A),抑制MDA-MB-231中miR-130a表达后,其荧光素酶活性显著增强(图6B);而转染二者的突变质粒时,上述作用均消失。由此表明,miR-130a靶向结合G3BP2的3’UTR区,在翻译水平抑制G3BP2表达(图6)。
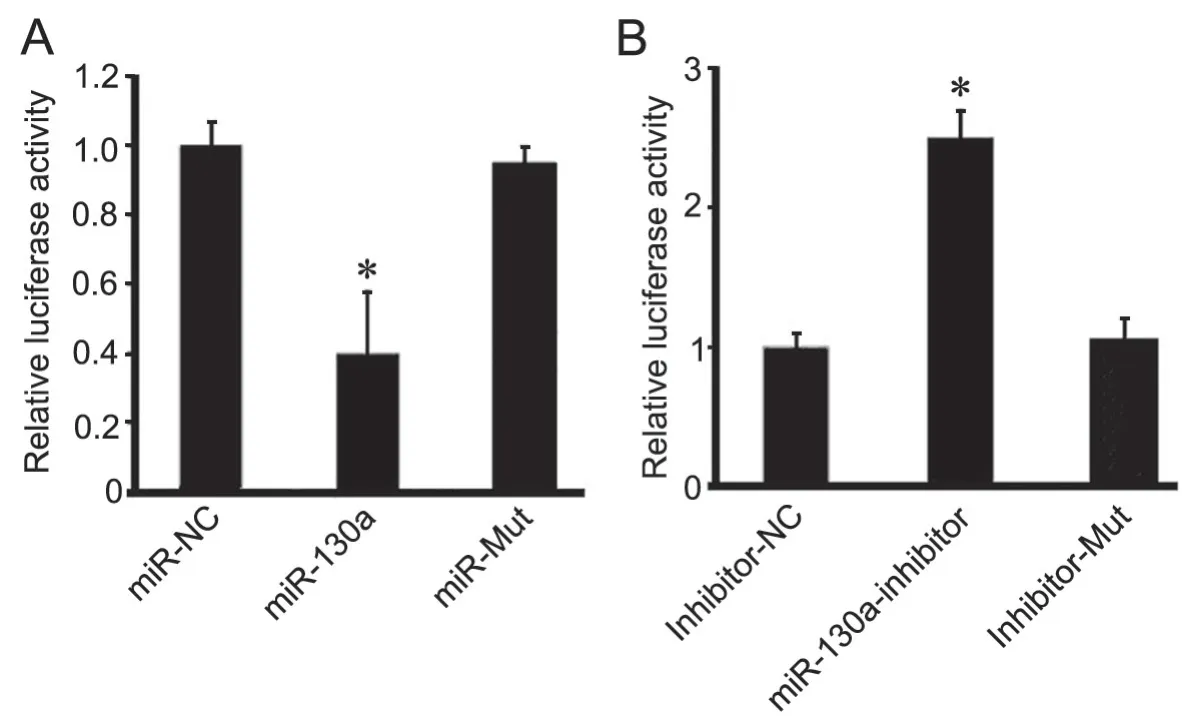
图6 双荧光素酶报告基因检测验证乳腺癌细胞内miR-130a靶向G3BP2。A,miR-130a过表达质粒和相应突变质粒转染对MCF-7细胞内pGL3-G3BP2-3’UTR荧光素酶活性影响的统计学分析; B,miR-130a抑制质粒和相应突变质粒转染对MDA-MB-231细胞内荧光素酶活性影响的统计学分析;与 mimics-NC 比较,*P <0.01;与 inhibitor-NC 比较,*P <0.01;n=3Fig. 6 Verification of the targeting relationship of miR-130a to G3BP2 in breast cancer cells by dual-luciferase reporter gene assay. A, statistical analysis for the effect of miR-130a overexpression plasmid and its corresponding mutant plasmid on the luciferase activity of pGL3-G3BP2-3’UTR in MCF-7 cells; B, statistical analysis for the effect miR-130a inhibition plasmid and its corresponding mutant plasmid on the luciferase activity of pGL3-G3BP2-3’UTR in the MDA-MB-231 cells; *P<0.01, compared with mimics-NC; *P<0.01, compared with inhibitor-NC; n=3
7 MiR-130a促进乳腺癌细胞侵袭
Transwell侵袭实验显示(图7),增加miR-130a的表达后,MCF-7细胞穿过基底膜小孔的数量显著增多,抑制miR-130a表达后,MDA-MB-231细胞穿过基底膜小孔的数量显著减少,表明miR-130a能促进乳腺癌细胞的侵袭能力。
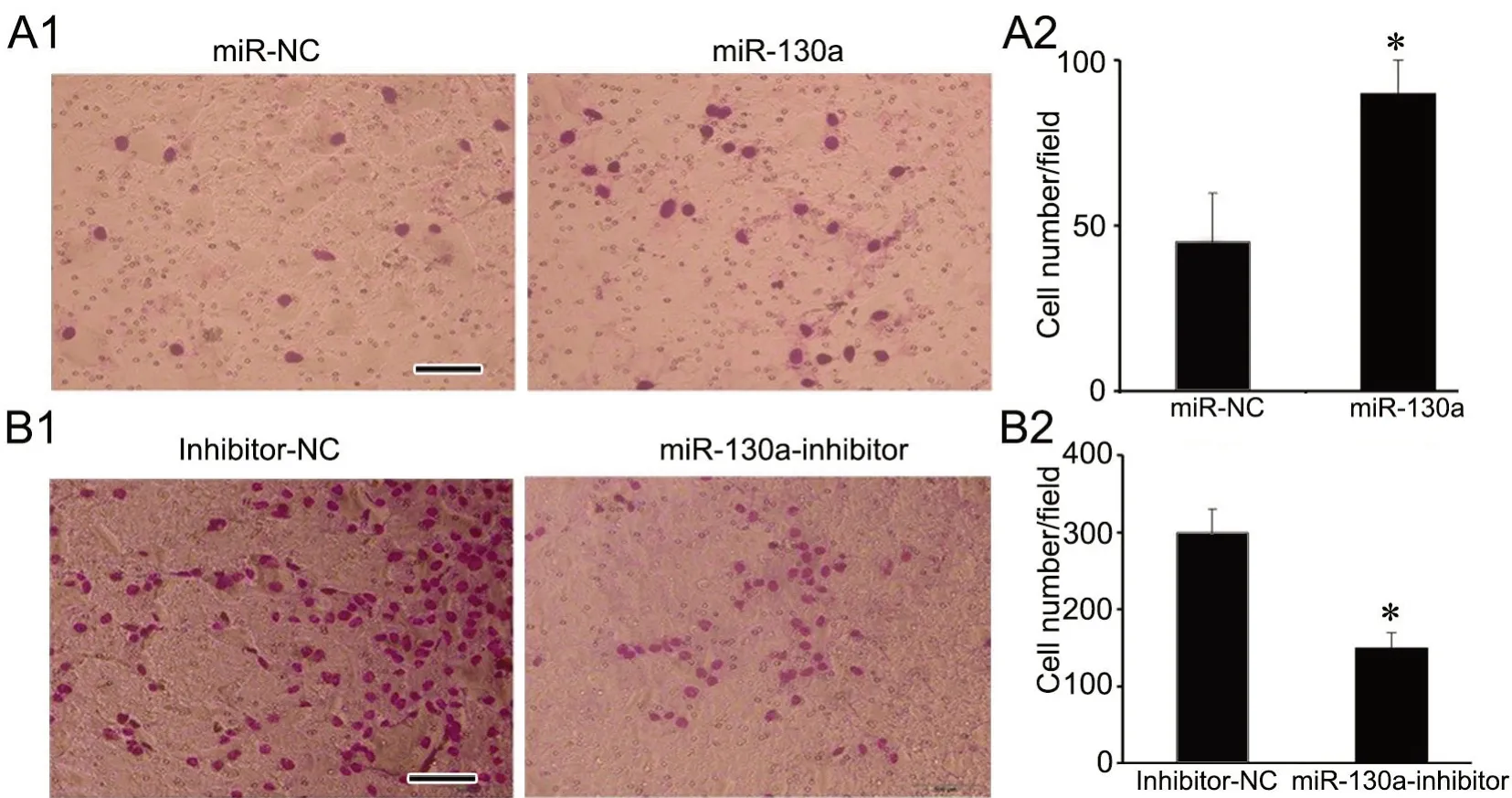
图7 改变miR-130a表达对乳腺癌细胞侵袭能力影响的Transwell检测。A,过表达miR-130a促进MCF-7细胞侵袭;A1代表性Transwell实验结果;A2,侵袭力统计学分析;*P<0.01;n=3。B,抑制miR-130a表达减少MDA-MB-231细胞侵袭;B1代表性Transwell实验结果;B2,侵袭力统计学分析;与miR-NC组比较,*P<0.01;n=3。Fig. 7 Transwell assay for the effect of miR-130a on the invasion ability of different breast cancer cells. A, miR-130a overexpression promotes the invasion of MCF-7 cells; A1, representative Transwell assay results; A2, statistical analysis for the invasion ability; *P<0.01; n=3. B, miR-130a inhibition decreases the invasion of MDA-MB-231 cells; B1, representative Transwell assay results; B2, statistical analysis of for the invasion ability; *P<0.01;n=3
8 miR-130a促进乳腺癌细胞EMT
Western blot检测显示:MCF-7细胞中转染miR-130a过表达质粒后,间质表型蛋白vimentin水平显著升高,上皮表型蛋白E-cadherin水平显著下降;然而,同时过表达G3BP2后,miR-130a升高vimentin水平和降低E-cadherin水平的作用消失。由此表明,miR-130a可通过靶向G3BP2促进乳腺癌细胞发生EMT(图8)。
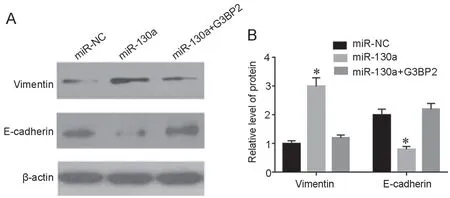
图8 miR-130a通过靶向G3BP2促进乳腺癌细胞EMT。A,miR-130a对MCF-7细胞EMT标志蛋白水平影响的代表性Western blot检测;B,miR-130a对MCF-7细胞EMT标志蛋白水平影响的统计学分析;与miR-NC组比较,*P<0.01;n=3Fig. 8 miR-130a promotes EMT of breast cancer cells by targeting G3BP2. A, representative Western blot images of the effect of miR-130a on the expression of EMT marker proteins in MCF-7 cells; B, statistical analysis for effect of miR-130a on the expression of EMT marker proteins in MCF-7 cells; *P<0.01, compared with miR-NC; n=3
讨 论
乳腺癌是世界范围内女性最常见的恶性肿瘤,严重危害女性身心健康。有研究表明20%~30%的患者在早期就会有远处转移。所以抑制乳腺癌的侵袭转移是提高乳腺癌患者治疗效果,降低全球乳腺癌死亡率的关键[5]。而上皮间质转化(EMT)被认为是导致乳腺癌侵袭转移最重要的原因之一。
EMT已被证实可促发癌细胞的局部浸润和癌症的全身散播,是胚胎发育的重要特征。上皮细胞失去上皮特性获得间质特性,表现为细胞间黏附性减弱而运动性增强,并且细胞间连接和细胞极性均发生异常[6]。EMT是肿瘤细胞迁移、侵袭活性增强的重要标志。诸多基因介导的乳腺癌侵袭转移都是通过促进EMT发挥作用,如Raptor[7]、NUAK1、Prrx2[8]、CDH1[9]等。乳腺癌EMT的发生需要多个相互关联的信号转导通路和胞外信号分子共同调节[10]。目前,有多种因子如Snail、Slug、SIP1及Twist被发现与EMT相关蛋白的表达调控相关,是EMT相关转录因子、E-钙粘蛋白表达抑制因子,能够下调E-cadherin表达[11]。
G3BP(RasGAP SH3 domain binding protein)是一种 RasGAP SH3结构域特异性结合蛋白,属于RNA 结合蛋白家族,它们参与 Ras下游信号通路。G3BP具有核酸内切酶、DNA解旋酶活性,能够诱导应急颗粒的形成,参与多种细胞生长、分化、凋亡和 RNA代谢的信号通路。在哺乳动物细胞中至少有 2种 G3BP: G3BP1、G3BP2,G3BP2又包括两种亚型G3BP2a 和 G3BP2b, 它们由两个不同的基因编码[12]。G3BP1在乳腺癌[12]、肺癌[13]中被证实能促进肿瘤的侵袭和迁移。然而G3BP2 能够结合TWST1阻止其进入细胞核间接发挥抑制EMT相关蛋白转录的作用,G3BP2通过抑制EMT的产生抑制了乳腺癌的侵袭和转移。G3BP2在对维持乳腺癌细胞亚群的长期增殖特性具有重要作用[14]。然而G3BP2抑制EMT的作用是否受miRNA的调控,尚未有研究报道。
我们的研究首次证明了miR-130a靶向作用G3BP2促进乳腺癌细胞侵袭。首先证实G3BP2在高侵袭乳腺癌细胞系表达水平降低,印证了Wei等证实的G3BP2结合TWST1抑制乳腺癌细胞侵袭。进而检测了G3BP2的预测靶调节miRNA(miR-130a)的表达水平,证实miR-130a与G3BP2表达呈负相关。我们通过转染miR-130a、miR-130a-inhibitor及相应阴性对照到MCF-7、MDA-MB-231细胞,发现miR-130a 可以降低 G3BP2蛋白表达。miRNA下调基因表达是通过部分互补结合转录后目的mRNA 3’UTR的区域,导致mRNA的降解或抑制翻译[15],通过靶向性结合癌基因或抑癌基因发挥抑制或促进肿瘤进展和转移的作用[16]。为了证实这一机制,我们应用qRT-PCR检测转染后细胞内G3BP2 mRNA,发现miR-130a高表达或抑制后,G3BP2的mRNA水平并无明显改变。而荧光素酶报告基因实验显示:过表达miR-130a的乳腺癌细胞pGL3-G3BP2-3’UTR荧光素酶活性明显受抑制,抑制miR-130a表达的MDA-MB-231细胞的荧光素酶活性反而增强。进一步证实了miR-130a通过与G3BP2的3’UTR靶向结合,在翻译水平抑制G3BP2的翻译。细胞侵袭实验表明:miR-130a促进乳腺癌细胞的侵袭能力。我们进而检测了在MCF-7中过表达miR-130a以及与G3BP2共转染后,上皮、间质蛋白标记物的改变,证实了miR-130a通过结合G3BP2促进乳腺癌细胞发生EMT。
综上可见,miR-130a可通过靶向结合G3BP2 3’UTR促进乳腺癌的EMT和侵袭能力,miR-130a可以作为抑制乳腺癌侵袭、治疗乳腺癌的新靶点。但miR-130a在临床患者手术切除标本中的表达情况,以及与分期、分级、远处转移以及预后相关性等临床病理参数需要我们进一步研究。
