干扰miR-135a减轻非酒精性脂肪肝的细胞变性和肝功能损害
2021-09-04岳明强张光文王昕红朱斌郜庆祖王天宝魏晓霞
岳明强,张光文,王昕红,朱斌,郜庆祖,王天宝,魏晓霞
(新乡医学院第一附属医院感染科,卫辉 453100)
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是临床常见的肝病之一[1,2],其重要的特征是肝细胞中脂质异常积累,发病原因包括超重和肥胖、胰岛素抵抗以及氧化应激等[3,4]。普通成人NAFLD患病率10%~30%[5],非酒精性脂肪性肝病可直接导致肝硬化、肝细胞癌并影响其他慢性肝病的进展,NAFLD患者10年内肝硬化发生率高达25%[6]。
微小RNA(microRNA, miRNA)是一种小的内源性非编码单链RNA,可调节基因表达[7]。miRNA在包括器官发育和分化、细胞死亡和增殖在内的各种生物学过程中以及在包括癌症在内的各种疾病中发挥重要作用[8-10]。研究表明,一些miRNAs在NAFLD的进展过程中具有重要的调节作用[11,12],其中miR-135a对NAFLD的作用尚未明晰。因此,本研究使用棕榈酸 (palmitic acid, PA)诱导的细胞NAFLD模型和高脂饮食(high fatty diet, HFD)诱导的小鼠NAFLD模型来评估miR-135a对NAFLD的影响。
材料与方法
1 试剂
PA购自于美国Sigma-Aldrich公司;人原代肝细胞复苏培养基与贴壁培养基、胎牛血清(FBS)购自美国Gibco公司;化学合成的miR-135a-inhibitor(135a-Inh)及对应的miR-NC(135a-NC)、慢病毒包装的LV-anti-miR-Con(anti-miR-Con)、LV-antimiR-135a(anti135a)由江苏硕世生物科技有限公司合成,其中LV-anti-miR-con、LV-anti-miR-135a分别携带Tomato标记基因;甘油三酯以及胆固醇检测试剂盒购自美国Promega公司。TRIzol试剂购自于北京索莱宝生物公司;逆转录试剂盒、SYBR GreenⅠ试剂盒购自日本Takara公司;小鼠血清甘油三酯、胆固醇、谷草转氨酶(glutamic-oxaloacetic transaminase,AST)、谷丙转氨酶(alanine transaminase, ALT)、碱性磷酸酶(alkaline phosphatase, ALP)以及总胆红素(total bilirubin, TBIL)检测试剂盒购于南京建成生物研究所;Masson染色试剂盒、尼罗红染色试剂盒购自南京森贝伽生物公司;HE染色试剂盒、油红O染色试剂盒购自广州赖德生物公司。
2 临床样本
10例经超声影像学检查为中度以上的男性NAFLD患者(患者自述无饮酒史或每周少于140g)和10例经超声影像学检查未见肝部明显异常的身体健康的男性志愿者纳入本研究。所有参与实验的受试者均通过静脉采血获得血液样本,3000r/min离心5min,分离血清。本研究获得了新乡医学院第一附属医院伦理委员会批准,且所有受试者均对本研究知情并同意参与本研究。
3 细胞培养
人源原代肝细胞由中国科学院(上海)生物化学与细胞生物学研究所提供。细胞采用人原代肝细胞复苏培养基复苏后,接种在含10%FBS和1%青霉素抗生素的人原代肝细胞贴壁培养基中,置于37°C、5%CO2的细胞孵育箱中培养。取第3~6代的细胞用于后续细胞转染与PA处理。
4 细胞转染
将细胞种植于6孔板中,待细胞贴壁后,采用Lipofectamine 2000试剂在无血清培养基条件下,分别将miR-135a-inhibitor或miR-NC转染细胞,6h后更换含10%FBS和1%青霉素抗生素的人源原代肝细胞贴壁培养基继续培养48h。
5 细胞处理
用25、100和400μmol/L PA处理未转染的细胞48h或用400μmol/L PA处理已转染miR-135a-inhibitor或miR-NC的细胞48h,收集细胞用于RT-qPCR检测miR-135a表达水平。
6 细胞尼罗红染色
取已或未转染的人源原代肝细胞,400μmol/L PA处理48h后,用尼罗红法测定原代肝细胞的脂质含量。用PBS洗涤细胞两次,然后用3.7%甲醛固定10 min,用尼罗红和DAPI溶液孵育3min。随后用PBS洗涤并用荧光显微镜测定荧光。使用Image Pro Plus软件对荧光进行定量。脂质含量用尼罗红染色的荧光值表示。
7 实验动物及分组处理
40只8周雄性C57BL/6J小鼠(22.5±3g)购买自河南省实验动物中心,动物生产可许证号SCXK(豫)2017-0001 ,实验动物均饲养在新乡医学院SPF级动物房内,室温23±1℃,昼夜循环12h。10只小鼠(对照组)采用标准饮食(standard diet,STD;含15%脂肪的饲料)饲养10周。30只小鼠采用HFD(含58%脂肪的饲料)饲养6周后,分为单独HFD亚组、HFD+LV-anti-miR-con亚组和HFD+LV-antimiR-135a亚组,每亚组10只小鼠,上述各亚组在进行注射处理后继续HFD饲养4周;其中LV-antimiR-135a和HFD+LV-anti-miR-135a亚组小鼠分别通过尾静脉注射LV-anti-miR-con(2×107TU,100μl)或LV-anti-miR-135a(2×107TU,100μl)。所有小鼠在上述整个饲养方案中均自由饮食饮水。本实验通过新乡医学院动物伦理委员会审查。
8 小鼠血液生化指标检测
第10周末,每只小鼠通过心脏穿刺采血1.5ml,并3000r/min离心5min,分离血清。按照试剂盒说明书步骤,检测血清中甘油三酯、胆固醇、ALT、AST、ALP 和TBIL水平。
9 肝病理组织学分析
第10周末,麻醉小鼠,解剖分离小鼠肝。肝组织采用电子天平称重后,固定于4%福尔马林缓冲液中,24h后进行石蜡包埋处理。按照文献[13]方法,取肝组织切片分别用HE、Masson和油红O染色后,观察其病理形态学变化。
10 qRT-PCR
取人血清样本、PA处理的细胞、小鼠血清和肝组织,采用TRIzol试剂提取总RNA,各样本总RNA经逆转录试剂盒转为cDNA。然后以采用SYBR GreenⅠ试剂盒、cDNA和miR-135a引物进行qRTPCR分析。以U6为内参照,miR-135a采用2-ΔΔCt法进行量化分析。
11 统计分析
数据表示为平均数±标准误,使用SPSS17.0统计分析软件包对数据进行分析。俩组数据采用成组t检验;多组数据采用单因素方差分析后,多重比较下采用Fisher’s最小显著差异法(Fisher’s Least Significant Difference,LSD)进行比较。P<0.05认为有统计学差异。
结 果
1 NAFLD患者血清和NAFLD实验模型中miR-135a表达上调
NAFLD患者血清中miR-135a的表达水平明显高于健康对照组(图1A)。在细胞实验中,与对照组比较,在PA处理组中miR-135a表达水平随着PA浓度升高而逐渐升高,在100μmol/L及400μmol/L的浓度下具有统计学差异,且400μmol/L差异更明显(图1B)。随后在动物学实验中发现,由HFD诱导法构建的NAFLD小鼠的血清及肝组织中miR-135a的表达水平也明显高于对照组(STD小鼠)(图1C、D)。
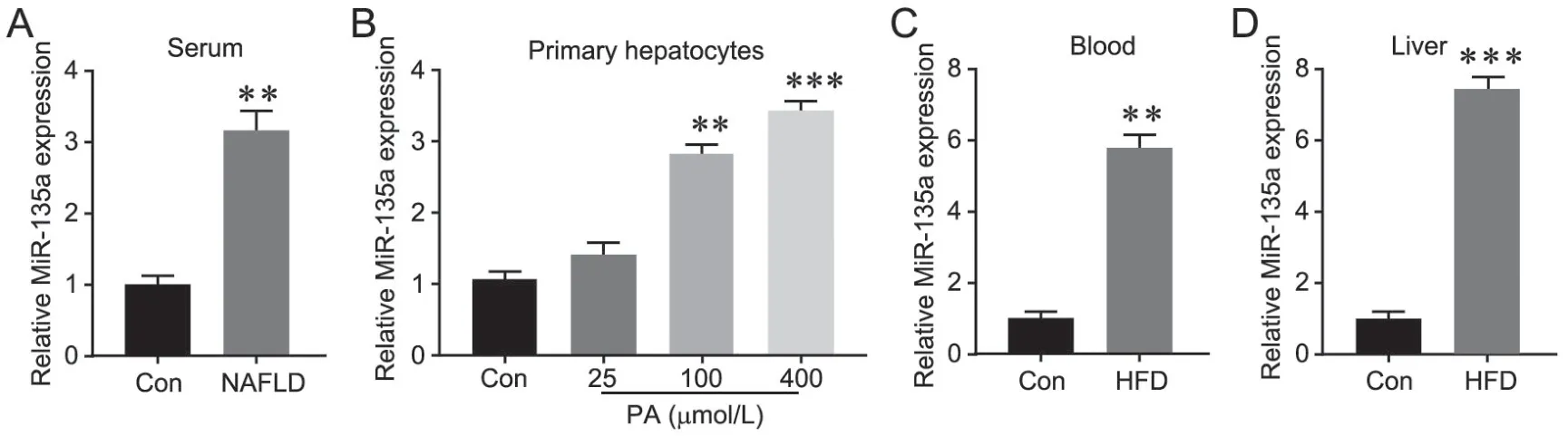
图1 miR-135a在NAFLD患者血清(A)、PA处理肝细胞(B)、HFD诱导法构建的NAFLD小鼠的血清及肝中的表达水平。与对照组比较:**P<0.01,***P<0.001;n=10Fig.1 The expression level of miR-135a in serum of NAFLD patients (A), hepatocytes treated with PA (B), serum (C) and liver tissues (D) of HFD induced NAFLD mice. **P<0.01, ***P<0.001 vs control group; n=10
2 抑制miR-135a减少PA引起的肝细胞中脂质蓄积
qRT-PCR检测显示,miR-135a inhibitor能显著抑制400μmol/L PA对肝细胞miR-135a表达的上调(图2A)。用尼罗红染色法观察转染miR-135a inhibitor对PA处理的肝细胞中脂质含量的影响, 400μmol/L PA处理后的肝细胞其荧光强度相比于对照组明显升高;而转染miR-135a inhibitor后,其荧光强度相比于PA处理组或PA+miR-135a-NC组明显降低(图2B、C)。实验结果说明,干扰miR-135a表达可显著降低PA处理后肝细胞的脂质蓄积。
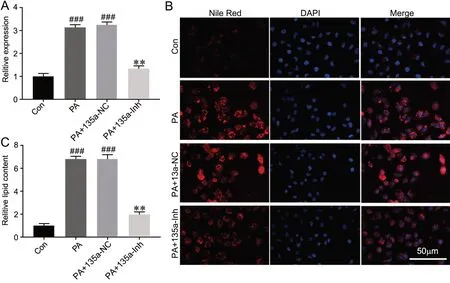
图2 干扰miR-135a对PA诱导的肝细胞脂质累积的影响。A,PA和miR-135a inhibitor对肝细胞中miR-135a表达影响的qRT-PCR检测。B,尼罗红染色检测PA和miR-135a inhibitor对肝细胞中脂质水平的影响(比例尺=50μm)。C,脂质含量的半定量与统计学分析。与对照组比较:###P<0.001;与PA+ 135a-NC组比较:**P<0.01;n=4Fig. 2 Effect of interfering miR-135a on the PA-induced lipid accumulation in hepatocytes. A, effect of PA and miR-135a inhibitor on miR-135 expression of hepatocytes detected by qRT-PCR. B, representative images of Nile Red staining for examining the effect of PA and miR-135a inhibitor on lipid content in hepatocytes (scale bar=50μm). C, semi-quantitative and statistical analysis of lipid content in hepatocytes. ###P<0.001 vs control group;**P<0.01 vs PA+ 135a-NC group; n=4
3 抑制miR-135a逆转HFD小鼠肝的损伤及脂肪沉积
对小鼠肝组织进行切片检测显示,外源性LV-antimiR-135a在小鼠肝转染成功(图3A),表达出了携带的荧光蛋白tomato(图3A)。HE染色显示,HFD小鼠和HFD+LV-antimiR-con小鼠肝组织其微泡脂肪变性程度明显高于对照组;而在HFD+LV-antimiR-135a小鼠的肝组织中,其微泡脂肪变性程度明显低于HFD组以及LV-antimiR-con组(图3B)。
Masson染色显示,HFD小鼠和HFD+LV-antimiR-con小鼠肝组织纤维沉积高于对照组;而HFD+LV-antimiR-135a小鼠的肝组织中,其纤维沉积程度明显低于HFD组以及LV-antimiR-con组(图3C)。油红O染色显示,HFD小鼠和HFD+LV-antimiR-con小鼠肝组织脂质沉积高于对照组;而HFD+LV-antimiR-135a小鼠的肝组织中,其脂质沉积程度明显低于HFD组以及LV-antimiR-con组(图3D)。
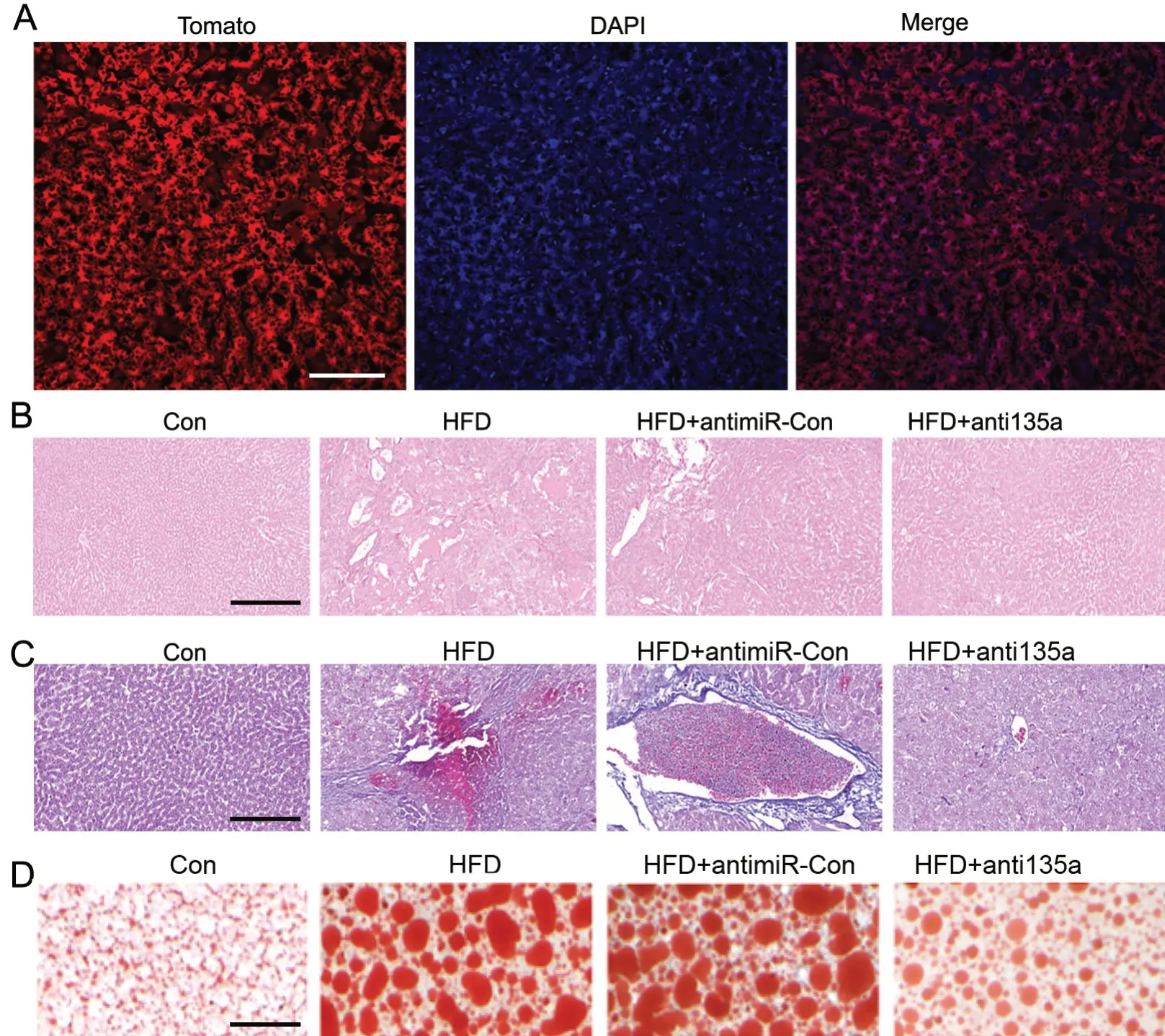
图3 抑制miR-135a对HFD小鼠肝组织学的影响。A,LV-antimiR-135a转染肝组织效果荧光显微镜观察(比例尺=100μm);B,HE染色(比例尺=500μm);C,Masson染色(比例尺=250μm);D,油红O染色(比例尺=200μm)Fig. 3. Effect of interfering miR-135a on the liver histology in HFD-fed mice. A, fluorescence microscopic examination of LV-antimiR-135a infection efficiency (scale bar=100μm); B, HE staining (scale bar=500μm); C, Masson staining (scale bar=250μm) ; D, Oil red O staining (scale bar=200μm)
4 抑制miR-135a逆转HFD小鼠肝脂质代谢相关基因的表达
为进一步确定干扰miR-135a后对肝脂质代谢的影响,本研究检测了HFD小鼠肝重量、脂质含量以及血清中甘油三酯以及胆固醇的含量。结果发现,HFD小鼠和HFD+LV-antimiR-con小鼠肝重量(图4A)、脂质含量(图4B)、血清中甘油三酯(图4C)及胆固醇(图4D)的含量明显升高;而与HFD小鼠和HFD+LV-antimiR-con小鼠相比,抑制miR-135a表达后,小鼠上述4项指标明显下降(图4)。结果说明HFD显著损伤小鼠肝细胞的正常脂质代谢,而抑制miR-135a表达能够显著逆转这些改变。
5 抑制miR-135a逆转HFD小鼠肝损伤的生化指标
为了探讨miR-135a对HFD后肝损伤的影响,继而检测了HFD小鼠血清中AST、ALT、ALP以及TBIL的含量。结果显示,HFD组和HFD+LV-antimiR-con小鼠血清中ALT(图4A)、AST(图4B)、ALP(图4C)以及TBIL(图4D)含量相比与对照组明显升高;而在转染LV-antimiR-135a后,小鼠血清中上述4项指标相比与HFD组和HFD+LV-antimiR-con明显下降(图4)。由此说明LV-antimiR-135a能够显著逆转HFD导致的肝功能损伤。
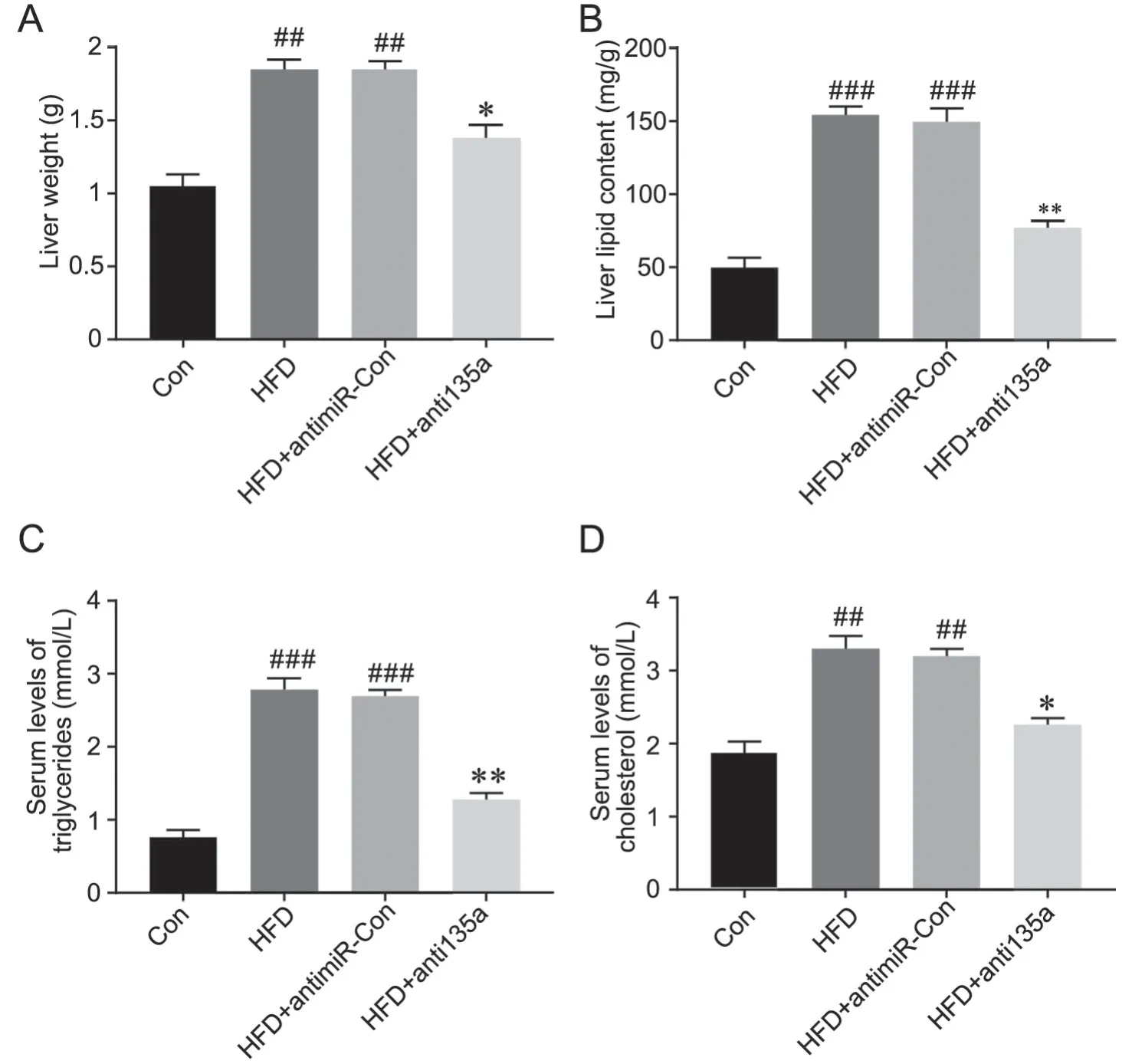
图4 抑制miR-135a对HFD小鼠脂质代谢的影响。A,小鼠肝重;B,小鼠肝脂质含量;C,小鼠血清中甘油三酯含量;D,小鼠血清中胆固醇含量。与对照组比较:##P<0.01,###P<0.001;与HFD+LV-antimiR-con组比较:*0.01 在过去20多年中,NAFLD在全球的发病率不断上升,在全世界的患病率为25.24%[14]。我国近十年NAFLD患病率大幅增长,流行病学调查显示我国NAFLD患病率高达26%~45%,已经取代慢性病毒性肝病成为我国慢性肝病之首[15]。现有的研究发现,超重、高血压、血脂紊乱、胰岛素抵抗等能够增加NAFLD发病的风险[16]。 非编码RNA是一种内源性的、短的(19-25个核苷酸)RNA序列,与靶基因mRNA的3′-UTR结合,在转录后水平上负性调节基因表达。越来越多的研究表明,非编码RNA在NAFLD的发展中起到重要作用[17-19]。在本研究中,我们发现NAFLD患者血清中miR-135a水平明显升高。随后在PA处理的肝细胞及HFD动物实验中也验证了这些变化。为了进一步验证miR-135a在NAFLD中的作用,我们将miR-135a inhibitor转染到高脂环境(PA处理)下培养的肝细胞以及HFD小鼠中转染LV-anti- miR-135a,发现抑制miR-135a的表达后,高脂环境下培养的肝细胞其脂质水平明显下降,HFD小鼠肝组织脂肪变性程度相比于对照组明显下降。 血液中甘油三酯、胆固醇的含量是衡量肝脂肪代谢的重要指标。我们通过血液检测发现,转染LV-antimiR-135a的小鼠,其血液中甘油三酯、胆固醇含量明显下降。肝功能的损伤是NAFLD的症状之一,临床上NAFLD往往伴有明显的肝功能异常。随后检测了HFD小鼠相关肝功能血液指标,结果显示:干扰miR-135a的表达后能显著降低血液中ALT、AST、ALP以及TBIL的水平。以上数据证明干扰miR-135a表达可改善HFD小鼠脂肪代谢和肝功能。这些改变是以为干扰了miR-135a后直接引起的,还说由于此非编码RNA下游的调节机制引起的改变还需要进一步研究。 综上,本研究结果说明NAFLD中miR-135a表达明显升高,干扰其表达可以降低NAFLD引起的肝损伤和脂肪代谢异常,抑制体内miR-135a表达水平可能是潜在的NAFLD治疗的新途径之一。 图5 干扰miR-135a对HFD小鼠肝功能的影响。A,小鼠血清中ALT含量;B,小鼠血清中AST含量;C,小鼠血清中ALP含量;D,小鼠血清中TBIL含量。与对照组比较:##P<0.01;与HFD+LV-antimiR-con组比较:**P<0.01;n=10讨 论
Fig. 5 Effect of interfering miR-135a on the liver function of HFD-fed mice. A, serum ALT content of mice; B, serum AST content of mice; C, serum ALP content of mice; D, serum TBIL content of mice.##P<0.01vscontrol group; **P<0.01vsHFD+LV-antimiR-con group;n=10
